肺血管病右心导管术操作指南
国家心血管病中心肺动脉高压专科联盟,国家心血管病专家委员会右心与肺血管病专业委员会
肺血管病是肺动脉、肺静脉及肺毛细血管的结构和(或)功能出现异常的肺循环疾病总称,严重者可引起肺动脉高压、右心衰竭,甚至死亡。肺动脉高压是以肺动脉压力升高为特征的一种异常的血流动力学状态和病理生理综合征,其病因复杂,病情进展迅速,如不及早诊断和尽早治疗,患者远期预后不佳[1]。右心导管术是一种将心导管经外周静脉送入右心系统,从而测定血流动力学及各部位血氧动力学参数的导管技术,是了解肺循环状态(如肺动脉压力、心输出量等)的重要手段,也是唯一能够提供肺循环准确资料的方法。1945 年心导管首次用于直接测量肺动脉压力,这标志着人类开始从血流动力学的角度认识肺动脉高压。我国最早的右心导管术始于1951 年,北京协和医院黄宛教授留美归来后,使用国外带回作为示范用的两根6 F、7 F 导管和自制的血氧测定仪成功完成了我国第一例右心导管术,并于1953 年首次将右心导管术的经验体会在国内医学杂志上发表[2],把右心导管技术及时推向全国,奠定了我国现代心脏介入诊疗技术的基础。随后,右心导管术在中国经历了长期的技术普及和推广,不仅成为肺血管病诊断、评价及治疗效果监测的关键检查手段,更被广泛应用于麻醉及危重症医学领域。不同学科、不同专业因右心导管术的目的不同而存在不同侧重点。然而,在右心导管术和操作方面,目前国内外仅有少数心血管疾病介入和治疗指南或共识中简要介绍相关内容,尚无针对肺血管病右心导管术具体应用的共识性、指导性文件发布,因此,在临床实践过程中,不同医院、不同专业右心导管术的普及程度和规范化水平存在较大差异。
为进一步推广右心导管术在肺血管病诊治中的应用,提高右心导管术的规范性和安全性,对术前准备、血管通路、导管操作、结果分析和报告书写等多个环节进行质量控制,国家心血管病中心肺动脉高压专科联盟和国家心血管病专家委员会右心与肺血管病专业委员会组织多学科专家,通过检索PubMed、Cochrane Library、Embase、中国期刊全文数据库、中文科技期刊数据库和万方数据库等,结合国际研究进展和国内实际经验,经专家委员会讨论,制定《肺血管病右心导管术操作指南》,旨在进一步规范右心导管术在肺血管病、肺动脉高压诊治中的应用。
1 适应证[3-4]
(1)肺动脉高压的定性和定量诊断;(2)筛查肺动脉高压的病因;(3)获取动脉型肺动脉高压危险分层的血流动力学参数;(4)进行急性肺血管反应性试验;(5)先天性心脏病合并肺动脉高压患者术前评估;(6)肺移植或心肺联合移植患者术前肺血流动力学评估;(7)肺动脉高压患者的治疗随访。
2 禁忌证[5-7]
如果病情需要进行右心导管术检查,特别是采用漂浮导管检查指导危重症患者救治时,并无绝对禁忌证,但对于择期右心导管术检查的肺血管病患者,以下情况应视为右心导管术的相对禁忌证:(1)急性感染性疾病;(2)三尖瓣或肺动脉瓣机械瓣置换术后;(3)右心腔或主肺动脉内漂浮血栓;(4)电解质紊乱;(5)严重恶性心律失常;(6)完全性左束支阻滞(有临时起搏器保驾除外);(7)重症肺动脉高压右心衰竭失代偿期;(8)严重凝血功能障碍;(9)近期植入起搏器或除颤器;(10)严重肝肾功能不全;(11)妊娠;(12)不能配合进行右心导管术者。
3 术前准备
术前完善血常规、肝肾功能、电解质、凝血功能、传染病等必要的常规化验以及相关的影像学检查。与患者及家属谈话交代右心导管术的必要性、操作流程和可能出现的意外情况,取得知情同意并签字。
器材准备:(1)穿刺针、5 F~8 F 血管鞘;(2)常用导管包括5 F~6 F 猪尾导管、Swan-Ganz 导管、端孔导管等;常用导丝为150 cm 长、0.035 英寸、0.025英寸“J”形头导丝或普通泥鳅导丝;(3)多导生理记录仪;(4)血气分析仪;(5)附加试验所需药物:如依前列醇、一氧化氮或伊洛前列素等;(6)抢救设备:电除颤仪、简易呼吸器、供氧设备、简单的手术器械及心包穿刺器械等。
4 右心导管术入路的选择
常用的右心导管术入路包括股静脉、颈内静脉、肘静脉和锁骨下静脉。应根据患者的具体病情、设备配置和医务人员的技术熟练程度综合考虑,选择适宜的入路,提高检查成功率、减少并发症。
(1)股静脉穿刺技术简单容易成功,但是Swan-Ganz 导管不易进入肺动脉,需要在导丝的指引下进入。对于下腔静脉、髂静脉及股静脉内存在血栓的患者宜避开选用其他入路。
(2)颈内静脉穿刺:右侧颈内静脉离右心房距离近,穿刺成功后易将导管送至理想位置。颈内静脉穿刺不适用于过度肥胖及有出血倾向者。
(3)锁骨下静脉穿刺:常选用左锁骨下静脉,该处易于消毒,便于固定,适用于需长时间血流动力学监测者。由于解剖位置比较固定,可用于相对肥胖者。但此穿刺法不适用于肺气肿患者,易造成气胸、血气胸。
(4)肘静脉穿刺:出血风险小,可用于不能平卧的患者。易引起血管痉挛,有时不易进入锁骨下静脉而使检查失败。
5 操作过程
5.1 准备工作
患者仰卧位,建立外周静脉通路。连接心电监护仪,连接压力传感器。连接三通管、压力延长管、传感器,并以肝素生理盐水冲洗、排气,保证各部位连接严密和通畅,并避免气泡堵塞导管影响压力测定。调节压力零点:患者平卧时零点水平常用的标志点为仰卧位第4 肋间隙前胸壁至操作床面中点[8-10]。选择合适的静脉穿刺部位,常规消毒,铺巾。肝素生理盐水预冲洗导管及Swan-Ganz 球囊导管、导丝、血管鞘,并检查Swan-Ganz 球囊密闭性。临床上常在每500 ml 生理盐水中添加6 250 U 肝素钠配制冲洗液,浓度为12.5 U/ml。
5.2 静脉穿刺
穿刺部位以1%~2%利多卡因局部麻醉。采用Seldinger 技术穿刺静脉,穿刺成功后在穿刺针内置入导丝,沿导丝送入血管扩张鞘和外鞘,随后撤除导丝及血管扩张鞘,保留外鞘,以肝素盐水冲洗鞘管抗凝。
5.3 导管操作及各部位取血测压
将导管经鞘管送入(不同部位穿刺放置漂浮导管深度参考值如表1 所示),在导丝引导下将心导管依次送至上、下腔静脉、右心房、右心室、主肺动脉、左肺动脉、右肺动脉,测量各部位压力并取血做血气分析。采股动脉血测定股动脉血氧饱和度。经导管抽血测定血氧饱和度时,为确保结果的准确性,在每个部位取血前先抽取2~4 ml 导管内血液弃掉,再抽取1~2 ml 血样送检。各腔室取血部位如图1 所示。当上腔静脉或下腔静脉血氧饱和度异常增高时可增加两个取血部位:高位上腔静脉即上腔静脉与无名静脉交叉处和低位下腔静脉即腰椎L5 水平,可以获取更多的信息量,减少因层流造成的误差。否则,当心房水平左向右分流血液混入腔静脉血标本时可造成漏诊。
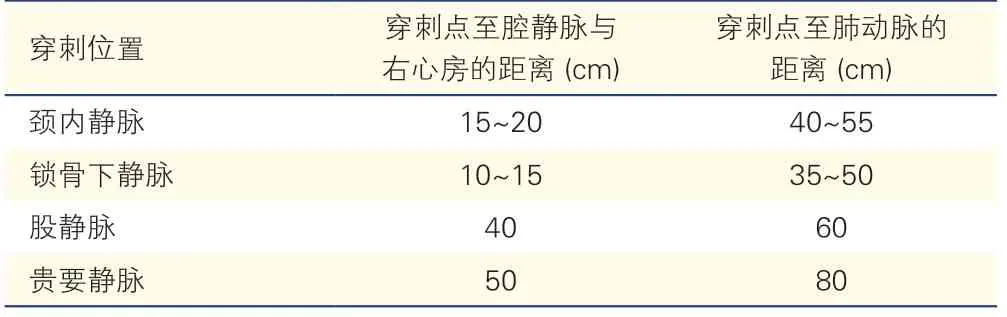
表1 不同部位穿刺放置漂浮导管深度参考值

图1 经导管测定血氧饱和度时的取血部位
5.3.1 连续测压
测压状态下将导管头端由主肺动脉缓慢匀速回拉至右心室流出道、右心室室中、右心室流入道。观察测定肺动脉瓣上、瓣下,肺动脉至右心室流出道、右心室室中、右心室流入道是否存在压力阶差,一般认为收缩压差>10 mmHg(1 mmHg=0.133 kPa)有血流动力学意义。
5.3.2 肺动脉楔压(PAWP)测定
将Swan-Ganz 导管经鞘管送入右心房,充气使球囊充盈。顺着血流方向将漂浮导管依次送入右心室、肺动脉,楔入肺动脉远端。测定PAWP 的注意事项:透视下确定导管头端嵌顿于肺动脉远端,压力波形呈现明确的A 波和V 波(心房颤动患者除外),有呼吸起伏波形,部分患者顶端可抽出肺静脉血,测得的PAWP 数值不高于肺动脉舒张压。记录3~5 个正常呼吸末(避免屏气或做Valsalva 动作)的均值作为PAWP;当PAWP 波形受呼吸影响较大时,推荐多导生理记录仪自动描记的平均PAWP[11]。
5.3.3 心输出量测定
目前常用的心输出量测定方法有两种:Fick 法和热稀释法。Fick 法的主要原理是:某个器官对一种物质的摄取或释放,是流经这个器官的血流量和动静脉血中这种物质差值的乘积,基于此原理在测定血氧饱和度后计算心输出量。热稀释法通过漂浮导管右心房孔注射一定量低于血温的液体,位于肺动脉处的热敏电阻感知温度变化,经电脑计算出心输出量。心内分流性先天性心脏病患者,优选Fick法计算心输出量;无心内分流患者可以采用热稀释法直接测定心输出量[12]。
热稀释法直接测定心输出量时漂浮导管顶端必须位于主肺动脉内,才能获取准确的心输出量。如果是床旁进行漂浮导管检查,可以通过右心房压力波形和肺动脉压力波形来确保导管近端口在右心房内,远端口在肺动脉内。在4 s 内将10 ml 冷生理盐水快速平稳地注射到漂浮导管的近端腔(位于右心房)内,两次注射需间隔70 s 以上,由一个人操作,取相差不大于10%的3 个值的平均数为心排血量测定值。注意热稀释法测定心排量时,不同型号的漂浮导管常数不同,要把正确的常数输入到仪器中。
5.4 急性肺血管反应性试验
特发性肺动脉高压、遗传性肺动脉高压、药物相关肺动脉高压患者首次进行右心导管术时,如病情相对平稳应进行急性肺血管反应性试验,以筛选出适合长期应用钙拮抗剂(CCB)治疗的肺动脉高压患者。
在获取血流动力学基线数据后,给予急性肺血管反应性试验用药物,当用药剂量达到目标剂量或出现低血压、严重心动过缓、头晕、胸闷、四肢麻木等不良反应时终止试验,并复测肺动脉压力、心排量等血流动力学参数。推荐试验药物如表2 所示[10]。

表2 急性肺血管反应性试验药物用法
5.5 肝静脉压力梯度测定
当肺动脉高压患者同时合并肝脏疾病时,为明确是否存在门静脉高压相关性肺动脉高压,可行肝静脉压力梯度测定。肝静脉压力梯度是肝静脉楔压和肝静脉自由压之间的差值。透视下将球囊导管送至肝静脉,在距离下腔静脉2~4 cm处,等待至少20 s,压力数值稳定后,读取肝静脉自由压。注入空气使球囊扩张以充分阻断肝静脉血流,等待至少40 s,压力数值稳定后,读取肝静脉楔压。测定肝静脉楔压时注意保持球囊扩张状态,嘱患者屏住呼吸,经球囊导管缓慢注入5 ml 对比剂行肝静脉造影检查,确认无对比剂反流或静脉-静脉侧支分流[13]。
5.6 右心导管术后常规
右心导管术所有检查结束后撤出导管和鞘管,穿刺部位压迫止血、包扎,股静脉穿刺术后需卧床4~6 h。返回病房,测量血压、心率,复查心电图、血常规、肝肾功能、电解质。密切观察生命体征、穿刺部位出血、血肿、动静脉瘘、假性动脉瘤等情况。
5.7 肺动脉高压患者右心导管术过程中的注意事项
(1)气泡:操作过程中气泡可能在管道连接的过程中混入,即使极小的气泡也会造成压力测量错误。因此,需要注意及时排气。
(2)零点水平和定标错误:右心导管术时零点水平非常重要,右心房压、右心室压、肺动脉压和PAWP 的正常值低,测定值受零点水平影响大。调零时需注意零点不是换能器压力膜的水平位置,而是所用三通或延长管末端的位置。三通或延长管内有气泡时可致零点水平不准[3]。检查过程中患者体位变化或导管检查床升降时,零点水平也必须相应调整。
(3)肺动脉内导管的位置变化:肺动脉高压患者常伴肺动脉扩张或肺动脉瓣关闭不全,导管远端位置易发生变化。在进行持续压力监测时,需要根据波形调整导管位置。
6 并发症
右心导管术总体安全性较好,严重并发症发生率低[14-15]。但肺血管病特别是肺动脉高压患者因右心扩张、三尖瓣反流、肺动脉增宽等原因,使操作难度增加,术中易发生并发症,常与技术不熟练、导管检查时间过长有关。
右心导管术操作并发症包括:
(1)穿刺并发症:局部血肿、动静脉瘘、假性动脉瘤、血气胸。
(2)心律失常:最常见。可见到各种心律失常,多与右心房室心肌应激性增高、心导管机械刺激室壁及心内结构有关,特别是操作不顺利、检查时间过长时易发生。重度右心功能不全的患者更易发生恶性心律失常。心房扑动、心房颤动以及室性心动过速患者如血压不稳定应及时电复律,维持血压。此外,右心导管术可引发右束支阻滞,因此,存在完全性左束支阻滞的患者要警惕心脏骤停的发生,必要时在临时起搏器保驾下完成检查。
(3)急性肺水肿、心力衰竭:较少见。往往见于重度肺动脉高压、右心高度增大、病情不稳定的患者。多与术中患者精神过度紧张和并发的各种心律失常有关。应及时撤出心导管,停止检查。头部垫高给予氧气吸入,同时给予呋塞米等药物,必要时行气管内插管辅助呼吸。
(4)肺动脉穿孔、破裂:是右心导管术的罕见并发症,可导致咯血、低氧血症和休克,严重者窒息死亡,需要急请外科、介入科等多学科会诊处理。
(5)血栓形成或栓塞:多见于高凝状态患者,术中应间断用肝素生理盐水冲洗导管。
(6)迷走反射:可见于术中或术后,精神紧张、疼痛、禁食等因素诱发患者出现血压下降、脉搏细弱、出汗等症状,应及时处理,给予快速补液,静脉给予阿托品、多巴胺和扩容药物。
(7)导管打折、断裂:往往因操作不当引起,打折导管应小心解开死扣,然后取出即可。断裂的导管可应用异物钳取出。
(8)心脏穿孔和心包压塞:一旦确诊急性心脏压塞,应立即行心包穿刺术,迅速排除积液,必要时行外科心包切开引流术。
为减少操作带来的并发症,避免因导管检查造成的死亡,建议采取如下措施:(1)肺动脉高压初治患者特别是重症患者的右心导管术检查要在有经验的医学中心进行;(2)导管室应备有除颤仪、麻醉剂、起搏器、各种急救药品,并能持续监测心电和血压;(3)检查者技术要熟练,选择合适的入路,缩短检查时间;当导管推送不畅时,应使用稀释的对比剂观察导管前方相关情况,切勿盲目送管;(4)检查前尽量改善患者的心肺功能,纠正电解质和酸碱失衡等;(5)术中密切观察患者情况,一旦出现血压降低、频发室性早搏或束支阻滞、胸闷、胸痛等异常情况应及时处理,必要时中止检查。
7 结果计算与分析
7.1 血流动力学指标测量和计算
7.1.1 压力记录
记录右心房压力(A 波/V 波/平均压)、右心室压力(收缩压/舒张压/右心室舒张末期压力)、肺动脉压力(收缩压/舒张压/平均压)、PAWP。
7.1.2 氧耗量的计算
直接测定氧耗量较繁琐,临床上常用体表面积和基础热量间接推算出每分钟氧耗量,公式如下[16-17]:氧耗量 (ml/min)=基础热量[cal/(m2·h)]×209÷60×体表面积(m2)。基础热量可按年龄、体重和身高查表获得,常数209 为1 cal 热量需氧毫升数,60 为每小时换算为每分钟。
氧耗量也可以用简易公式计算获得[18]:氧耗量(ml/min)=125 ml/(min·m2)×体表面积 (m2)。
氧耗量是根据正常人年龄、性别和体表面积得到的估算值。由于患者基础代谢与正常人不同,而且有创检查带来的不适和紧张会进一步影响代谢状况,致使患者实际氧耗量与估算值不符。
7.1.3 Fick 法计算体肺循环血量[12,16-17]


(注:SvO2:混合静脉血氧饱和度;Hb:血红蛋白)
关于血氧饱和度的说明:(1)体动脉和肺动脉血氧饱和度以实测值为准;(2)SvO2[19]:由于不同途径的静脉血在肺动脉混合均匀,肺动脉血氧饱和度可反映SvO2,然而临床中常遇到患者存在心内分流的状况,肺动脉血氧饱和度受分流影响无法准确反映SvO2,因此采用以下公式计算SvO2:

(3)肺静脉血氧饱和度:导管送入肺静脉或左心房者,肺静脉血氧饱和度按实测值计算,否则需估算:当存在心内分流时,若无肺实质疾病,肺静脉血氧饱和度按98%估算;存在肺实质病变时,当体动脉血氧饱和度小于95%时,若无右向左分流,肺静脉血氧饱和度按股动脉血氧饱和度估算,若同时存在右向左分流,肺静脉血氧饱和度无法估算,建议导管经分流口至肺静脉直接测定肺静脉血氧饱和度[3,12,16-17]。
肺动脉高压患者多数伴有低氧血症,当动脉血氧饱和度<95%时如何估算肺静脉血氧饱和度并无统一标准。如不存在心内分流,采用标准热稀释法直接测定心输出量可以避免上述不足。热稀释法与间接Fick 法测定肺动脉高压患者的心输出量一致性欠佳,两种方法测定结果不能互换[20]。
心输出量正常值范围为4~8 L/min。当出现心输出量升高时,应考虑存在高血流动力学状态或心外分流,如甲状腺功能亢进症、贫血、外周动静脉分流或门体分流等。
7.1.4 全肺阻力(TPR)及肺血管阻力(PVR)的计算

(注:mPAP:平均肺动脉压)
Wood 单位(WU)=达因单位(dyn·s·cm-5)/80 (Wood)
肺血管阻力指数 (WU·m2)=PVR (WU)×体表面积 (m2)
PVR 正常值范围:47~160 dyn·s·cm-5,<2 WU。
根据《2022 欧洲心脏病学会/欧洲呼吸学会肺动脉高压诊治指南》[21],动脉型肺动脉高压血流动力学诊断必须满足mPAP>20 mmHg,PAWP ≤15 mmHg,同时PVR>2 WU。由于部分肺动脉高压患者不易测到PAWP,特别是重度肺动脉高压伴有肺动脉扩张和(或)肺动脉瓣关闭不全时,即使在X 线透视下将导管送到理想位置后也不易固定,常弹回至主肺动脉内,只能用TPR 反映PVR 的变化。在肺动脉压力正常或轻度增高者中,PAWP 对TPR 与PVR 的差别影响较大,而在中至重度肺动脉高压时影响较小,可以用TPR 反映肺动脉高压患者PVR变化的情况。当PAWP不易获取时,不建议反复尝试,反复测量PAWP 将延长导管检查时间,增加并发症的风险。
7.1.5 计算心脏指数
心脏指数[L/(min·m2)]=Qs (L/min)÷体表面积(m2),正常值范围2.5~4.0 L/(min·m2)。心脏指数是动脉型肺动脉高压危险分层的指标之一,心脏指数≥2.5 L/(min·m2)属于低危,心脏指数2.0~2.4 L/(min·m2)属于中危,心脏指数<2.0 L/(min·m2)属于高危。
7.2 血氧饱和度结果分析[3,12,16-17]
根据右心各腔室血氧饱和度可判断有无心内分流、分流方向、分流水平等。
7.2.1 左向右分流水平及分流量判断
左向右分流可发生在心房水平、心室水平、肺动脉水平和腔静脉水平。早年国内外对左向右分流的判断主要来自于分流前后血氧含量的差异,随着血气分析方法学的进展,逐渐用血氧饱和度来替代血氧含量,以降低患者Hb 含量对结果的影响,但并没有一致的标准。肺动脉高压患者右心导管术的目的之一就是除外分流性先天性心脏病,但随着肺动脉压力的升高,左向右分流逐渐减少,血氧饱和度的差异亦随之减小。因此,为减少先天性心脏病的漏诊,专家建议采用最低的血氧饱和度差异值作为标准,以指导临床医师进一步寻找肺动脉高压原因。
心房水平存在左向右分流:当右心房平均血氧饱和度较上下腔静脉高9%及以上时,除外心室水平左向右分流伴有三尖瓣关闭不全者,需考虑存在心房水平的左向右分流,常见于房间隔缺损、肺静脉异位引流入右心房、冠状动脉瘘入右心房等疾病。
心室水平存在左向右分流:当右心室平均血氧饱和度较右心房高5%及以上时,需警惕心室水平存在左向右分流,常见于室间隔缺损、主动脉窦瘤破入右心室等疾病。
肺动脉水平存在左向右分流:当肺动脉血氧饱和度较右心室高3%以上时,考虑存在肺动脉水平左向右分流,常见于动脉导管未闭、主肺间隔缺损等疾病。
腔静脉水平存在左向右分流:当腔静脉血氧饱和度异常增高时,应怀疑腔静脉水平存在左向右分流,多见于肺静脉异位引流入腔静脉,也可见位于腔静脉或髂股静脉水平的动静脉瘘。
左向右分流量的判断:通过计算Qp 与Qs 的比值(Qp/Qs)来判断分流量大小。正常时,Qp/Qs=1;1<Qp/Qs<1.5 为少量分流;1.5≤Qp/Qs<2 为中等量分流;Qp/Qs≥2 为大量分流。
7.2.2 右向左分流判断
正常人外周动脉血氧饱和度为95%~100%,如果外周动脉血氧饱和度<95%,在排除肺部疾患导致的血氧交换障碍后,应考虑存在右向左分流,低于90%时患者可出现紫绀。
7.2.3 动脉型肺动脉高压危险分层
SvO2是动脉型肺动脉高压危险分层的指标之一,SvO2>65%属于低危,SvO260%~65%属于中危,SvO2<60%属于高危[10,21]。
心脏每搏指数(SVI)=(心脏指数×1 000)÷心率,可以作为动脉型肺动脉高压危险分层的指标,SVI>38 ml/m2属于低危,SVI 31~38 ml/m2属于中危,SVI<31 ml/m2属于高危[10]。
7.3 右心导管术常见参数的正常参考值
肺血管病患者第一次进行右心导管术检查时,必须进行完整的血流动力学评估,常见参数正常值范围如表3 所示,包括直接测量获得和通过计算获得的参数。
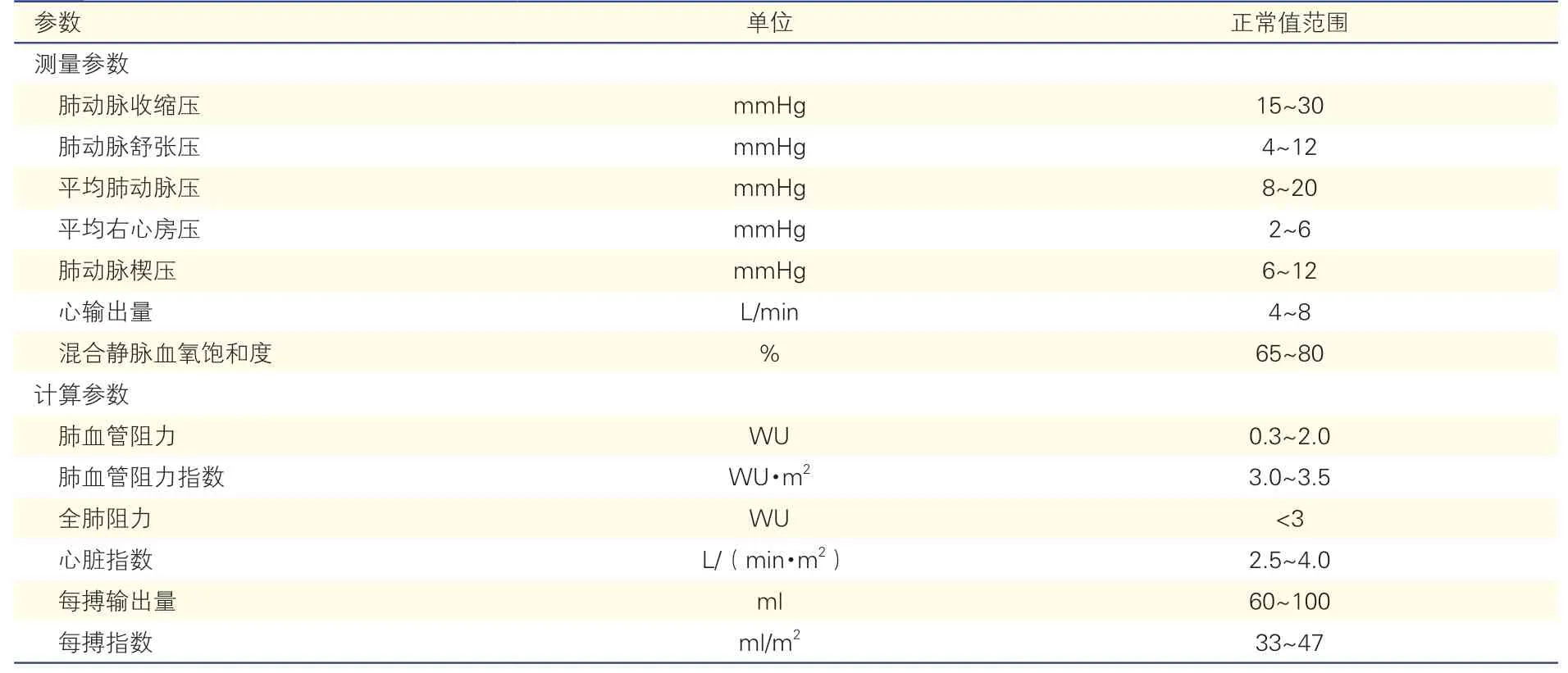
表3 右心导管术常规参数的正常值范围
7.4 急性肺血管反应性试验结果解读
目前多采用欧洲心脏病学会和欧洲呼吸学会肺动脉高压诊治指南推荐的急性肺血管反应性试验阳性标准:mPAP 下降≥10 mmHg 且绝对值≤40 mmHg,同时心输出量保持不变或增加[10]。对于基线mPAP 低于40 mmHg 的患者,支持判断阳性依据的数据极少。若患者吸药后心输出量正常的条件下mPAP 显著下降(超过20%),合理做法是进行CCB的试验治疗,并评估临床疗效[22]。
需要注意的是,急性肺血管反应性试验阳性、口服CCB 的患者,需要逐渐滴定至能够耐受的最大剂量,并在3~6 个月评价患者功能状态及血流动力学指标,以明确长期使用CCB 的有效性和安全性。
8 儿童右心导管术操作注意事项
(1)可疑肺动脉高压的儿童,尤其是初诊的患者,如无禁忌证,需要同时做右心导管术和左心导管术。
(2)由于肺动脉高压儿童右心导管术的并发症风险相对较高(1%~3%,尤其在婴幼儿和病情较重的患儿中),因此需要充分评估风险和获益,个体化决策右心导管术的适应证[23]。
(3)儿童心腔小,心脏和血管壁薄,操作过程中手法要轻柔,遇到阻力时应撤回导管,避免强行推送,严禁在端孔导管内用力推送泥鳅超滑导丝,此操作易造成心肌穿孔或动脉夹层。
(4)由于小儿在术中不能配合,操作前需要麻醉。考虑到小儿独特的解剖和生理特点,在麻醉时容易出现气道梗阻或呼吸抑制,其麻醉的首要原则是选用可以保持气道通畅、方便控制呼吸的麻醉方式,所以幼儿主要采用插入气管导管或者喉罩的全身麻醉。在非插管条件下接受镇静镇痛的患儿,应注意监测其动脉血气。对于初步评估高危的患儿,全身麻醉下行心导管检查风险高,需综合评估麻醉风险,必要时先行经验性治疗,待病情稳定后实施,建议在有经验的中心实施。
(5)存在心内或大动脉水平分流的先天性心脏病患儿,建议采用Fick 法计算Qp 或Qs,有条件可采用直接测得的氧耗量,通过公式估计的氧耗量存在误差,尤其是额外吸氧的患者。存在心内分流的患者不建议应用热稀释法测定心输出量。
(6)Fick 法测定Qp 或Qs 时,额外氧气吸入可能影响计算准确性,应尽量在室内空气环境下取血化验。在吸氧条件下测定并计算血氧含量时,应纳入物理溶解氧气量。
(7)不建议在儿童急性肺血管性反应试验中应用CCB、静脉注射依前列醇或静脉注射腺苷,可能会造成危害[24]。
(8)儿童肺血流量及阻力值受年龄及体重影响大,建议对计算所得出的数值进行体表面积的校正,以使数据更规范及具有可比性。
(9)解读小儿右心导管术报告时,需要结合患儿的基础疾病。同时,也要理解肺动脉收缩压与肺动脉舒张压之间的差异。肺动脉压力需要结合体循环压力来解读,通常用肺动脉压力与体循环压力的比值或肺动脉压力占体循环压力的百分比、肺血管阻力指数及PVR 与体循环阻力比值来反映肺血管病变严重程度。
9 右心导管术报告书写
右心导管术结束后,应撰写检查报告,报告内容详实规范,报告格式相对统一。书写报告过程中注意:(1)认真记录,对照仪器记录的压力数值与压力波形,避免误差;(2)书写的右心导管术报告注意留存;(3)报告需包括基本资料、右心导管术检查的导管路径及经过描述、各部位的压力与血氧饱和度、计算的血流动力学参数、急性肺血管反应性试验结果及右心导管术后诊断。右心导管术报告的参考模板见图2。
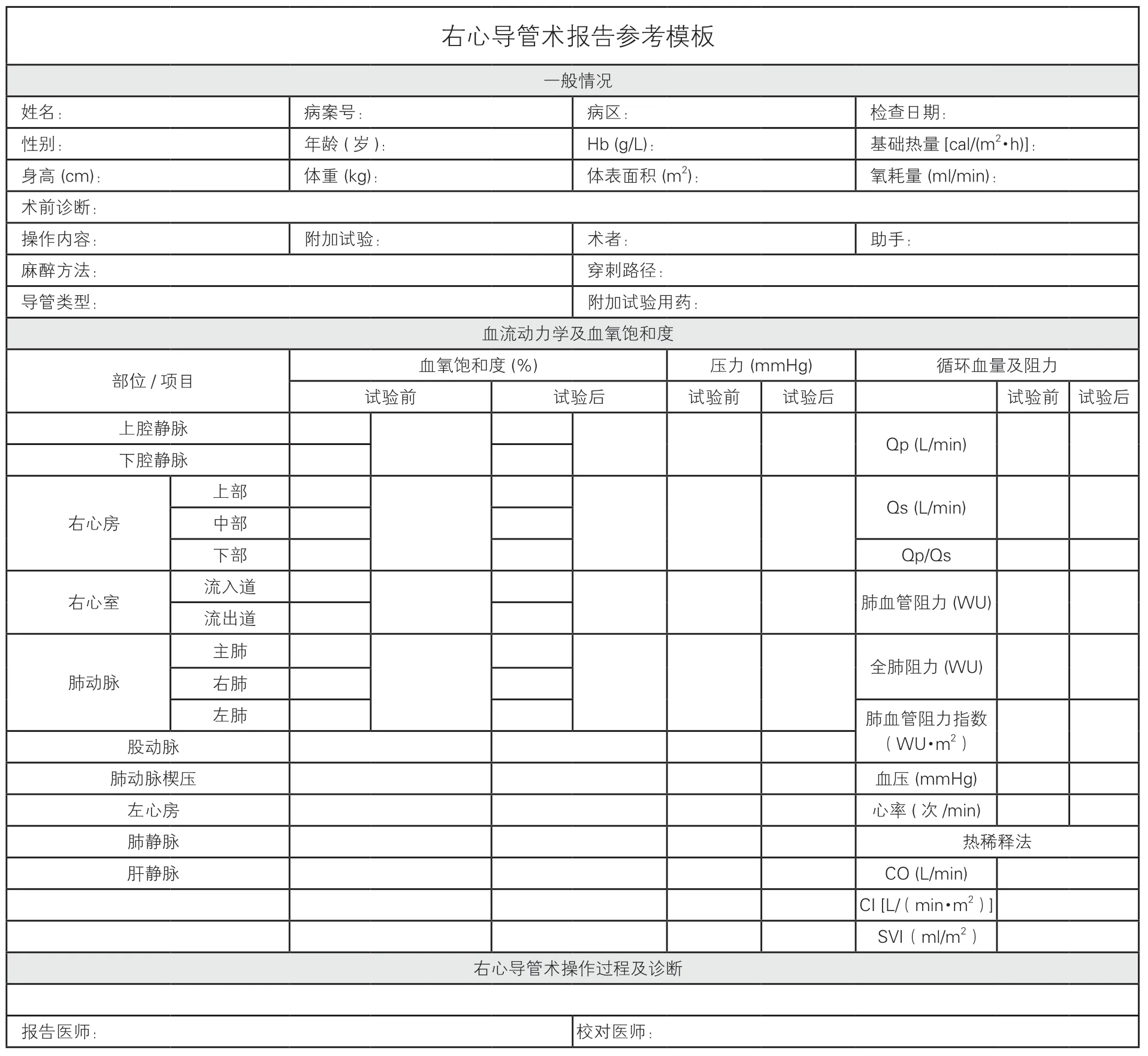
图2 右心导管术报告参考模板
执笔人:罗勤(中国医学科学院阜外医院),熊长明(中国医学科学院阜外医院)
专家委员会成员(按姓氏汉语拼音排序):曹云山(甘肃省人民医院),顾虹(首都医科大学附属北京安贞医院),谷新顺(河北医科大学第二医院),管丽华(复旦大学附属中山医院),韩学斌(山西省心血管病医院),洪城(广东呼吸病研究院),胡海波(中国医学科学院阜外医院),黄凯(广西医科大学第一附属医院),纪求尚(山东大学齐鲁医院),金旗(复旦大学附属中山医院),李江(中南大学湘雅二医院),李伟(贵州医科大学附属医院),柳志红(中国医学科学院阜外医院),罗勤(中国医学科学院阜外医院),陶新曹(中日友好医院),王琦光(北部战区总医院),奚群英(中国医学科学院阜外医院深圳医院),熊长明(中国医学科学院阜外医院),杨涛(中国医学科学院阜外医院),杨媛华(首都医科大学附属北京朝阳医院),袁杰(深圳市人民医院),张刚成(武汉大学中南医院),赵青(中国医学科学院阜外医院),赵智慧(中国医学科学院阜外医院)
利益冲突:所有作者均声明不存在利益冲突

