联合免疫相关性lncRNA和临床病理学特征建立肾透明细胞癌的预后模型
叶硕鹏 林登强 陈凌宇 赖鹏
肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)是肾小管上皮来源最常见的肾脏恶性肿瘤,全球每年新发ccRCC病例约为29.5万人,相关死亡人数达13.4万人[1]。尽管目前局部进展和晚期ccRCC的治疗已从非特异性免疫方法转变为新型免疫疗法,但这类患者预后仍然较差[2]。因此,我们亟需寻找新型有效的ccRCC肿瘤标志物去协助临床医师诊断、指导治疗、评估并改善患者预后。
在人类基因组中,参与编码蛋白的RNAs仅占基因组的1%~2%,既往研究主要集中于此,而高达98%的非编码RNA(non-coding RNA, ncRNA)同样具备调控细胞复制、细胞特点及细胞功能的作用,并在肿瘤免疫应答过程中发挥至关重要的作用,如抗原暴露、抗原识别、免疫激活、免疫浸润、肿瘤清除等[3]。长链非编码RNA(long non-coding RNA, lncRNA)作为ncRNA的一大类,相关研究已证实其不仅在肿瘤中异常表达,而且参与肿瘤的发生、发展,有望成为肿瘤诊断或治疗的分子标志物[4]。
近来研究表明lncRNA与ccRCC的发生、发展密切相关,其可能通过调控免疫浸润、免疫功能等影响ccRCC的临床预后[5]。因此,我们基于免疫相关的lncRNA,纳入临床病理学信息,构建包含lncRNA风险评分(lncRNA-Score)和临床病理学信息的联合预后模型,旨在协助临床诊疗,改善ccRCC患者的预后。
材料与方法
一、生物信息学数据来源
ccRCC患者的基因表达谱及相应临床数据来源于癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库(https://cancergenome.nih.gov/),排除没有完整临床数据或生存时间≤30 d的患者,共纳入539例ccRCC组织数据和72例正常肾脏组织数据。而免疫应答和免疫系统过程基因集来源于基因集富集分析(gene set enrichment analysis, GSEA)数据库(https://www.gsea-msigdb.org/gsea/msigdb/)。
二、暴露和结局
因变量:生存结局。包含生存或死亡,如果没有出现终点事件或截止到最后一次随访时患者仍存活,则被作为截尾数据处理。
自变量:lncRNA的数据及ccRCC患者的年龄、性别、肿瘤分期、肿瘤分级。
三、数据处理
首先,通过人类基因注释文件注释基因芯片信息,结合GSEA数据库来源的免疫相关基因集,获取免疫相关的lncRNA(r>0.7,P<0.001),并通过R软件的Heatmap包绘制lncRNA表达热图、GSEA 1.0.3软件进行基因富集分析。然后,利用R 软件的Survival包进行生存分析和多因素Cox回归分析,将P<0.05作为lncRNA最终保留在预后模型中的标准。输出回归系数值、P值和HR及其95%CI等统计量。计算每个患者的风险评分:Risk score=coef AL117336.2×expr AL117336.2+coef AC046143.1×expr AC046143.1+…+ coef AC016773.1×expr AC016773.1。coef表示lncRNA的多因素Cox比例风险回归系数,expr表示lncRNA的表达值。以此建立风险评分预后模型。结合lncRNA-Score与临床病理学信息构建联合预后模型。根据计算结果,将中位风险评分作为截断值,将其分为高危组和低危组。最后,利用R软件的Survival包和Surviminer包绘制高危组和低危组的生存曲线,利用R软件的Survival包绘制受试者工作特征(receiver operating characteristic, ROC)曲线和校准曲线,并以此结果来验证预后预测模型的可行性、有效性。为进一步使模型可视化,利用R软件的rms包绘制Nomogram图。
结 果
从TCGA数据库中提取了539例ccRCC患者的数据,共获取14 142个lncRNA表达信息。经GSEA数据库(免疫系统过程相关基因集M13664和免疫应答相关基因集M19817)比对,共发现128个与免疫相关的lncRNA。结合TCGA中患者的生存资料,我们筛选了30个与临床预后相关的lncRNA。通过多因素Cox回归分析,我们发现7个与免疫相关的lncRNA(均P<0.05)是ccRCC预后的独立危险因素,7个lncRNA分别为AL117336.2、AC046143.1、AC027601.2、AL136295.2、LINC00886、AC046143.2和AC016773.1(表1)。根据多变量Cox风险回归模型的结果,构建lncRNA-Score预后模型:Risk score=coef AL117336.2×expr AL117336.2+coef AC046143.1×expr AC046143.1+…+ coef AC016773.1×expr AC016773.1。依据中位风险评分(0.81)将纳入研究的患者分为高危组和低危组。通过计算所有患者7种免疫相关lncRNA的风险评分、生存时间和表达,结果表明lncRNA的表达与患者的生存相关。
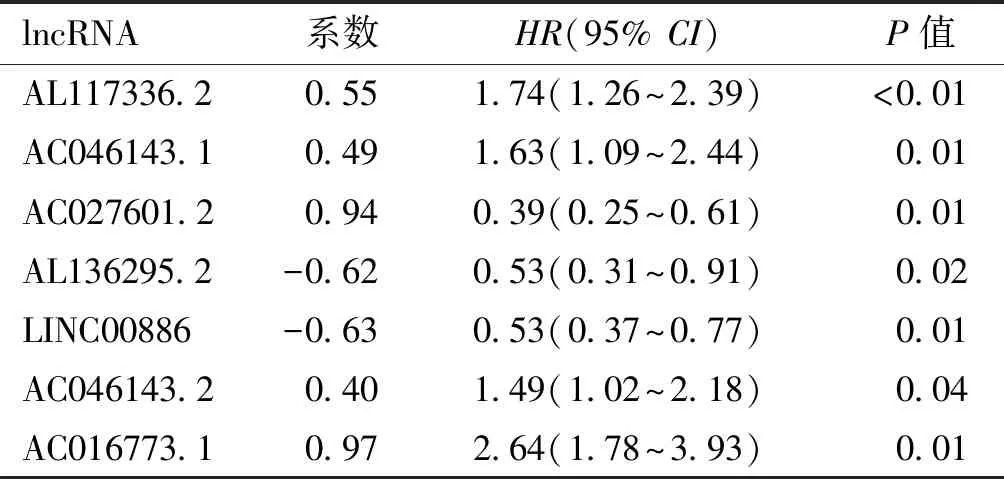
表1 多因素Cox回归分析结果
为构建联合预后模型,我们将lncRNA-Score及ccRCC患者的年龄、性别、肿瘤分级及肿瘤分期纳入多因素Cox回归分析中,分别平衡各项因素后发现lncRNA-Score(HR=1.18,P<0.01)、年龄(HR=1.03,P<0.01)、肿瘤分期(HR=1.65,P<0.01)和肿瘤分级(HR=1.31,P=0.03)是ccRCC的独立危险因素(图1、2)。依据中位风险评分将ccRCC患者分成高危组和低危组。相对低危组而言,高危组患者的预后更差(P<0.01,图2F)。因此,我们基于上述5个因素构建了ccRCC联合预后模型(C指数=0.78),对ccRCC患者进行1年、3 年和5年的生存率预测后(图3),患者1年、3年和5年生存率的ROC曲线下面积(area under curve, AUC)分别为0.86、0.81和0.77,校准曲线也吻合良好(图4),此结果提示构建联合预后预测模型具有优越的预测效能。

图1 森林图可视化展示多因素Cox回归分析结果

A:lncRNA-Score与ccRCC患者预后的关系;B:年龄与ccRCC患者预后的关系;C:性别与ccRCC患者预后的关系;D:肿瘤分级与ccRCC患者预后的关系;E:肿瘤分期与ccRCC患者预后的关系;F:风险评分与ccRCC患者预后的关系图2 Kaplan-Meier法分析各风险因素与ccRCC患者预后的关系
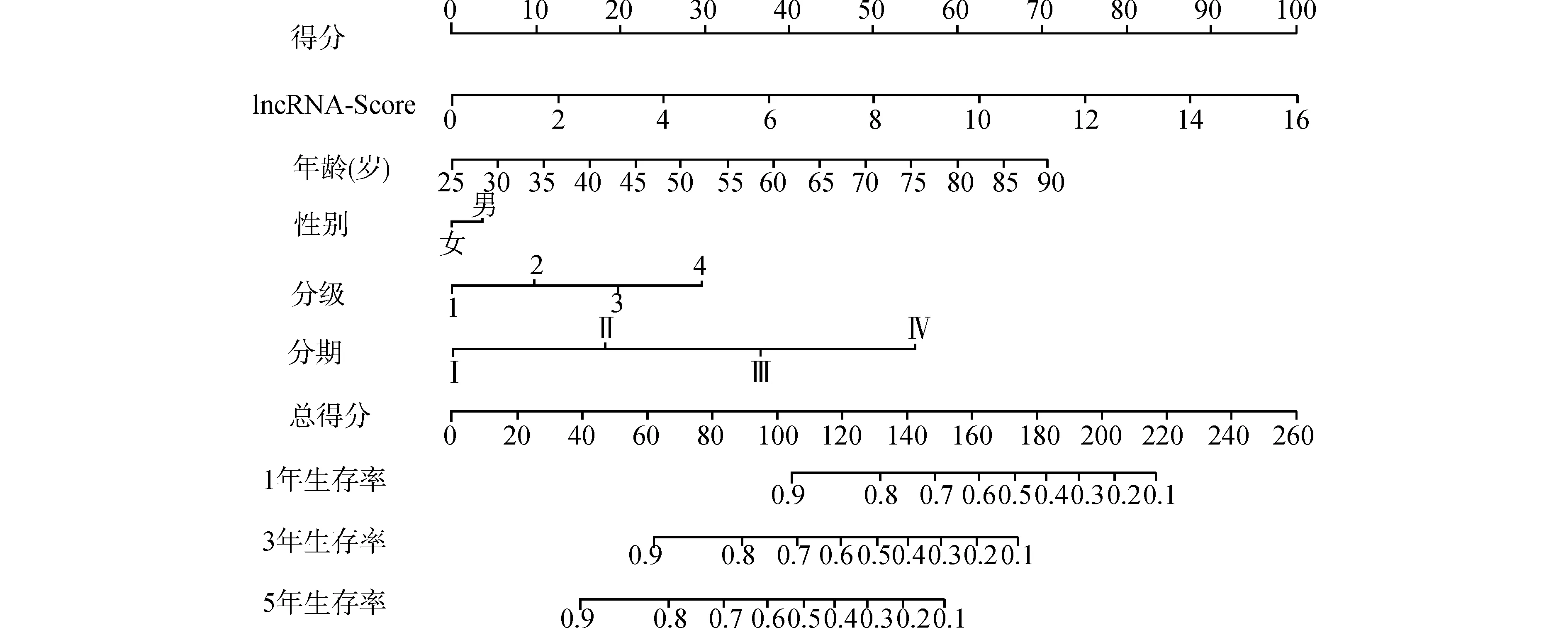
图3 Nomogram图预测ccRCC患者生存率

A:ROC曲线展示联合预后模型的AUC;B:校准图检验联合预后模型的效能图4 联合预后模型的ROC曲线及校准图
讨 论
近年来,对于ccRCC的治疗取得了一定的进步,但转移性肾细胞癌的生存率仍不尽如人意。既往研究已证实ccRCC是一种免疫相关性疾病、免疫源性的肿瘤,肿瘤微环境可见大量淋巴细胞浸润为其主要的组织学特征[6-7]。因此,免疫疗法逐渐被临床专家所认可[8]。近来研究发现lncRNA在免疫应答中发挥着至关重要的调控作用,并与多种肿瘤的发生、发展密切相关,对其预后有良好的预测价值,且是它们治疗的潜在有效靶点[9]。 因此筛选与ccRCC预后相关的免疫相关性lncRNA并联合临床病理学特征,由此构建ccRCC预后模型,将有助于改善患者预后,为疾病治疗提供理论依据。
在本研究中,我们将来自于TCGA数据库中的539例ccRCC患者的14 142个lncRNA与GSEA数据库的免疫相关基因集进行比对,共发现128个免疫相关性lncRNA。结合TCGA中患者的生存资料,筛选出了30个与ccRCC患者临床预后显著相关的lncRNA。我们通过进一步分析确认了7个免疫相关的lncRNA为ccRCC预后的独立危险因素,并计算lncRNA-Score。随后,我们基于lncRNA-Score及ccRCC患者的年龄、性别、肿瘤分期和肿瘤分级构建联合预后模型,依据中位风险评分将ccRCC患者分为高危组和低危组。相较于低危组患者而言,高危组患者的预后更差。同时患者1年、3年和5年生存率的AUC分别为0.86、0.81和0.77,该结果进一步证实了该模型具有良好的预测效能。
最近,Khadirnaikar等[10]基于143个免疫相关性lncRNA,利用K均值聚类算法将504例患者分成3个亚型(C1、C2和C3),其中C3亚型高表达PD1基因且预后最差。尽管我们的研究并未比较低危组和高危组患者的基因表达差异情况,但我们筛选出了7个与预后相关的lncRNA,后续研究可深入探索。在Zeng等[11]的研究中,先筛选出ccRCC与癌旁组织间的差异表达lncRNA,随后应用Cox回归分析并建立了基于6个差异lncRNA的ccRCC预后预测模型,该预后模型证明了lncRNA的预后价值。我们的预后模型同时纳入了lncRNA-Score和患者的临床病理学信息,且预测效能更佳,无论1年、3年还是5年生存率预测ROC的AUC均超过Zeng等研究的AUC(0.683)。此外,我们研究纳入的均为免疫相关性lncRNA,表明ccRCC是免疫原性的肿瘤。
另外,我们通过共表达分析发现7个lncRNA中有2个lncRNA与免疫基因共表达,即AC027601.2与NOTCH4和AC016773.1与TAZ。 NOTCH4是NOTCH信号通路的重要成员,在血管生成中起重要作用。有研究表明Notch4蛋白阳性表达可抑制微血管形成及肾细胞癌恶化[12]。 TAZ是具有PDZ结构域的转录共活化因子,由WWTR1基因编码,在人类多种癌症的细胞增殖、分化和迁移中起到关键作用[13]。已有文献表明,TAZ蛋白可通过铁死亡信号通路EMP1-NOX4调节肾细胞癌的生长,促进肿瘤的进展[14]。
本研究基于lncRNA-Score和临床病理学特征(年龄、性别、肿瘤分级及肿瘤分期)建立了一个新的ccRCC预后预测模型,能够较好地预测患者的1年、3年、5年生存率,有助于区分ccRCC进展高风险者,为密切随访患者、制定积极有效的治疗策略提供了理论帮助。此外,7个免疫相关性lncRNA也可能成为肾细胞癌的肿瘤标志物,不仅可能协助诊断ccRCC,而且可能成为潜在有效的治疗靶点。当然,由于我们的研究是基于数据库的回顾性分析,仍需要在后续的临床和实验中进行验证。同时,本次文献检索中未发现对应于另外5个lncRNA的基因,也需要在后续的研究中进一步找寻,并探索7个lncRNA影响肾细胞癌生长的分子机制。

