腹腔镜肾肿瘤精准剜除术治疗肾门部肿瘤的初步体会
钱洲楠 唐爱国 周留正 马克钧
外科手术目前仍然是治疗肾细胞癌的主要手段,肾部分切除术已广泛用于T1期肾肿瘤的治疗[1-2]。随着外科手术技术的发展和术者能力的提高,较多经筛选的T2期肾肿瘤亦可采用肾部分切除术治疗[3-5]。腹腔镜下保留肾单位手术(laparoscopic nephron sparing surgery, LNSS)及机器人辅助腹腔镜下保留肾单位手术(robot-assisted laparoscopic partial nephrectomy, RALPN)已广泛用于局限性肾细胞癌的治疗[6]。RALPN虽然是一种趋势,但由于其设备和手术费用昂贵,且对术者操作技能要求高等原因,目前RALPN仍无法大规模应用于各级医院,因此,LNSS依然是目前治疗早期局限性肾癌的主流术式。
肾门肿瘤由于其邻近肾蒂血管及集合系统的特殊解剖位置[7],术中损伤血管及集合系统等各种风险很大程度提升[8],而中转肾切除或传统开放手术的可能性也显著提高,而且术后创面出血、血尿、漏尿等一系列并发症的发生率也明显升高[9]。本研究回顾性分析了2019年8月至2021年8月本院同一术者完成的11例应用腹腔镜肾肿瘤精准剜除术切除肾门肿瘤的病例资料,并对该方法的安全性及可行性进行了探讨。现报告如下。
对象与方法
一、一般资料
本组患者共11例,男6例,女5例;患者年龄65~78岁,平均68.8岁;体重指数19.6~25.1 kg/m2,平均22.83 kg/m2;肿瘤位于左侧6例,右侧5例;肿瘤直径1.8~4.1 cm,平均3.04 cm;肿瘤位于肾门背侧的4例患者采取经腹膜后途径,肿瘤位于肾门上方的3例患者采取经腹膜后途径,肿瘤位于肾门腹侧的2例患者采取经腹途径,肿瘤位于肾门下方的2例患者采取经腹途径;临床分期为T1a~T1b期,R.E.N.A.L.评分平均8.5分(8~9分),术前患肾GFR平均43.7 ml/min(40.2~46.9 ml/min)。术前完善CT检查及双肾动脉血管增强造影,从而大致判断肾门肿瘤与肾门部血管和集合系统的关系。见图1。
二、手术步骤
患者采取全身麻醉,术前根据影像学进行肿瘤位置的评估,如肿瘤位于肾门背侧或者肾门上方则采用经腹膜后途径,如肿瘤位于肾门腹侧或者肾门下方,则使用经腹途径;打开肾周筋膜,探及输尿管,

A:CT检查提示肾门区肿瘤;B:CTA检查图1 术前影像学评估
沿输尿管向上分离至肾门处,纵行切开肾周脂肪囊,充分游离肾脏,使肾脏可以在腹腔内任意摆动和反转;彻底解剖肿瘤附近肾门结构,游离出肾盂、肾动脉及肾静脉,尽可能去除肾门部脂肪,清楚暴露肿瘤附近肾门结构,仔细分离分支血管,如术前CTA发现肿瘤有供血血管或术中分离血管分支时发现肿瘤有单独供血血管,则自行分离后,将供应血管结扎离断;用哈巴狗钳临时阻断肾动脉,在肿瘤肾门对侧缘沿肿瘤边缘剪开肾包膜,紧贴肿瘤假包膜表面将瘤体逐步剥离肾脏,剥离至肿瘤肾门侧时,需反其道而行之,将肿瘤提起,并非继续将肿瘤剥离肾脏,而是将肾门分支血管及集合系统沿假包膜外侧剥离肿瘤表面,尽可能保护周围组织,此过程始终沿肿瘤假包膜表面操作,即将肿瘤假包膜和肾脏组织撕开,不伤及肿瘤假包膜也不伤及肾脏组织,将肿瘤精准剥离肾脏;完整剪切肿瘤后用倒刺线双层缝合肾脏创面,缝及肾门侧时尽可能少带及肾门血管及集合系统,外层缝合可由肾门侧进针,避开血管及集合系统,由肾门对侧面出针后每针以锁扣固定加固,力求精准牢固缝合;松开血管阻断钳,恢复肾脏血供,观察创面有无明显出血,用止血纱填塞创面,缝合脂肪囊将肾脏再行悬吊固定,留置引流管,关闭切口。见图2。
三、观察指标及术后随访
记录手术时间(皮肤切开至切口缝合时间)、热缺血时间(阻断肾动脉供血时间)、术中出血量(吸引器吸出的血量)、手术并发症以及有无中转肾切除或开放手术。术后6个月时复查CT和患肾GFR。
结 果
11例患者手术均顺利完成,无一例中转肾切除或开放手术。手术时间平均153.5 min(120~180 min),热缺血时间平均27.8 min(25~35 min),手术过程中平均出血量为81.5 ml(50~150 ml),术后无一例患者出现血尿、漏尿、肾周血肿等并发症。术后病理证实10例为透明细胞癌,1例为血管平滑肌脂肪瘤,且11例均切缘阴性。术后随访6个月,行CT及患肾GFR检查,患肾GFR平均28.2 ml/min(22.4~34.1 ml/min),11例患者均无肿瘤复发或转移。
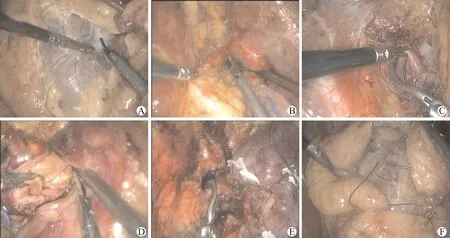
A:充分游离肾脏;B:精细解剖肾门肿瘤;C:阻断肾动脉;D:精准剥除肿瘤;E:精准牢固缝合创面;F:再次缝合脂肪囊,固定肾脏图2 术中主要步骤图解
讨 论
肾门肿瘤属于复杂性肾肿瘤,由于其位置紧邻肾门,肿瘤肾门侧紧靠肾蒂大血管和集合系统,切除肿瘤时非常容易损伤肾血管引起术中大量出血进而中转肾切除或开放手术,更有甚者可出现大出血危及生命,而且术后出血风险也明显增加,同样损伤集合系统后可引起术后漏尿进而影响术后恢复[8,10]。同时,术者如因畏惧损伤肾蒂组织而术中破坏肿瘤完整性可导致肿瘤切缘阳性,影响患者预后。因此,肾门肿瘤的精准剜除及创面牢固缝合至关重要,肾门肿瘤LNSS是泌尿外科手术者的一大技术挑战。
LNSS可更大程度地保护患者肾功能,目前为绝大多数术者所推崇[11-14]。机器人技术虽然已成为趋势,但是由于其设备和手术费用昂贵、对术者操作技能要求较高等原因,RALPN仍未在各级医院大规模开展,而腹腔镜技术已成熟,且各级医院目前多常规开展。本研究回顾性分析了11例肾门肿瘤手术,以普通腹腔镜技术精准剜除肾门部肿瘤,为患者保留患肾功能,治疗过程总结如下。
一、术前评估,精细准备
影像学检查首选CT平扫及增强,可显示肿瘤位置、大小、侵入深度以及与邻近组织的大致关系,CTA则可清晰显示肿瘤与肾门血管的关系[15],如设备条件许可可行IQQA系统三维重建,从而做到术前精准评估肿瘤情况,为精准剜除肿瘤做好准备。术前完善患肾GFR检查,了解患肾功能及正常肾脏功能,以备中转肾切除可能。
二、充分暴露,精准剜除
术中充分游离患肾,使肾脏可以各个方位充分调整,充分暴露肿瘤肾门侧,尽可能清理肾门部脂肪,清晰显露肿瘤旁肾血管及集合系统。剜除肿瘤时,由肿瘤肾门对侧面切入,探及肿瘤包膜,沿肿瘤包膜将肿瘤剥离肾脏,分离至肾门侧将肾门组织反向剥离肿瘤,尽可能不予剪切,保护肾门组织,将肿瘤完整剥离肾脏。沿肿瘤假包膜剜除剥离可以最大程度减少损伤正常肾脏组织,同时可以快速完整的将肿瘤切除,真正做到精准切除。
三、牢固缝合,二次固定
采用双层缝合,内层用4-0倒刺线缝合,使创面缩小,减少创面张力,外层用3-0倒刺线缝合,由肾门侧进针,要求缝及肾包膜且尽可能避开肾门血管和集合系统,对侧面可多缝些肾脏组织,每次由对侧面出针后用锁扣加固。创面缝合后用止血纱填塞,后将脂肪囊重新缝合包裹肾脏,以减少肾脏活动度,降低术后出血风险。
常规腹腔镜下肾部分切除术在阻断肾动脉后沿肿瘤边缘5 mm处进行切割,以切除肿瘤为目的,可切除一定正常肾脏组织,而肾门肿瘤因其解剖位置的特殊性,肿瘤周围正常组织有肾门大血管及集合系统,损伤后易造成严重并发症及后遗症。精准剜除术是沿肿瘤边缘入刀,紧贴肿瘤假包膜分离,做到既完整切除肿瘤,又基本不损伤周围正常组织,从而达到精准治疗的目的。但并非所有肾门肿瘤均适合行精准剜除术,如肿瘤较大,剜除后创面对合困难,或术中无法探及假包膜,或术中发现肿瘤侵犯肾门结构则不建议行精准剜除术。
本组11例患者手术出血量、手术时间及热缺血时间无明显增加,术后肾功能得到一定保护。但本研究也有一定局限性,由于患者数量较少,且有几例病例为近期手术患者,随访时间较短,尚需继续对这些患者进行长期随访。综上所述,对于腹腔镜技术娴熟的术者,采用腹腔镜肾肿瘤精准剜除术治疗肾门肿瘤是一种安全可行的方案。

