常规超声与超声造影对甲状腺乳头状癌患者侧颈区淋巴结转移的术前诊断效能
陆健斐 ,卜 锐 ,刘小艳 ,张 幸 ,丁 昱 ,章 然
(1)昆明医科大学第二附属医院超声科;2)心内科,云南 昆明 650101)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺恶性肿瘤中发病率最高的一种病理类型,为近年来发病率增长最快的恶性肿瘤[1]。颈部淋巴结转移是PTC 患者常发生的事件,其中侧颈区淋巴结转移(lateral cervical lymph node metastasis,LCLNM)高达20%~70%[2]。因此,术前准确评估LCLNM 的水平状况对PTC 患者选择最佳治疗策略具有重要意义。术前常规超声(ultrasonography,US)是PTC 患者LCLNM 临床诊断的首选的影像学检查方法[3],在诊断良性或恶性性的甲状腺结节方面上也显示出潜在的应用价值[4-5]。US 和CEUS 在PTC 患者LCLNM 临床诊断上各具优点,也有局限性[6],单纯依靠单一的检查对区分其良恶性仍较困难[7]。本研究通过与术后确诊的手术病理结果对照,分析术前US、CEUS 及联合应用对PTC 患者LCLNM 的超声特征及诊断效能,以期为超声引导下细针穿刺细胞学检查和术前制定淋巴结清扫术及手术治疗策略提供参考依据。
1 资料与方法
1.1 一般资料
选取2020 年8 月至2021 年8 月在昆明医科大学第二附属医院接受PTC 手术及侧颈区淋巴结清扫术的患者80 例,男31 例,女49 例,年龄21~70 岁,平均(42.9±12.8)岁。纳入标准:(1)所有患者均行颈侧区淋巴结US 和CEUS 检查;(2)声像图完整且质量优良;(3)PTC 病理诊断结果明确;(4)PTC 患者同时患有其它的恶性肿瘤病史。排除标准:(1)患者术前临床资料不完整;(2)既往曾行颈部淋巴结消融术。本研究经医院医学伦理委员会批准(伦理审批号:审-PJ-2020-35),所有患者均签署CEUS 知情同意书。
1.2 仪器与方法
1.2.1 US 检查采用Siemens Acuson S3000 超声诊断仪,18L 高频线阵探头(频率6~18 MHz)。依据AJCC 进行颈部淋巴结分区[8],侧颈区为Ⅱ~Ⅴ区。记录目标淋巴结的长短径比(L/S)、淋巴门是否消失或偏移、皮质回声、内部有无团状高回声、有无钙化、有无囊变区;观察淋巴结内部Adler[9]血流分级:0 级为淋巴结内无血流信号,1 级为淋巴结内有1~2 个点状或短棒状血流信号,3 级为淋巴结内部有3~4 支点状血流或1 支清晰的血流,3 级为淋巴结内有2 支以上清晰血流信号。观察血流分布类型,分为4 型:无血流型、门型、周围型、混合型。
1.2.2 CEUS 检查使用9L4(频率4~9 MHz)高频线阵探头,机械指数0.06~0.08。以目标淋巴结的最大切面作为观察面,选用造影剂声诺维(SonoVue,Bracco,Italy)经肘部静脉快速团注2.4 mL 混悬液,随后注入5 mL 生理盐水快速冲管,存储DICOM 动态图像90s。由2 名具有丰富CEUS 诊断经验的主治医师采用盲法独立评估淋巴结增强模式和增强类型。增强模式分为离心型、向心型和混和型;增强类型分为4 型[10]:Ⅰ型(均匀增强型);Ⅱ型(不均匀增强型:内有低或无增强区);Ⅲ型(不均匀微弱增强型);Ⅳ型(环状增强型:只有周边增强,内部无增强)。
1.2.3 US 联合CEUS 检查US 联合CEUS 检 查均提示为淋巴结未转移时诊断为未转移性淋巴结;任何一种检查提示为淋巴结转移则诊断为转移性淋巴结。
1.2.4 病理学检查最终获得手术切除126 枚淋巴结标本,依据术后淋巴结病理学诊断分为未转移组(n=45)和转移组(n=81)。
1.3 统计学处理
使用SPSS 25.0 软件对数据进行统计学分析,计数资料采用频数和百分比描述,采用χ2检验比较未转移性淋巴结和转移性淋巴结的US 和CEUS 的声像特征的差异,计算US、CEUS 及联合应用对PTC 患者LCLNM 的术前诊断的敏感度、特异度、准确度、阳性预测值、阴性预测值。P<0.05 表示差异有统计学意义。
2 结果
2.1 侧颈区淋巴结US 声像特征
常规超声检查结果显示:转移淋巴结在侧颈区分布中由高到低的顺序依次为Ⅳ(47 枚,占58%)、Ⅲ(21 枚,占26%)、Ⅱ区(12 枚,占14.8%)、Ⅴ区(1 枚,占1.2%);转移性淋巴结多表现为淋巴门消失或偏移、皮质回声为非均匀低回声、内部存在团状高回声及钙化,血流类型多表现为周围型和混合型,Adler 分级多为2 级和3 级,与未转移淋巴结比较,差异有统计学意义(P< 0.05);转移淋巴结与未转移淋巴结的长短径比、有无囊变区的比较,差异无统计学意义(P>0.05),见图1 和表1。

图1 PTC 患者侧颈区转移性淋巴结US 声像图Fig. 1 The conventional ultrasonographic images of lateral cervical metastatic lymph node in PTC patients
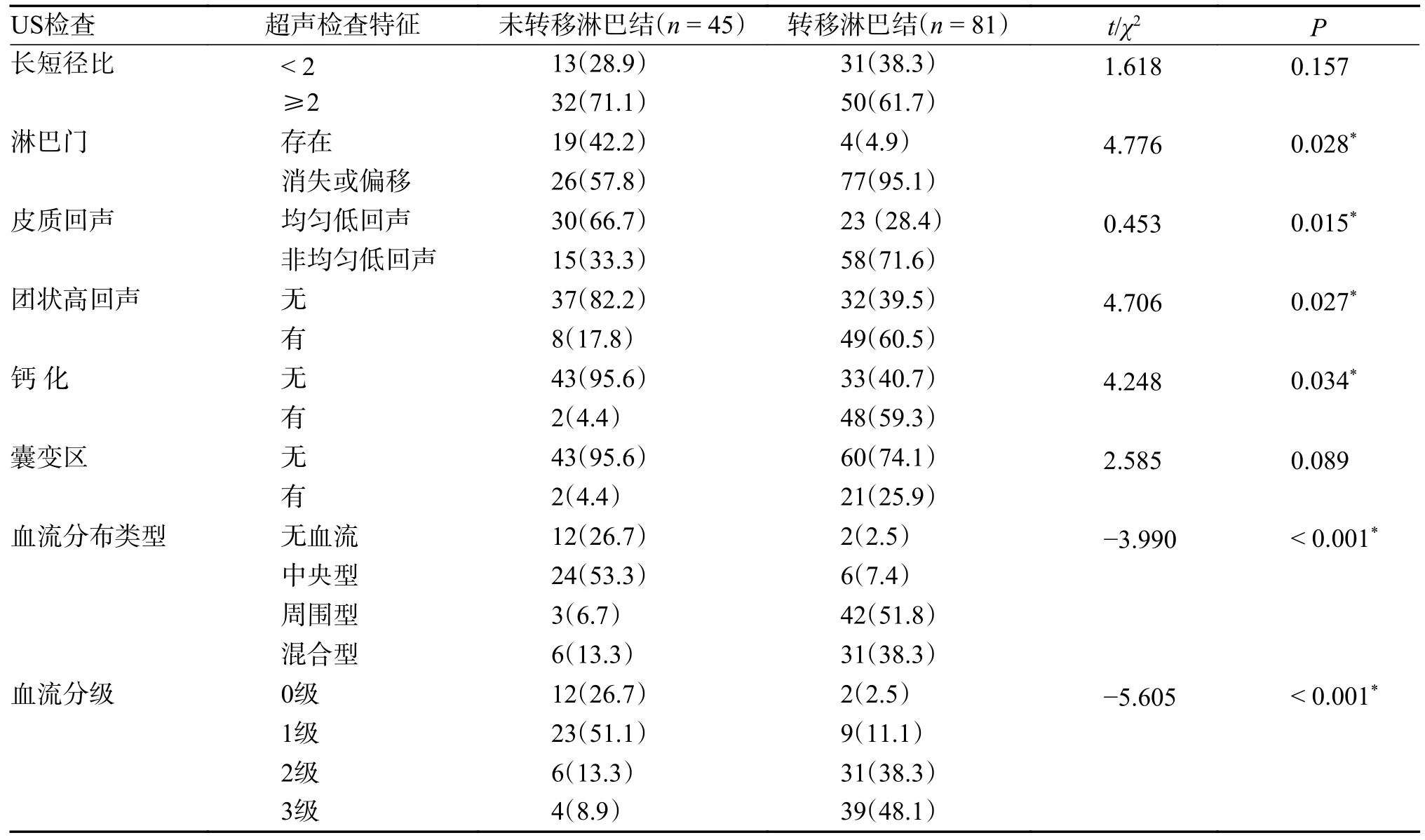
表1 PTC 患者侧颈区淋巴结US 声像特征[n(%)]Tab.1 The conventional ultrasonographic image features of lateral cervical lymph node status in PTC patients [n(%)]
2.2 侧颈区淋巴结CEUS 声像特征
CEUS 结果显示:未转移淋巴结多表现为离心型和Ⅰ型,而转移淋巴结多表现为向心型和Ⅱ型,其次见于Ⅲ型,2 组比较,差异有统计学意义(P< 0.05),见表2、图2。

表2 PTC 患者侧颈区淋巴结CEUS 声像图特征 [n(%)]Tab.2 The contrast-enhanced ultrasound image features of lateral cervical lymph node status in PTC patients [n(%)]

图2 PTC 患者侧颈区转移性淋巴结CEUS 声像图Fig. 2 The CEUS images of lateral cervical metastatic lymph node in PTC patients
2.3 US、CEUS 与两者联合应用对PTC 患者侧颈区淋巴结转移的诊断效能
与病理结果对比,后期研究时进一步对US单独分析,计算US、CEUS 及US+CEUS 联合应用3 种检查方法的诊断效能分析显示:US+CEUS联合应用对PTC 患者颈侧区淋巴结转移诊断的敏感度、特异度、准确度、阳性预测值及阴性预测值均高于CEUS 或US 单独应用,见表3。
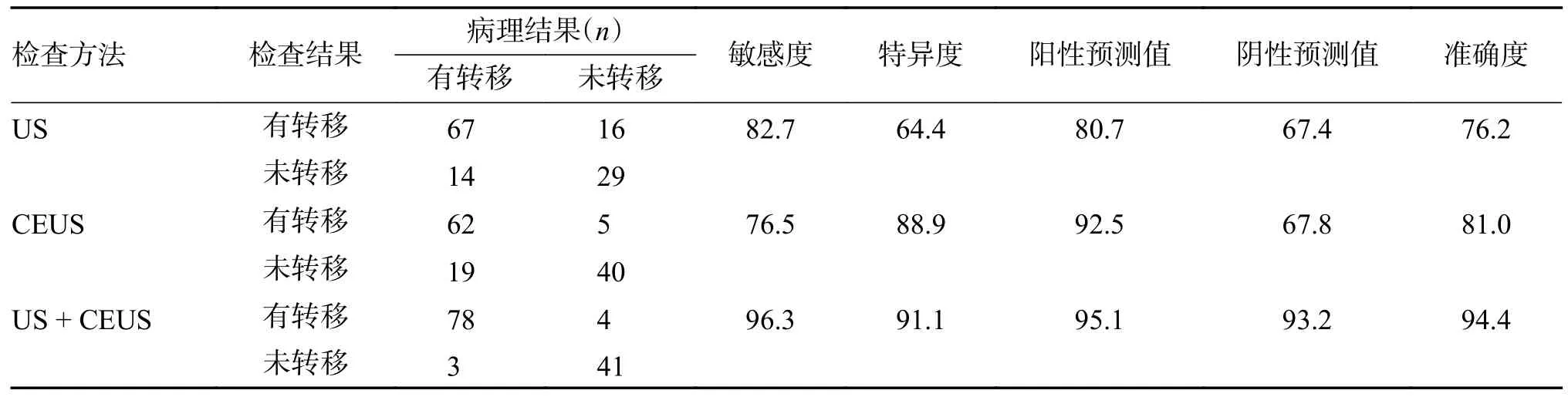
表3 US、CEUS 及US+CEUS 联合应用对PTC 患者侧颈区淋巴结转移的诊断效能(%)Tab.3 Diagnostic efficacy of US,CEUS and US+CEUS combined in patients with PTC patients with lateral cervical lymph node metastasis(%)
3 讨论
常规超声(US)作为国际指南推荐的用于浅表淋巴结病变的主要影像学诊断技术[11],目前已被用于PTC 术前颈部淋巴结转移的首选影像学检查[12]。研究表明:术前US 能显示PTC 患者侧颈区淋巴结的分区、大小、形态及内部回声,但良恶性淋巴结的US 图像存在较多重叠,有一定的假阳性率及假阴性率,造成侧颈区淋巴结清扫不足或过度清扫[13];而超声造影(contrast-enhanced ultrasound,CEUS)作为一种微血管显影技术,可更清晰实时动态反映淋巴结内部血流灌注情况,CEUS 对良、恶性浅表淋巴结的诊断准确性更高[6,14-15]。然而,对于良、恶性特征兼具的淋巴结,单纯依靠单一的US 声像特征或应用CEUS 增强模式区分其良恶性仍较困难。因此,寻找更多的超声特征提高诊断效能显得至关重要。
本研究对PTC 患者术前侧颈区淋巴结的US显示:PTC 转移性淋巴结多表现为淋巴门消失或偏移、皮质回声为非均匀低回声、内部存在团状高回声及钙化,与非转移淋巴结比较,差异有统计学意义(P< 0.05),这与何守伟]等[16]的结果相一致。高回声团形成的原因是PTC 转移至淋巴结内的肿瘤细胞分泌的甲状腺球蛋白不能被及时有效利用而聚集成团后所形成[17]。大多数文献认为出现边界清楚清晰、团状高回声是PTC 淋巴结转移的一个特异性征象,但本研究中发现有8 枚未转移淋巴结内见团状高回声,分析原因是淋巴结内炎性细胞和纤维组织反应性增生,从而增加局部回声反射呈团状高回声。本研究US 检查发现转移淋巴结多表现为内部见点状强回声,与王磊等[18]报道一致,其形成原理是淋巴结内的转移灶分泌的甲状腺球蛋白通常会呈现胶体聚集的砂粒体所形成但其与淋巴结结核或其他恶性肿瘤转移的淋巴结内部的强回声不同,本研究发现点状强回声后方多数伴有彗星尾征[19],因此认为点状强回声并后方伴有彗星尾征是PTC 转移的高度特异性征象。本研究显示转移淋巴结与未转移淋巴结的长短径比(L/S)的比较,差异无统计学意义(P>0.05)。既往研究[20]认为淋巴结体积变大,则为转移性的可能性大。这与本研究有差异,分析原因入组淋巴结肿瘤侵犯处于早期阶段,尚未引起淋巴结整体形态改变,因此大小不能作为判断淋巴结是否转移的单一声像特征。另外,既往研究认为PTC 转移性淋巴结易发生囊性变,而本研究显示2 组淋巴结对有无囊性变的比较,差异无统计学意义(P> 0.05),分析原因结核性和反应性增生的淋巴结内部也可出现囊性变,导致结果差异无统计学意义。本研究显示转移性淋巴结的血流类型多表现为周围型和混合型,其原因是当肿瘤细胞侵犯淋巴结后分泌大量肿瘤血管生长因子,促进生成众多粗大扭曲的肿瘤新生血管大多分布在周边区,因此血流呈周围型,如果淋巴门血管未遭到破坏,部分淋巴结呈混合型。对此,笔者认为血流类型是鉴别PTC 淋巴结转移的重要特征。
本研究CEUS 检查显示未转移淋巴结特征多表现为离心型和Ⅰ型(均匀增强型),而转移淋巴结特征多表现为向心型和Ⅱ型(不均匀增强型,内有低或无增强),其次见于Ⅲ型(不均匀微弱增强型)。这与任玲等[21]报道相一致。未转移淋巴结通常存在正常淋巴门动脉,呈放射状分布于淋巴结周边皮质下,因此呈离心性均匀性增强;而转移性淋巴结肿瘤细胞侵入淋巴结外包膜下并聚集于淋巴结边缘窦后生成生大量新生肿瘤血管,从而表现为由周围向中心的向心型增强,同时肿瘤血管管径不均、分布紊乱,表现为Ⅱ型,内部低或无增强区为肿瘤细胞;部分淋巴结内新生肿瘤血管管径细小,受肿瘤组织压迫管壁塌陷,对造影剂微泡流入的阻力较大而呈Ⅲ型;当淋巴结内广泛浸润的肿瘤细胞时只见周边环状增强,内部无增强,即Ⅳ型,本研究中有2 枚转移性淋巴结的增强类型呈Ⅳ型。
选择高敏感度、特异度及准确度的高诊断效能检查方法对于术前诊断PTC 患者LCLNM 具有重要临床价值。本研究结果显示,US+CEUS 联合应用对PTC 患者LCLNM 诊断的敏感度、特异度、准确度、阳性预测值及阴性预测值均高于CEUS或US 单独应用。这与张琦等[22]的研究结果相似。CEUS 在一定程度上可弥补US 的不足,特别对于形态较小或内部血流不丰富的淋巴结。本研究在后期对US 单独应用进行分析,原因是本研究中US+CEUS 联合应用仍有14.3%(18/126)淋巴结出现误诊,其中假阳性淋巴结15 枚、假阴性淋巴结3 枚。在15 枚假阳性淋巴结CEUS 均表现为混合型增强,US 显示淋巴门均消失,8 枚血流分级3 级。分析原因可能是淋巴结太靠近大血管,增强模式受大血管影响,CEUS 检查出现假阳性。3枚假阴性淋巴结US 显示淋巴门存在,局部皮质非均匀低回声,血流分级1 级,CEUS 呈门型离心型增强,周边局部不均匀增强,导致US 与CEUS 检查均出现假阴性。分析原因,该淋巴结可能处于肿瘤侵犯早期,由周围侵入的肿瘤细胞尚未侵犯淋巴结门,因此当US 显示淋巴门存在时,CEUS 检查应仔细观察周边区增强的均匀性。
综上所述,US+CEUS 联合应用可显示良性和恶性的淋巴结特征性影像,对于诊断PTC 患LCLNM 诊断具有高度的敏感度、特异度及准确度高,在临床上能提高其诊断效能,可以为术前制定手术治疗策略提供有价值的参考依据。然而,本研究的局限性为样本量较少,有待扩大样本量以及结合更多的超声技术如弹性成像于今后的研究。

