血管内皮生长因子-C 对鼻咽癌CNE-2 细胞小鼠移植瘤的辐射敏感性的影响
吴锡芳 ,汪 勇 ,彭丽莎 ,罗 洁 ,王 枫
(1)昆明医科大学第三附属医院头颈外科,云南 昆明 650118;2)昆明医科大学第一附属医院放疗科,云南 昆明 650032)
鼻咽癌(nasopharyngeal carcinoma,NPC)是常见头颈部恶性肿瘤之一,很容易发生淋巴结转移,目前治疗主要以放疗为主综合治疗。鼻咽癌新生血管在它的发生、发展及远处转移中发挥重要的作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)高表达可促进血管新生,VEGF 高表达的患者治疗后总体生存情况较差,并且更容易发生转移[1-2]。研究发现血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C)是促淋巴管生长因子,VEGF-C 在鼻咽癌转移中发挥很大的作用,但目前关于VEGF-C在鼻咽癌辐射敏感性方面报道很少。
本研究以VEGF-C 作为研究问题着眼点,探讨VEGF-C 对鼻咽癌CNE-2 细胞小鼠移植瘤辐射敏感性影响及其机制,以期为鼻咽癌抗VEGFC 治疗联合放疗提供理论支持,也为鼻咽癌患者的治疗提供新的治疗靶点。
1 材料与方法
1.1 实验材料
细胞株,CNE-2 细胞来源于上海复旦大学,培养条件:1 640+10%FBS+1%双抗+1%谷氨酰胺完全培养基,37 ℃、5% CO2培养箱中培养,当细胞融合度达到80%时,接种细胞于6 孔板,待细胞长至70%,按组别进行换液,常规传代。
1.2 研究方法
1.2.1 质粒和siRNA 干扰用锐博human VEGFC siRNA 转染套装对CNE-2 细胞进行VEGF-C siRNA 干扰预实验,筛选出干扰效果最好的siRNA 序 列。VEGF-C siRNA 靶序列如下:siRNA-1,5 ′-GGCTTATGCAAGCAAAGATCTG G-3′;siRNA-2,5′-ACCCAGAATATTGGAAAA TGTAC-3′;siRNA-3,5′-CAGAATATTGGAA AATGTACAAG-3′;NC,5′-UUCUCC GAACG UGUCACGUTT-3′。
CNE-2 细胞组换液为1640 基础培养基,siRNA NC 对照组换液为含80 nM NC 的1640 基础培养基;干扰序列换液为含80 nM siRNA 干扰序列的1640 基础培养基;培养48 h 后,收集细胞,提取细胞总RNA,Q-PCR 检测各组细胞VEGFC 的表达情况,通过分析,发现干扰效果最好序列,并采用此序列进行后续实验。
1.2.2 定量RT-PCR(qRT-PCR)按Trizol 法提取细胞总RNA,先进行逆转录反应合成cDNA,以逆转录反应中获得的cDNA 为模板,GAPDH 为内参对照,SYBR™ Green PCR Master Mix 用于qPCR 测定、20 µL PCR 扩增体系。反应条件为:95 ℃ 15 s,95 ℃ 5 s,60 ℃ 30 s,共进行40 个循环。2-ΔΔCt法计算目标基因的相对表达水平。
1.2.3 免疫印迹分析收到细胞后,将培养板中的培养液吸干净,PBS 洗涤2 次,每孔细胞板,加入300 µL 的RIPA 裂解液(含50 µL 蛋白酶抑制剂),冰盒上裂解5 min,然后用细胞刮刀刮取细胞,将细胞收集到1.5 mL 离心管中,并加入100 µL SDS 蛋白上样缓冲液,水浴93 ℃ 10 min,取出后自然冷却,测定总蛋白浓度。经过SDSPAGE 电泳,转膜(采用湿转法转膜)。免疫反应,将PVDF 膜置于5%的牛血清白蛋白中,室温(20 ℃~30 ℃)封闭1 h;脱色摇床上,TBST 漂洗3 次,每次5 min;尽量吸干BSA 液,加入一抗(VEGFC 蛋白抗体稀释比1∶200,GAPDH 蛋白抗体稀释比1∶3 000)5 mL,装入杂交袋中,将剪好的PVDF 膜置于其中,捆绑于静音混合仪上,放置4 ℃冰箱中过夜;取出杂交袋,室温复温10 min,去除一抗液体,加入TBST 缓冲液洗膜3 次,每次10 min;加入酶标二抗(兔二抗 1∶3 000,鼠二抗 1∶3 000),室温孵育2 h。TBST 洗膜3 次,每次10 min。ECL 显色:用吸水纸尽量吸干PVDF 膜上的水分后,将其平放在采集化学发光信号凝胶成像仪里;吸取ECL 试剂盒中的A 液和B 液各50 µL 加入900 µL 双蒸水中,混匀,均匀地滴加到膜上;点击live aquire,开始采集图像。
1.2.4 细胞增殖实验用CCK-8 溶液测定细胞存活率。收集各组细胞培养上清于96 孔板,另按试剂盒说明书设置空白孔、对照孔、阴性组,每组3 孔重复;向每孔加入10 µL 的CCK-8 溶液;培养箱中孵育24 h,酶标仪(美国MD 公司)450 nm波长处测定吸光度。
1.2.5 实验动物与照射通过昆明医科大学动物所购买周龄均为6 周左右的SPF 级BALB/C 小鼠用SPF 级饲料条件饲养,经过1 周时间待小鼠情况稳定后,对小鼠进行成瘤实验(合格证号:1107271911003162)。
照射条件:Synergy VAMT,放射源为6MV X-射线,细胞单次受照射剂量为2 Gy 源皮距100 cm 照射,剂量率为300 cGy/min。
1.2.6 动物实验设计向小鼠腋下皮下注射鼻咽癌细胞CNE-2,每日观察瘤体生长情况,待瘤体体积达到0.7 cm3左右,将小鼠随机分为6 组,每组6 只:模型瘤体组为瘤体内注射50 µL 生理盐水连续注射4 d,然后每3 d 补注射1 次;siRNANC 组,每天注射浓度为50 nM 的siRNA-NC 50 µL,连续注射4 d,然后每3 d 补注射1 次;siRNAVEGF-C 组,每天注射浓度为50 nM siVEGF-C 50 µL,连续注射4 d,然后每3 d 补注射1 次;照射组为瘤体内注射50 µL 生理盐水连续注射4 d,然后每3 d 补注射1 次,同时每日进行2 Gy X 射线照射,连续照射4 d;siRNA-NC+照射组为瘤体内注射siRNA-NC,连续注射4 d,瘤体每日照射2 Gy,连续照射4 d,然后每3 d 补注射1 次;照射组+siRNA-VEGF-C,瘤体内注射50 nM si-VEGF-C 50 µL,连续注射4 d,瘤体每日照射2 Gy,连续照射4 d,然后每3 d 补注射1 次。照射后继续饲养小鼠15 d,每天观察肿瘤生长情况,同时用游标卡尺对肿瘤体积测量1 次,V=a2×b/2(a 为瘤体长径、b 为瘤体短径)。15 d 后处死小鼠进行瘤体取材,比较肿瘤大小。
1.2.7 小鼠移植瘤组织免疫组化实验(1)石蜡切片制备 将固定好的组织放入包埋盒中,用乙醇进行脱水处理,二甲苯透明,将透明好的组织块置入在石蜡内,让石蜡易于渗入。将过滤好的新蜡倾入包埋器中,尽快将浸透蜡的组织块放到里面。用石蜡切片机将石蜡块切成4 µm 厚的切片。进行贴片,将完毕的石蜡切片在60 ℃烤箱烘烤过夜。
(2)免疫组化染色 切片进行常规脱蜡、水化,用PBS 漂洗,抗原修复,3%过氧化氢封闭,在用PBS 漂洗,用滤纸将切片周围的水分吸干,用5%羊血清封闭,加合适浓度的第一抗体,反复用PBST 漂洗,滴加PV9000 试剂Ⅰ、Ⅱ,每张组织切片上滴加DAB 显色液,室温避光孵育5 min,蒸馏水冲洗,终止显色,苏木素复染。梯度酒精脱水,二甲苯透明,中性树胶封片,光镜下观察显色结果并拍照。
1.3 统计学处理
采用SPSS 22.O 统计软件进行分析,数据以均数±标准差()表示,多组间比较用单因素方差分析(one way ANOVA),2 组间比较采用t检验。P< 0.05 表示差异有统计学意义;应用ImageJ 软件做蛋白电泳条带灰度分析。
2 结果
2.1 稳定的沉默VEGF-C 表达鼻咽癌细胞系CNE-2 的建立
将VEGF-C 特异性siRNA 序列(siVEGF-C-1、siVEGF-C-2 和siVEGF-C-3)分别转染到CNE-2细胞中。采用CCK-8 法、qRT-PCR 法和免疫印迹法检测不同siRNA 对CNE-2 细胞增殖及VEGFC mRNA 和蛋白表达的影响。如图1 所示,干扰CNE-2 细胞的VEGF-C 后,在0、12、24、36 h后,测定细胞增殖,发现细胞增殖逐渐下降,其中siVEGF-C-1 组细胞增殖下降最明显,见图A。采用qRT-PCR 法检测mRNA 的表达,3 组序列中,siVEGF-C-1 组mRNA 表达量最低,siVEGFC-1 组VEGF-C mRNA 与正常组和阴性对照组比较明显降低(P< 0.01),见图B。siRNA-1 序列转染CNE-2 细胞48 h 后,通过免疫印迹法检测VEGF-C 的蛋白表达,如图C 和D 所示,与正常组和阴性对照组(NC)相比,VEGF-C 蛋白表达显著降低(P< 0.01)。结果表明,采用VEGF-C siRNA 转染试剂盒(RBbio)第1 组序列,进行干扰CNE-2 细胞VEGF-C 能降低VEGF-C mRNA和蛋白表达,成功干扰鼻咽癌细胞CNE-2 中VEGF-C 表达。

图1 鼻咽癌细胞CNE-2 中VEGF-C 干扰序列筛选Fig. 1 The establishment of VEGF-C silenced NPC cell lines
2.2 动物实验检测干扰VEGF-C 对小鼠移植瘤辐射敏感性影响
对小鼠腋下皮下注射鼻咽癌细胞CNE-2,每日观察瘤体生长情况,待瘤体直径达到0.7 cm3左右,将小鼠随机分为6 组,每组6 只。每3 d 观察肿瘤大小,15 d 后处死小鼠进行瘤体取材。收集数据绘制肿瘤生长折线图,结果如图2 所示,si-VEGFC 组肿瘤体积小于si-NC 阴性对照组和瘤体组;si-VEGFC+照射组肿瘤体积小于单独照射组。结果说明:干扰VEGF-C 使肿瘤生长速度减慢,干扰VEGF-C 可增加辐射敏感性。
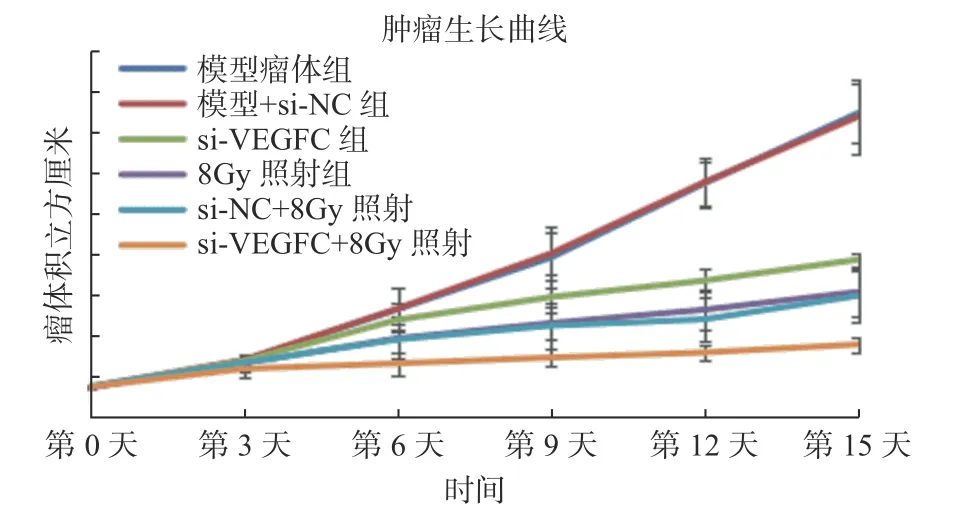
图2 动物实验检测干扰VEGF-C 对肿瘤大小影响Fig. 2 Animal experiment to detect the influence of interfering VEGF-C on tumor size n=6。
2.3 采用免疫组化检测干扰VEGF-C 对小鼠VEGF-C、p-65、ATM 影响
剥离小鼠的肿瘤,4%多聚甲醛固定、包埋、切片,进行免疫组化染色,检测VEGF-C、ATM、p65 蛋白表达变化。如图3 所示免疫组化结果表明:在干扰组中,VEGF-C 蛋白表达明显少于瘤体组和阴性对照组(P< 0.05),照射组与瘤体组相比VEGF-C 增加(P< 0.05);与照射组相比,干扰组+照射组中VEGF-C 蛋白表达降低(P< 0.05),这表明:干扰组成功降低VEGF-C 表达,同时也说明辐射可刺激VEGF-C 表达升高。图4 所示p65 蛋白表达,与瘤体组相比,p65 蛋白表达在干扰组中增加(P< 0.05);但与照射组相比,干扰组+照射组p65 变化不明显,细胞实验表明干扰VEGF-C 可增加p65 表达。图5 表示ATM 蛋白表达变化,与瘤体组和阴性组相比,干扰VEGF-C后ATM 表达减少(P< 0.05);与照射组和阴性对照组+照射组相比,照射组+干扰组中ATM 减少(P< 0.05)。免疫组化结果表明:干扰鼻咽癌细胞CNE-2 中VEGF-C,使p65NF-κB 升 高,NFκB 通路下游ATM 降低。

图3 免疫组化检测VEGF-C 表达(×400)Fig. 3 Immunohistochemical detection of VEGF-C expression(×400)
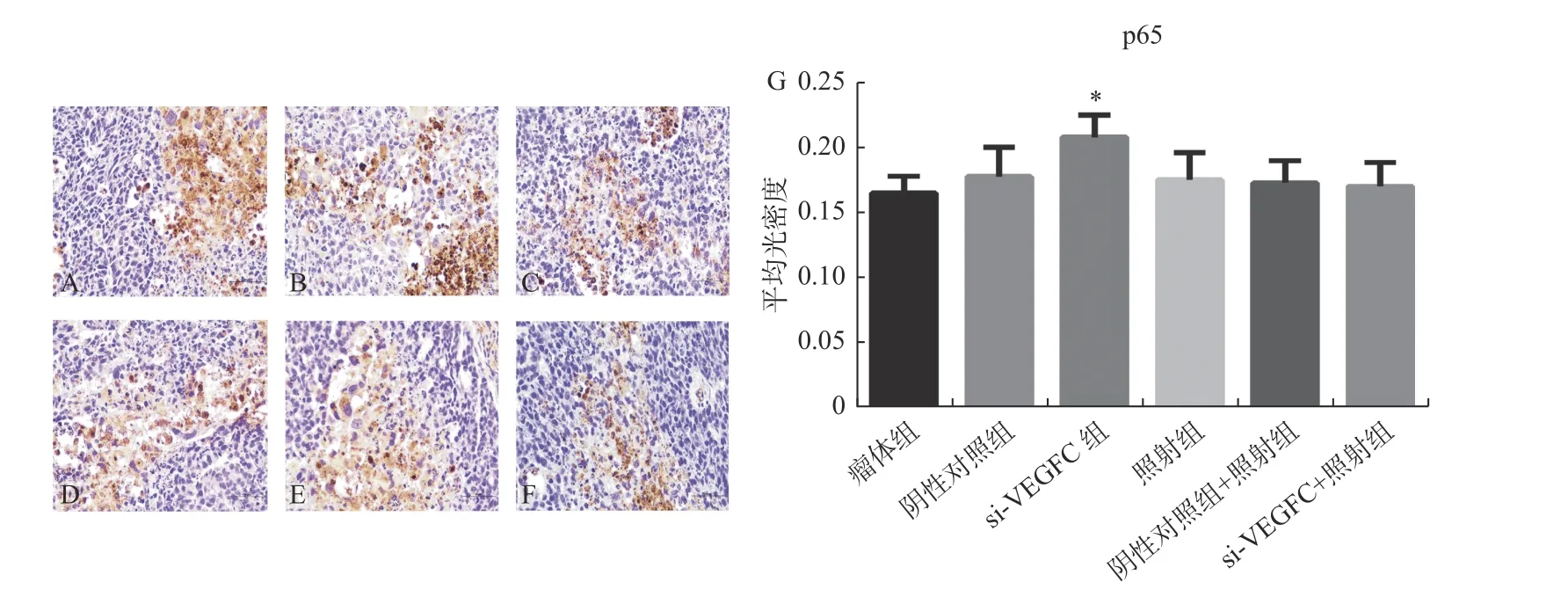
图4 免疫组化检测p65 表达(×400)Fig. 4 Immunohistochemical detection of p65 expression(×400)
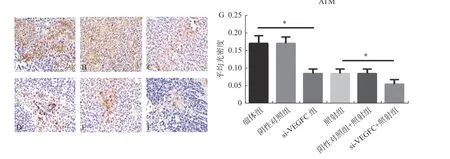
图5 免疫组化检测ATM 表达(×400)Fig. 5 Immunohistochemical detection of ATM expression(×400)
3 讨论
目前研究表明鼻咽癌中VEGF 表达率可达60%~80%左右,通过Meta-analysis 分析发现:组织和血清中血管内皮生长因子水平的测定具有重要意义,可预测鼻咽癌预后[3]。鼻咽癌患者淋巴结转移机率比较高,首诊患者以颈部肿块为主要症状的多达40%~50%左右。VEGF 亚型的VEGF-C 是较早发现能特异性促进淋巴管新生的生长因子[4]。黄方等[5]研究发现在鼻咽癌组织中高表达的VEGF-C、NF-κB p65 及Survivin 与鼻咽癌的临床分期及颈淋巴结转移密切相关,通过检测VEGF-C、NF-κB p65 及Survivin 表达水平,可预判鼻咽癌恶性程度及转移具有一定的意义。研究发现肿瘤细胞可通过自分泌和旁分泌形式释放VEGF-C,与表达淋巴内皮细胞的血管内皮生长因子3 受体特异性结合,进而刺激下游信号通路ERKl/2 和P13K/AKT 信号通路,诱导新生淋巴管和加速肿瘤细胞往区域淋巴结转移[6-7]。
为发现VEGF-C 更多潜在的功能,本研究使用RNA 干预技术,实时定量PCR 检测结果表明:VEGF-C 的mRNA 表达水平在siVEGF-C 组均显著下调;Western Blot 检测VEGF-C 的蛋白质表达水平,结果表明在siVEGF-C 组显著下调。证明成功干扰鼻咽癌细胞 CNE-2 中VEGF-C 基因,可用此技术研究VEGF-C 与放射敏感性的关系。
小鼠移植瘤实验结果证明,干扰VEGF-C 后,接种了鼻咽癌CNE-2 细胞小鼠生长速度减慢,对于照射组,干扰+照射组肿瘤明显变小。15 d 后处死小鼠,通过免疫组化发现,与照射组相比,干扰+照射组,VEGF-C、ATM 减少,与瘤体组相比,干扰组p-65 增加,VEGF-C、ATM 减少。动物实验结果表明:根据肿瘤生长曲线和免疫组化结果发现,干扰鼻咽癌细胞CNE-2 中VEGF-C通过NF-κB 信号通路增加辐射敏感性。这与细胞学实验结果相一致:在鼻咽癌CNE-2 细胞干扰VEGF-C 后,通过NF-κB 信号通路引起ATM减少引起细胞DNA 损伤修复减少,进而提高放疗敏感性[8]。
Gorski 等[9]研究证实:Lewis 肺癌细胞体外接受电离辐射后,VEGF 的表达明显增高。这提示电离辐射诱导肿瘤细胞VEGF 高表达,可能是肿瘤治疗过程中产生抵抗性有关。有研究证实VEGFR2 在肿瘤细胞内表达高低与其对放射线抗拒密切相关,阻断肿瘤细胞内VEGFR2 能提高肿瘤细胞放射敏感性[10]。刘亮等[11]研究发现内皮抑素能增强VEGFR2 高表达肺癌细胞放射敏感性,其机制可能是内皮抑素降低VEGFR2 表达后,通过PI3K/AKT 和MAPK/ERK 2 条非乏氧途径下调HIF-1a 表达,进而增强肺癌细胞放射敏感性。动物实验也表明:抑制鼻咽癌CNE-2 小鼠VEGFC 表达后,明显增加辐射敏感性。
放疗引起的DNA 损伤可激活NF-κB,调节靶基因的转录与表达[12]。NF-κB 可以同时存在促进转录和抑制转录的作用,转录因子究竟发挥促进还是抑制作用,与其结合的调控因子有关,而究竟哪些调控因子会一起结合上去,则与刺激因素有关[13-14]。NF-κB 作为一种转录因子,可与ATM 发生特异性的结合,进而调控细胞的DNA 损伤。Jung 等[15]研究表明:ATM 能够激活NF-κB,并影响辐射敏感性,他们数据表明,ATM 功能降低通过激活NF-κB,促进放疗敏感性。ATM 作为P53 上游基因,P53 蛋白有2 个丝氨酸位点被ATM 磷酸化后活性上调来调控DNA修复,当损伤不能被完全修复,P53 介导细胞发生凋亡。本研究发现DNA 损伤修复基因ATM,在siVEGF-C+照射组中,免疫组化表明ATM 表达下降,导致了细胞DNA 修复受损,进而使DNA 损伤加重,增加放疗敏感性。
综上所述,在移植鼻咽癌CNE-2 细胞小鼠中,干扰VEGF-C 后可明显提高放疗疗效,其机制主要通过激活NF-κB 信号通路进而降低ATM 表达,使DNA 损伤修复能力下降。本研究结果为鼻咽癌的抗血管治疗提供实验依据,随着研究不断深入,相信越来越多证据将会证实辐射联合抗血管治疗可提高放疗疗效。

