改性豆渣对高脂血症大鼠生理和肠道菌群的影响
向沁雪,田 瑞,吴 波,孙国根,陈丽梅,莫开菊,*
(1.湖北民族大学生物与食品工程学院,湖北 恩施 445000;2.风湿性疾病发生与干预湖北省重点实验室(湖北民族大学),湖北 恩施 445000;3.恩施土家族苗族自治州中心医院,湖北 恩施 445000)
豆渣中膳食纤维相对含量达到62.5%,而不被人体消化部分占90.64%,不溶性成分又占不被消化的94.92%[1],因此大豆膳食纤维主要是不溶性成分。大豆不溶性膳食纤维具有与有毒重金属结合的能力[2],以及预防肥胖[3]、控制体质量的效果[4]。
目前,肥胖已成为世界性公共卫生问题。肥胖、高血脂不仅与遗传有关,更与生活习惯、营养偏颇等因素有关,是心脑血管疾病、高血压、糖尿病、肿瘤等多种疾病的诱发因素。脂质主要是食物在肠道被消化吸收入血液,此外饥饿时从脂肪组织或肝脏中也可动员一部分脂质吸收入血液,通过血液循环被运输到全身各处。肥胖者需要通过控制饮食,减少高热量和高脂肪类食品的摄入。膳食纤维具有预防及辅助治疗过度肥胖和高血脂症等疾病的作用。
本实验采用不同方法改性豆渣膳食纤维,考察其调节大鼠血脂和减肥的功效,以期为豆渣膳食纤维的深度开发提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
SPF级Wistar雄性大鼠(3 月龄)70 只,体质量150~200 g,饲养于相对湿度40%~60%、温度为(22±2)℃环境中,所有大鼠饮水和摄食自由,饲喂普通饲料。生产许可证号:SCXK(辽)2020-0001。
原豆渣:普通豆渣用纯净水洗过滤至水清澈,以去除豆渣中的蛋白质;改性豆渣:原豆渣经烘干后按料液比1∶9加入1.5%(质量分数,下同)NaOH溶液或1.5% Na2HPO4溶液,在温度32 ℃、压力20.68 MPa的超临界CO2条件下改性4 h,然后反复洗涤去除可溶性成分,离心留取不溶性残渣,烘干,作为改性豆渣[5],用于动物实验。
脂肪乳配方:10%(相对含量,下同)胆固醇、1%甲基硫氧嘧啶、20%猪油、20%吐温-80、2%胆酸钠、30%丙二醇和17%蒸馏水。
血脂康胶囊 北京北大维信生物科技有限公司;乙醚 国药集团化学有限公司;BL539A多聚甲醛Biosharp生物科技公司;血脂测定试剂盒 潍坊三维生物工程集团有限公司;D3142 DNA提取试剂盒 广州美基生物科技有限公司;液氮 武汉华星工业技术有限公司。
1.2 仪器与设备
NanoDrop微量分光光度计 美国赛默飞世尔科技公司;TG16-WS离心机 湖南湘仪实验室仪器开发有限公司;DYY-6C电泳仪 北京六一生物科技有限公司;TMS-1024i全自动生化分析仪 美生实业有限公司;ETC 811聚合酶链式反应(polymerase chain reaction,PCR)仪 苏州东胜兴业科学仪器有限公司;QuantiFluorTM荧光计 普洛麦格(北京)生物技术有限公司。
1.3 方法
实验周期共76 d,适应期3 d,建模期26 d,干预期45 d,后期处理2 d。
1.3.1 大鼠造模及分组
大鼠造模及分组方法根据文献[6-8]加以整合及完善。适应期后,将大鼠分为高脂饮食(high fat diet,HF)组60 只和空白对照(control check,CK)组10 只,用10 mL/(kg·d)剂量的脂肪乳灌胃建模,以HF的体质量和4 项血脂指标(总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C))与CK组比较,差异显著,判定模型成功。
建模成功后,对高脂饮食组进行二次分组,共分为5 组,每组12 只大鼠,分别是高血脂对照(hyperlipidemia control,HC)组、药物对照(positive drug control,DC)组、未改性豆渣(bean dregs contrast,BC)组和Na2HPO4改性豆渣(disodium hydrogen phosphate modified bean dregs,DB)组及NaOH改性豆渣(sodium hydroxide modified bean dregs,SB)组。
1.3.2 大鼠建模及干预期喂养
灌胃剂量分别为药物对照组灌胃血脂康溶液,剂量为30 mg/(kgmb·d)、豆渣灌胃组分别灌胃不同处理豆渣,剂量1 g/(kgmb·d),高血脂对照组灌胃蒸馏水,剂量为10.0 mL/(kgmb·d)。
建模期和干预期:饲喂普通饲料,自由进食记录每日摄食量,每3 d称体质量。
1.3.3 血脂指标检测
4 项血脂指标检测:建模完成后及干预期每15 d测定血脂水平,将大鼠剪尾取血,取0.3 mL血液于肝素钠负压采血管内;干预完成(即在干预第45天)麻醉后从心脏取血。采血后离心(3 000 r/min、10 min),取血清,采用全自动生化分析仪检测4 项血脂指标即TC、TG、HDL-C、LDL-C浓度。
1.3.4 脏器指数检测
干预45 d后,禁食不禁水,过夜,次日采用吸入乙醚麻醉,打开胸腔,暴露心脏,从心脏处取血(用肝素钠负压采血管),从心尖部位灌注37 ℃生理盐水,洗至内脏无血色,心脏右心耳流出液体为无色。解剖、取出大鼠的肝脏、脾脏、肾脏并称质量。脏器指数计算如下式。

1.3.5 肠道微生物检测
大鼠解剖后取出内脏,放进超净工作台,取出盲肠并将其内容物挤进灭菌后的EP管内,封存并用液氮速冻,于-80 ℃冰箱内保存,送至广州基迪奥生物科技有限公司进行16S rRNA测序,测序区域:16S(V3~V4),引物名称:341F、806R,引物序列分别为5’-CCTACGGGNGGCWGCAG-3’、3’-GGACTACHVGGGTATCTAAT-5’,PCR扩增产物切胶回收,用QuantiFluorTM荧光计定量分析。等量混合纯化的扩增产物,连接测序接头,构建测序文库,利用Illumina PE250上机测序,使用Krona 2.6软件计算每个物种分类的丰度。
1.4 数据处理与分析
实验结果以平均值±标准差表示,采用SPSS 19.0软件进行单因素方差分析检验数据显著性差异以及偏相关性分析,采用Origin软件作图。
2 结果与分析
2.1 高脂血大鼠造模结果
如图1所示,与CK组相比,HC组体质量、TC、TG、LDL-C、HDL-C浓度均有显著或极显著差异(P<0.05、P<0.01),表明造模成功。

图1 造模期大鼠各项指标Fig. 1 High-fat diet feeding induced hyperlipidemia in rats
2.2 大鼠生理指标变化
2.2.1 大鼠体质量变化
实验期间每3 d称1 次体质量,第42天是实验结束前最后1 次称质量,发现第12天是体质量变化的转折点。高脂血症大鼠体质量表现为持续快速增长;干预期第12天后,体质量缓慢增长,干预各组始终低于HC组。如图2所示,HC组体质量在第12和42天均最高,BC、SB、DB干预组体质量明显低于HC组和DC组。干预第42天时,与HC组相比,DC、BC、SB、DB组体质量分别减轻1.5%、10.9%、6.3%、13.3%。
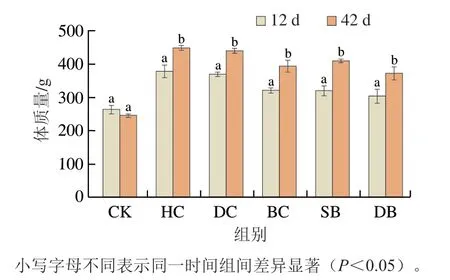
图2 实验期间大鼠体质量变化Fig. 2 Changes in body mass of rats during high-fat diet feeding
2.2.2 大鼠血脂变化
4 项血脂指标中TC、TG、LDL-C浓度过高被认定为高脂血症,而HDL-C是有益的胆固醇,可降低血管壁胆固醇沉积,具有抗动脉粥样硬化作用。由表1可知,豆渣灌胃均能改善大鼠血脂。在整个干预期,除HDL-C外,CK组3 项血脂指标水平较低且平稳,HC组水平较高而平稳,说明在无外部因素干预时不会自发大幅波动。DC组在药物作用下,TC、TG、LDL-C浓度持续下降,HDL-C浓度持续上升,在45 d时与0 d相比,TC浓度下降了19.0%、TG浓度下降30.0%、LDL-C浓度下降35.0%、HDL-C浓度上升了34.9%;45 d与0 d相比,3个豆渣组TC浓度下降了19.7%~32.0%、TG浓度下降了47.0%~59.3%、LDL-C浓度下降了43.2%~55.3%,HDL-C浓度上升了20.9%~48.5%。结果表明豆渣对于高脂血症改善效果明显且效果优于药物组。但是豆渣灌胃组在15 d内变化明显,改善效果依次分别是DB组>SB组>BC组,15 d之后趋于稳定。

表1 实验期间大鼠血脂变化Table 1 Changes in blood lipids in rats during the experiment
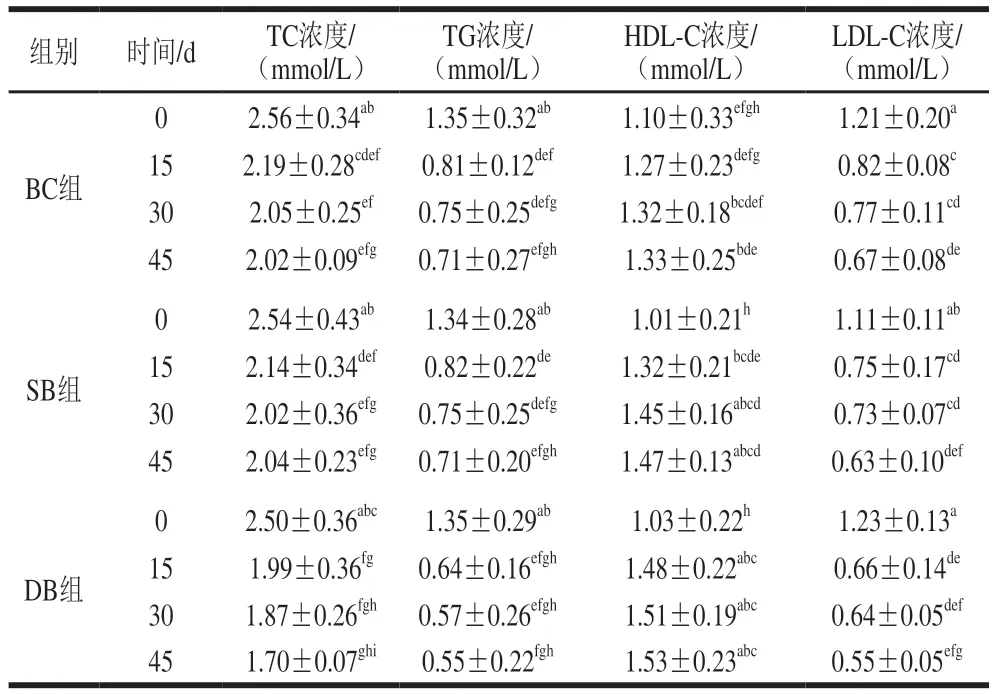
续表1
2.2.3 大鼠脏器指数变化
由表2可见,各组间脏器指数没有显著差异,其中各组间变化较大的是肝脏指数,与HC组相比,DC、BC、SB、DB组下降了5.4%~12.8%。相比于CK组,高脂乳使肝脏指数增大;相较于HC组,灌喂药物和豆渣均使肝脏指数降低,DB组对肝脏指数的改善效果最好,相比HC组下降了12.8%,与CK组的脏器指数接近。
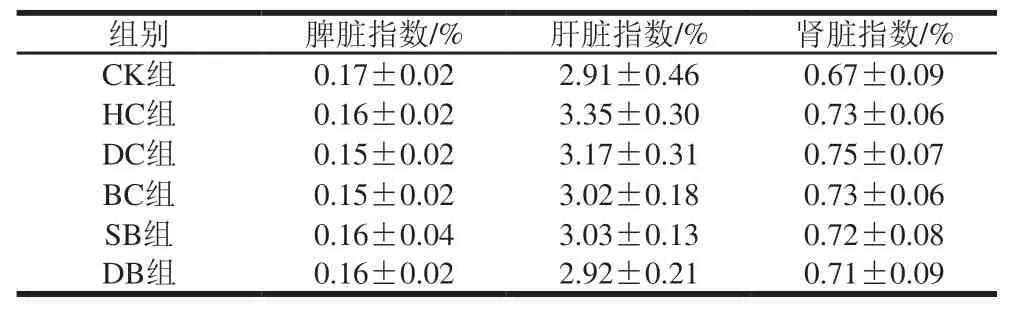
表2 实验期大鼠各脏器指数Table 2 Visceral organ indexes of rats during the experiment
2.3 大鼠肠道微生物物种丰度差异
各组大鼠肠道微生物种群在门、属、种水平上存在一定差异。由表3可知,在门水平上,主要有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria),其中CK组Firmicutes相对丰度占比最高,Bacteroidetes次之,HC组Firmicutes相对丰度最高,Bacteroidetes最低,通过豆渣喂养改善后Bacteroidetes相对丰度明显增大,Firmicutes减少,降低了Firmicutes/Bacteroidetes相对丰度比值,本实验中CK组Firmicutes/Bacteroidetes相对丰度比值为2.72,HC组为3.36,DC组以及3种豆渣膳食纤维组在1.02~1.31之间。
属水平上主要有乳杆菌属(Lactobacillus)、肠杆菌志贺菌属(Escherichia Shigella)和拟杆菌属(Bactericides)。除了CK、SB组以外,Lactobacillus相对丰度均比HC组高,且DB组大幅增长;豆渣各组的Escherichia Shigella相对丰度均较CK和HC组大幅下降;种水平上,主要菌群有产酸拟杆菌(Bacteroides_acidifaciens)和鼠乳杆菌(Lactobacillus_murinus),Lactobacillus_murinus在大鼠肠道内为优势菌,各实验组Lactobacillus_murinus相对丰度与HC组对比均明显上升,效果依次分别为DB组>DC组>BC组>SB组。

表3 大鼠肠道微生物相对丰度变化Table 3 Changes in relative abundance of intestinal microorganisms in rats %
在大鼠肠道菌群中,拟杆菌和厚壁菌为主要的优势细菌,均与肥胖相关。肠道中的厚壁菌群比拟杆菌群多,能更多地吸收食物中的热量,因而增加体质量,进而导致肥胖。Proteobacteria属于致病菌,豆渣组肠道中有益菌群增多,而有害菌群减少。综合来看,DB对肠道菌群具有有益作用。
2.4 大鼠肠道菌群与体质量及血脂指标的相关性分析结果
上述实验结果表明,实验大鼠的理化指标和肠道菌群发生一系列变化,因此将两类指标进行关联,以期找出肠道菌群与健康指标之间的相关性。首先,进行一元线性相关性分析,将具有显著相关性的指标列入表4,不具有显著性的肠道菌未列出。其次,将体质量作为控制变量,对微生物菌群与各项血脂指标进行偏相关分析,同样将有显著相关的指数列于表5。

表4 大鼠肠道菌群与体质量、血脂指标的一元相关性分析结果Table 4 Correlation analysis of intestinal microorganisms with body mass and blood lipids indexes in rats

表5 控制体质量时大鼠肠道菌群与血脂的偏相关分析结果Table 5 Partial correlation analysis of rat gut microbiota and blood lipids during body mass control
由表4可以看出,在门水平上,Firmicutes并未表现出与体质量和血脂指标的相关性(表4中未列出),而在其属水平的Lactobacillus和种水平的Lactobacillus_murinus却与体质量呈极显著正相关(P<0.01),在引起体质量增加时,并不会导致血脂异常,对二者的影响没有同步性。Bacteroidetes与LDL-C浓度之间呈显著负相关(P<0.05),与HDL-C浓度之间呈极显著正相关(P<0.01),显示出拟杆菌对血脂健康的有利影响。Proteobacteria及其所属Escherichia Shigella与HDL-C浓度呈显著负相关(P<0.05),表明其对血脂健康的负面影响。由此可见,肠道菌群的确对体质量和血脂健康有重要影响。
在控制体质量干扰的情况下,菌群与血脂之间偏相关分析的结果如表5所示。Firmicutes中的Lactobacillus丰度与HDL-C浓度呈显著正相关(P<0.05),和TC、TG浓度呈显著负相关(P<0.05),种水平中的Lactobacillus_murinus对血脂4 项指标均表现出有益作用。结合表4及表5可见,Firmicutes的一些菌群既有利于体质量增加,又有利于血脂健康。说明体质量增加不一定引起血脂异常,其深层次机理值得更深入广泛的进行研究。Bacteroidetes及Bacteroides不仅不会引起体质量增加,而且对血脂多项指标的改善有益。Proteobacteria及其所属的Escherichia Shigella与LDL-C浓度呈极显著正相关(P<0.01),Proteobacteria也与TG浓度呈显著正相关(P<0.05),表明其对血脂健康的负面影响。
3 讨 论
膳食纤维有防治高血压、高血脂、肥胖等疾病的效果。大豆种皮多糖可以减轻体质量,降低血清脂质[9]。大豆不溶性膳食纤维对高脂饮食诱导的小鼠肥胖具有预防作用[3],本实验也验证了这一点。
近年来,很多研究证实膳食纤维的减肥作用与肠道菌群的改变相关。小鼠肥胖的发展通常伴随着Firmicutes与Bacteroidetes比例增加以及几种机会性病原体的生长。Turnbaugh等[10]研究指出同窝小鼠中肥胖小鼠厚壁菌丰度高、拟杆菌丰度低,且将其肠道微生物移植到无菌小鼠肠道中,导致后者Firmicutes与Bacteroidetes比例升高,且体脂增加,Thaiss等[11]也获得了同样的研究结果。同样人体肠道中Firmicutes与Bacteroidetes的比例也与肥胖密切相关,Turnbaugh等[12]对肥胖和苗条双胞胎的核心肠道微生物的研究证实了上述结果。肠道微生物群能调节宿主代谢,益生菌和益生元可用于治疗和管理肥胖及几种相关的代谢紊乱[13],益生元可减少超重或肥胖儿童的体脂并改变肠道微生物群[14]。低聚果糖可降低肥胖小鼠肠道菌群Firmicutes与Bacteroidetes的比例[15],可以降低饮食诱导小鼠的肥胖风险[16],也有报道称,肥胖的特征是肠道双歧杆菌数量减少[17-19]。Daniel等[20]通过荟萃分析发现,膳食纤维中果聚糖和低聚半乳糖能增加双歧杆菌和Lactobacillus等肠道益生菌的丰度。
大豆膳食纤维与肠道菌群的关系研究还较少。Wang Bixiang等[21]报道不溶性大豆膳食纤维通过增加乳酸杆菌的相对丰度,改善肠道菌群,降低小鼠肝脏脂质含量和脂肪滴数量。大豆种皮多糖可改善肠道菌群的多样性[22-23]。大豆多糖可调节小鼠和人体的肠道菌群[24-25]。
大豆膳食纤维的减肥降血脂机理是多方面的,除其饱腹感和吸附作用、降低了营养素及油脂、胆固醇等致胖致高血脂物质的摄入外,目前报道较多的是其调节肠道菌群并通过肠道微生物产生乙酸、丙酸、丁酸等短链脂肪酸,影响葡萄糖、脂质和胆固醇代谢,其乙酸导致肥胖,而丙酸和丁酸有助于减重[26-28]。厚壁菌和拟杆菌都以产生丙酸和丁酸为主,但每种菌只产生一种短链脂肪酸。Kim等[29]报道日常饮食中添加豆渣,可以上调肥胖小鼠肝脏中过氧化物增殖激活受体α、下调其细胞凋亡的膜表面分子表达水平,从而改善肥胖。
本实验聚焦于改性豆渣膳食纤维对肥胖和高血脂症大鼠的生理及肠道菌群的影响,丰富了大豆不溶性膳食纤维与血脂健康及肠道菌群的关系研究,对实验大鼠的肠道菌群与相关的生理指标进行相关性分析发现,Firmicutes未对体质量和血脂指标表现出相关性,而Lactobacillus、Lactobacillus_murinus虽然与体质量呈正相关,但是有益于血脂健康,二者对体质量与血脂的影响并不同步。Bacteroidetes及其Bacteroides对HDL-C浓度和LDL-C、TC、TG浓度均有积极影响。Proteobacteria及其所属的Escherichia Shigella对血脂健康有负面影响。有关研究表明[30-32],Bacteroidetes参与类固醇、多糖等代谢,Firmicutes促进宿主从膳食纤维中吸收能量,但是本研究结果提示Firmicutes所属微生物对体质量和血脂的影响存在差异性,值得深入研究厚壁菌微生物种群对机体的不同影响,这将有利于更精准地通过调整肠道微生物调理人体的健康状态。
4 结 论
与HC组相比,灌胃豆渣使大鼠体质量和肝脏指数下降,显著改善4 项血脂指标,豆渣改善效果依次为DB组>SB组>BC组。豆渣使高脂血症大鼠的肠道微生物的物种有所改变,其中DB组最为明显;优势菌群如Bacteroidetes及Firmicutes中的Lactobacillus、Lactobacillus_murinus相对丰度增大,有害菌群的Proteobacteria及其所属的Escherichia Shigella相对丰度减少,说明改性豆渣对血脂和肥胖的改善作用是通过调整肠道菌群实现的。

