脱氢乙酸钠抑制指状青霉的作用机制
谭小丽,龙春燕,李 路,陶能国
(湘潭大学化工学院,湖南 湘潭 411105)
指状青霉(Penicillium digitatum)引起的绿霉病是全球最棘手和最具破坏性的柑橘病害之一,约占柑橘采后病害的60%~90%[1-3]。目前控制柑橘绿霉病的商业化防治手段主要是采用常规化学杀菌剂(如噻苯咪唑、抑霉唑、咪酰胺、咯菌腈和嘧霉胺等),这些药物虽然对病原菌有较好的防治效果,但也具有毒性大、高残留、污染环境以及作用位点单一导致病菌易产生耐药性等缺点[4-6]。
作为新一代的盐类食品防腐剂,脱氢乙酸钠(sodium dehydroacetate,SD)对多种病原菌具有极强的抑制作用,目前已广泛应用于食品、饲料、化妆品、医药等行业的防腐保鲜[7-10]。近年来的研究发现,SD对链格孢霉、灰葡萄孢霉、果链核盘菌、青霉和酸腐菌等采后病原真菌也具有显著的抑制作用,且能够有效延缓多种果蔬采后品质的下降,增强果蔬的贮藏性[11-15]。前期的研究发现,SD对柑橘典型采后病害(如绿霉病、青霉病和酸腐病)具有明显的防治效果,质量分数0.02%~0.08%SD就能显著抑制指状青霉、意大利青霉和酸腐菌的生长,降低贮藏柑橘果实发病率,维持柑橘采后品质[11,13,16]。因此,SD可能是非常有应用前景的防控柑橘绿霉病常规化学杀菌剂的替代品。
研究表明,SD处理能够破坏酸腐菌菌丝体细胞膜和线粒体,导致其菌丝体细胞质流失、质壁分离、胞内物质溶解,胞内ATP含量降低和Na+/K+-APTase活性增加[12];此外,碳酸铵可通过直接损伤意大利青霉菌丝线粒体结构和功能发挥其抑菌活性[17];聚合季铵盐处理不仅能够破坏水稻纹枯病菌细胞的结构完整性和功能,引起细胞质膜受损和线粒体功能障碍,导致胞内物质泄漏,还会严重破坏病原菌细胞壁的完整性,造成胞内碱性磷酸酶(alkaline phosphatase,AKP)的大量外泄[18]。因此,细胞壁、细胞膜和线粒体等可能是盐类物质发挥抑菌作用的直接靶标位点。但SD抑制P. digitatum生长的作用机制尚不清楚,这极大限制了SD在实际生产中的应用。因此,本实验通过研究不同质量浓度SD对P. digitatum菌丝体细胞壁、细胞膜、线粒体功能以及柑橘绿霉病等的影响,分析SD抑制P. digitatum的可能作用机制,以期为柑橘采后绿霉病的持续防治和新型防腐保鲜技术的开发提供理论依据。
1 材料与方法
1.1 菌株、材料与试剂
柑橘指状青霉(P. digitatum)菌种保存于湘潭大学农产品加工与保藏实验室。
金柑果实(八成熟)采购于湖南省湘潭市湘潭大学附近的果园。
SD(分析纯) 上海阿拉丁试剂有限公司;碘化丙啶(propidium iodide,PI)、JC-10线粒体膜电位和Na+/K+-ATPase测定试剂盒 北京索莱宝科技有限公司;AKP试剂盒 上海贝博生物科技有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基由水、土豆、葡萄糖和琼脂粉按照质量比50∶10∶1∶1配制而成;马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基由水、土豆和葡萄糖按照质量比50∶10∶1配制而成。
1.2 仪器与设备
LDZF-50KB立式压力蒸汽灭菌锅 上海申安医疗器械有限公司;SPX-250B-Z型生化培养箱 上海博迅实业有限公司医疗设备厂;Labogene冷冻干燥机 香港环球分析测试仪器有限公司;DS-FI2荧光显微镜 日本尼康仪器有限公司;LC-20AT高效液相色谱仪 苏州市莱顿科学仪器有限公司;UV-6300B紫外-可见分光光度计青岛明博环保科技有限公司。
1.3 方法
1.3.1 SD用量的确定及菌丝体的收集
本课题组前期研究表明,SD对P. digitatum的最小抑菌质量浓度(minimum inhibitory concentration,MIC)和最小杀菌质量浓度(minimum fungicidal concentration,MFC)分别为0.2 g/L和0.4 g/L[13],因此本研究直接使用此质量浓度进行后续实验。
菌丝体样品收集:取-80 ℃保藏的P. digitatum菌液5 μL,加入100 μL PDB培养基混匀,涂布于新灭菌的PDA培养基,25 ℃培养5 d,用直径6 mm的无菌打孔器在新培养好的P. digitatum平板上取菌苔,置于各新灭菌的PDA培养基中间,倒置培养5 d。刮取PDA培养基中的P. digitatum孢子置于无菌水中,调整孢子浓度为1×107spores/mL(血球计数板计数法测得),将20 μL孢子悬浮液注入无菌PDB培养基,25 ℃、160 r/min振荡培养48 h,用质量浓度分别为0、1/2 MIC和MIC的SD处理120 min,并分别在0、30、60 min和120 min 4个时间点取样,离心收集菌丝体。
1.3.2 胞内和胞外SD质量浓度测定
胞内和胞外SD质量浓度测定参考刘海龙[19]方法。菌液用纱布过滤,滤液用于测定胞外SD含量。收集的菌丝体用无菌水清洗3 次,液氮研磨,取1.0 g于离心管中,加入3 mL乙腈混匀,随后加入40 μL冰醋酸混匀,超声提取20 min,5 000 r/min离心10 min,取上清液,残渣重复提取1~2 次,合并上清液,加入1 mL正丙醇,45 ℃旋转蒸发干燥。利用2 mL流动相(V(甲醇)∶V(0.02 mol/L乙酸铵)=31∶69)溶解残渣,超声1 min,10 000 r/min离心10 min,上清液过0.22 μm有机系滤膜备用。高效液相色谱检测条件:C18分析柱(250 mm×4.6 mm);流速1.0 mL/min;流动相(V(甲醇)∶V(0.02 mol/L乙酸铵)=31∶69)线性洗脱;紫外检测器;检测波长293 nm;进样量10 μL。
1.3.3 细胞壁完整性的检测
细胞壁完整性的检测参考Tang Xu等[12]方法。挑取少量菌丝体在载玻片上,加入10 μL钙荧光白(calcofluor white,CFW)染色10 s,之后加入等量KOH溶液(质量分数10%)洗脱背景色,置于荧光显微镜下观察拍照,每组重复3 次。
AKP活力测定参考Tang Xu等[12]的方法。培养的菌液用4 层纱布过滤,收集上清液,用于检测胞外APK活力。菌丝体用无菌水清洗3 次,取过滤后菌丝体0.50 g,加入2 mL磷酸缓冲盐液(phosphate buffered saline,PBS)(0.10 mol/L、pH 7.0,含1.5 g/L 4-氨基安替吡啉),液氮研磨,4 000 r/min离心20 min,收集上清液,用于检测胞内APK活力。AKP活力测定具体步骤按照说明书进行。定义40 ℃每克样品每分钟催化水解产生1 μmol酪氨酸为一个酶活力单位,AKP活力单位为U/g。
1.3.4 细胞膜完整性检测
细胞膜完整性的检测参考李路等[20]的方法。取0.10 g菌丝体,加入1 mL pH 7.0 50 mmol/L PBS、10 μL 1 mg/mL PI染液,于37 ℃下水浴15 min,之后用PBS洗数次去除残留染液,取少量菌丝体制片,置于荧光显微镜下观察、拍照。使用荧光分光光度计检测样品荧光强度,参考李路等[20]方法计算相对荧光强度。
1.3.5 菌丝体总脂质含量和胞外pH值测定
将培养48 h的菌液用纱布过滤,取滤液,用pH计测定胞外pH值。菌丝体总脂质含量测定参照Zhou Hai’en等[21]的方法,以胆固醇为标准品,绘制标准曲线,根据样本在520 nm波长处的吸光度以及标准曲线方程计算各样品总脂质含量,单位为mg/g。
1.3.6 菌丝体线粒体膜电位和Na+/K+-ATPase活力的测定
线粒体膜电位采用JC-10线粒体膜电位检测试剂盒测定。线粒体膜电位较高时,JC-10聚集在线粒体基质中形成聚合物,可以产生红色荧光;线粒体膜电位较低时,JC-10不能聚集在线粒体的基质中,此时JC-10为单体,可以产生绿色荧光。用红绿荧光强度比来表征线粒体膜电位,进而反映线粒体功能的受损程度。
Na+/K+-ATPase活力测定参考相应试剂盒说明书进行。定义每小时每克菌丝体中Na+/K+-ATPase分解ATP产生1 μmol无机磷的用量为一个酶活力单位,Na+/K+-ATPase活力单位为U/g。
1.3.7 ATP、ADP、AMP含量的测定和能荷的计算
ATP、ADP、AMP含量的测定和能荷的计算参考辛志彤[22]的方法。取1.3.1节制备的菌丝体,用灭菌的ddH2O清洗,称取适量样品(0.1 g)于试管中,加入煮沸的MgSO4溶液(5 mL、2 mmol/L),混匀,100 ℃水浴15 min后取出立即流水冷却,液氮研磨并离心(4 000 r/min、4 ℃),上清液用于高效液相色谱测定胞内ATP、ADP、AMP含量。液相色谱条件:C18分析柱(250 mm×4.6 mm);流动相为V(缓冲液)∶V(甲醇)=97.5∶2.5,缓冲液为0.05 mol/L KH2PO4-K2HPO4溶液(含1 mmol/L pH 6的乙二胺四乙酸);紫外检测器;等度洗脱;流速1.0 mL/min;柱温25 ℃;检测波长259 nm;进样体积20 μL。
1.3.8 SD对金柑果实绿霉病干预实验
采摘下来的金柑果实于15 ℃贮藏库放置过夜,先用自来水冲洗干净,再用次氯酸钠溶液(体积分数2%)处理2 min,之后蒸馏水冲洗3 次,晾干,用无菌手术刀在果实赤道处前后对称划2个十字伤口(1 mm×1 mm)。接种10 μL(1×105CFU/mL)孢子悬浮液于伤口处,静置4 h。将果实随机分成4 组,每组3个重复,分别浸泡于不同质量浓度的SD溶液(0、4 MFC、8 MFC、16 MFC)中30 s。果实自然晾干后,每10个果实一筐,用聚乙烯保鲜袋包装,置于培养箱(温度25 ℃、相对湿度90%)培养6 d。每天拍照并统计果实腐烂率,腐烂率计算参考李路等[20]的方法。
1.4 数据处理与分析
所有实验均重复3 次,结果以平均值±标准差表示。采用SPSS 16.0软件进行统计分析,采用Duncan’s test检验差异的显著性,以P<0.05表示差异显著。使用Origin 2017软件绘图。
2 结果与分析
2.1 SD处理对P. digitatum菌丝体胞内和胞外SD水平的影响
如图1A所示,与对照相比,1/2 MIC SD和MIC SD处理菌丝体后,胞内SD质量浓度迅速升高,且分别在处理60 min和30 min时达到峰值,之后有所下降但仍维持较高水平,在整个处理期间SD处理组胞内SD质量浓度均显著高于同时期对照,结果表明SD在处理30 min时已进入胞内,致使胞内SD质量浓度增加。胞外SD质量浓度主要受SD处理质量浓度的影响,在整个处理期间维持稳定,且处理组胞外SD质量浓度均高于同时期对照(图1B)。
2.2 SD处理对P. digitatum菌丝体细胞壁完整性的影响
利用CFW染料染色后,蓝色荧光较亮的部分为几丁质沉积最多的隔膜和菌丝体顶端。在整个处理期间,对照组与处理组菌丝体细胞壁荧光分布均匀(图2A),说明SD处理不影响菌丝体细胞壁荧光。
如图2B所示,在0~120 min,处理组与对照组菌丝体胞外AKP活力整体呈上升趋势,120 min时,1/2 MIC SD处理组((4.187 7±0.317 8)U/L)和MIC SD处理组((4.556 6±0.317 0)U/L)AKP活力均高于对照组((4.094 3±0.359 5)U/L),但与对照间无显著差异。
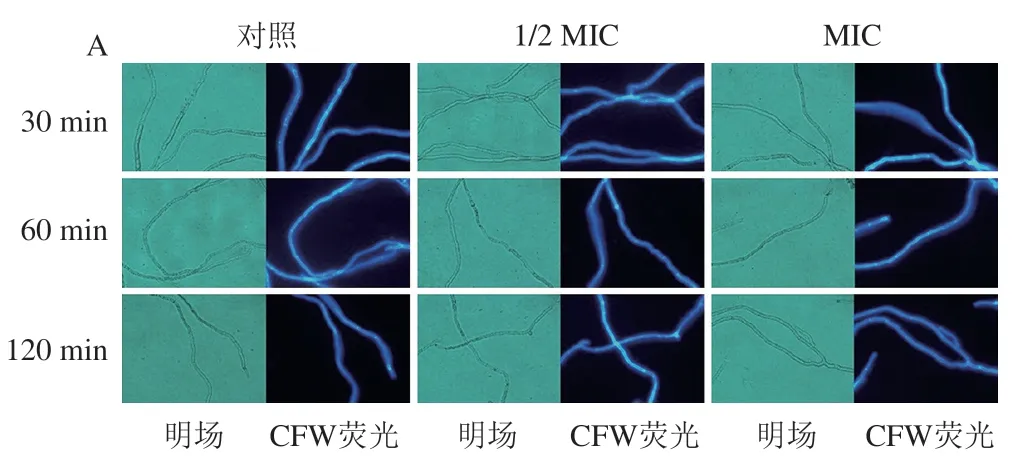

图2 SD处理对P. digitatum菌丝体细胞壁完整性的影响Fig. 2 Effect of SD on the cell wall integrity of P. digitatum mycelia
2.3 SD处理对P. digitatum菌丝体细胞膜完整性的影响
PI染料染色结果如图3所示,1/2 MIC SD处理菌丝体30 min时,出现微弱的红色荧光,且随处理时间的延长,红色荧光增强;处理120 min时,相对荧光强度显著高于对照,为对照组的1.36 倍。MIC SD处理组在30 min即出现明显的红色荧光,且随处理时间的延长,红色荧光和相对荧光强度均增加,均高于同期1/2 MIC SD处理组和对照组。
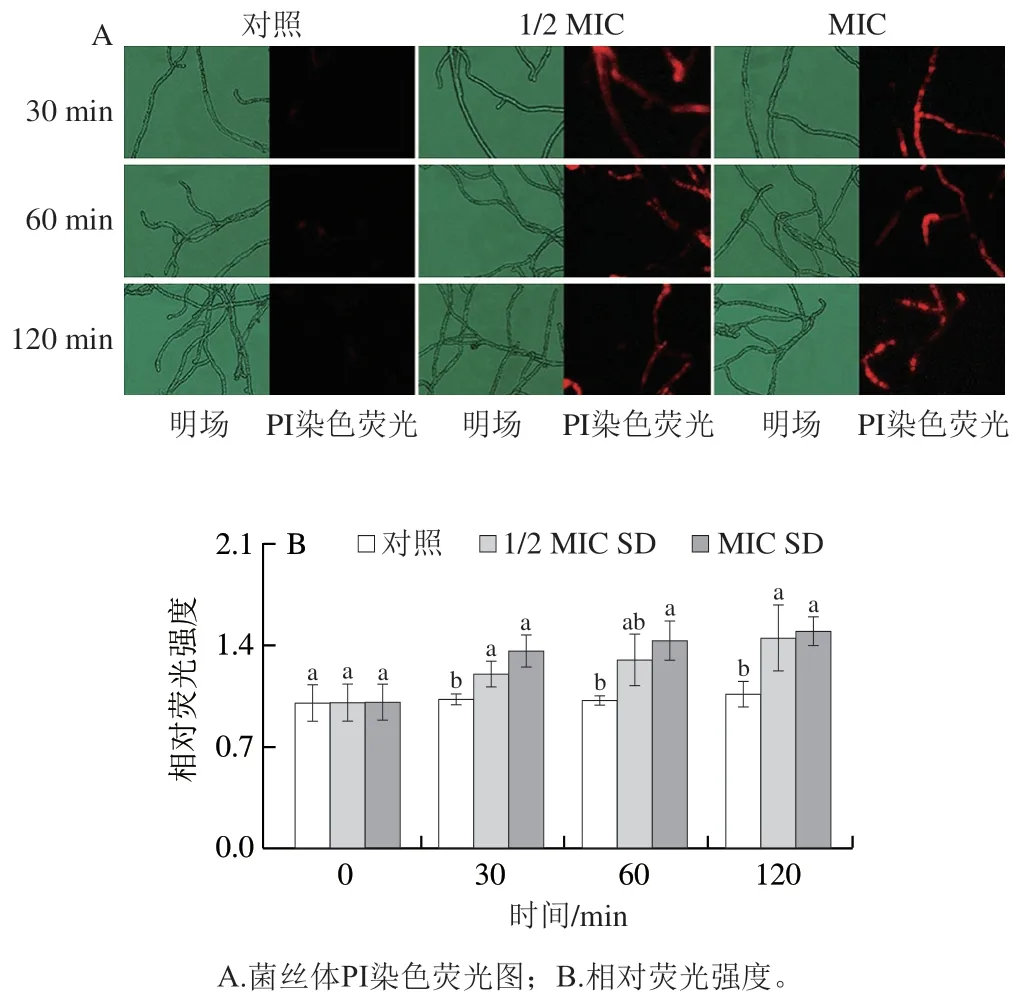
图3 SD处理对P. digitatum菌丝体细胞膜完整性的影响Fig. 3 Effect of SD on the cell membrane integrity of P. digitatum mycelia
2.4 SD处理对P. digitatum菌丝体总脂质含量和pH值的影响
由图4A可知,与对照相比,SD处理30 min后显著降低了菌丝体总脂质含量(P<0.05)。在处理60 min时,1/2 MIC和MIC SD处理组的总脂质含量分别比对照((524.63±33.40)mg/gmf)降低了24%和30%,仅为(396.60±19.63)mg/gmf和(366.82±59.11)mg/gmf。
菌丝体胞外pH值变化如图4B所示。由于SD溶液呈弱碱性,在0 min时,MIC SD处理组pH值高于1/2 MIC SD处理组和对照组。MIC SD处理组和1/2 MIC SD处理组的pH值在前60 min持续升高并在之后维持较高的水平,而对照组在整个处理期间变化较小。
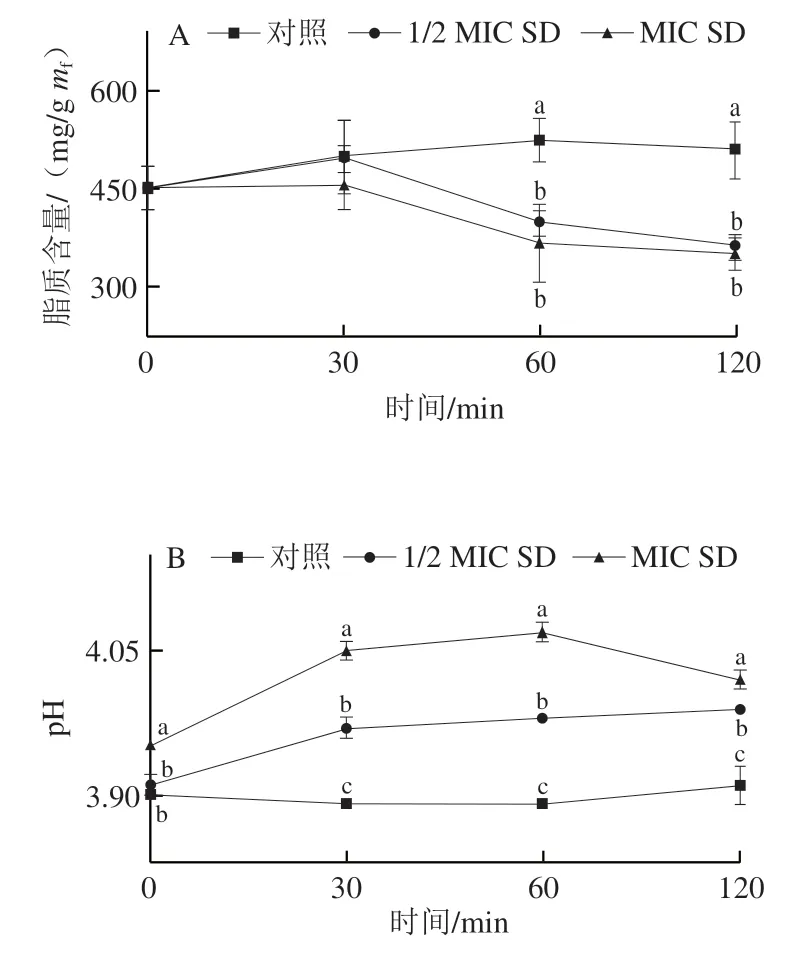
图4 SD处理对P. digitatum菌丝体总脂质含量(A)和胞外pH值(B)的影响Fig. 4 Effect of SD on total lipid content (A) and extracellular pH (B)of P. digitatum mycelia
2.5 SD处理对P. digitatum菌丝体线粒体膜电位的影响
菌丝体线粒体膜电位荧光变化如图5所示,对照菌丝体线粒体膜电位在整个处理期间一直维持较高水平;与对照相比,SD处理显著降低了线粒体膜电位。在30 min时,MIC SD处理组的红绿荧光强度比显著低于对照和1/2 MIC SD处理组,之后一直维持在较低的水平。在处理30 min后,1/2 MIC SD处理组与MIC SD处理组间红绿荧光强度比差异不显著,但均显著低于对照。
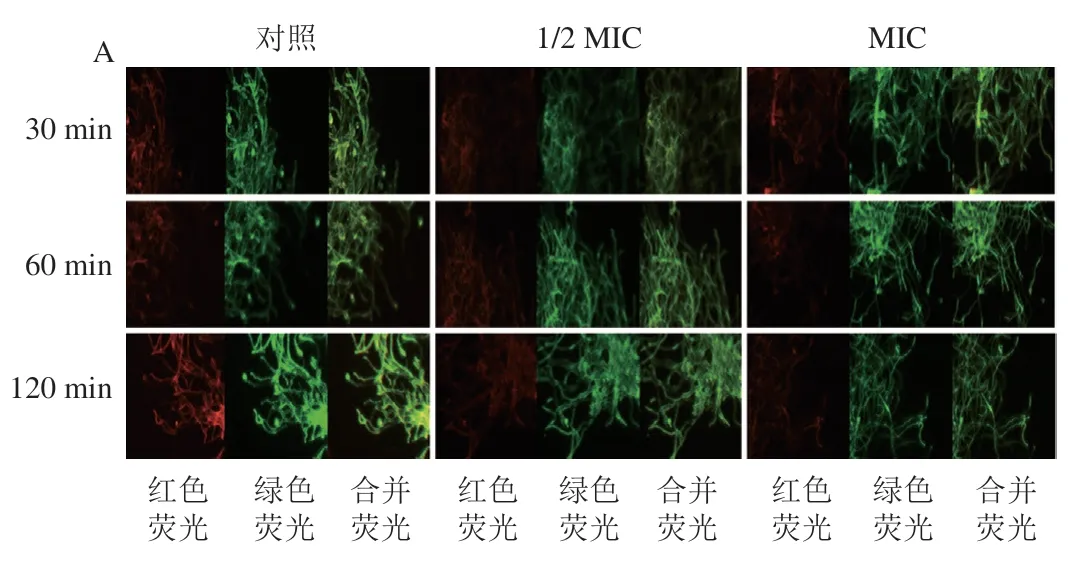
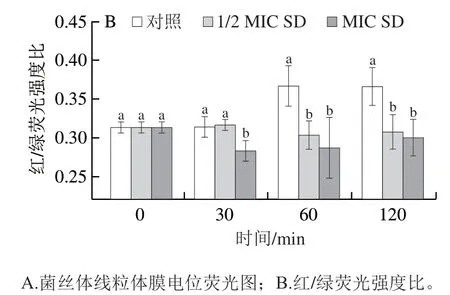
图5 SD处理对P. digitatum菌丝体线粒体膜电位的影响Fig. 5 Effect of SD on the mitochondrial membrane potential of P. digitatum mycelia
2.6 SD处理对P. digitatum菌丝体能量水平的影响
菌丝体能量水平变化如图6所示,对照组、1/2 MIC SD处理组和MIC SD处理组的ATP含量均呈先升后降的变化趋势,相比于对照组和MIC SD处理组,1/2 MIC SD处理组降低了P. digitatum菌丝体胞内ATP含量,但3个处理组之间无显著差异。在处理30 min时,1/2 MIC SD处理组和MIC SD处理组的ADP含量均高于对照组,MIC SD处理组显著高于对照组。对照组AMP水平在30 min后逐渐增加,而SD处理进一步加速其积累。此外,与对照相比,SD处理组在整个处理期间维持了更低的能荷水平。
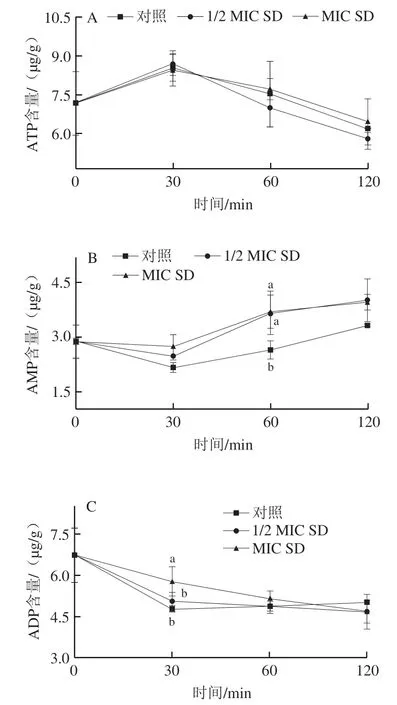

图6 SD处理对P. digitatum菌丝体能量代谢的影响Fig. 6 Effect of SD on energy metabolism of P. digitatum mycelia
2.7 SD处理对P. digitatum菌丝体Na+/K+-ATPase活力的影响
如图7所示,对照菌丝体Na+/K+-ATPase活力在整个处理期间保持稳定,而SD处理组菌丝体的胞内Na+/K+-ATPase活力在整个处理期间持续增加。在处理60 min时,MIC SD处理组的Na+/K+-ATPase活力显著高于对照组;在处理120 min时,MIC SD处理组和1/2 MIC SD处理组菌丝体的Na+/K+-ATPase活力均达到最高,且显著高于对照组。
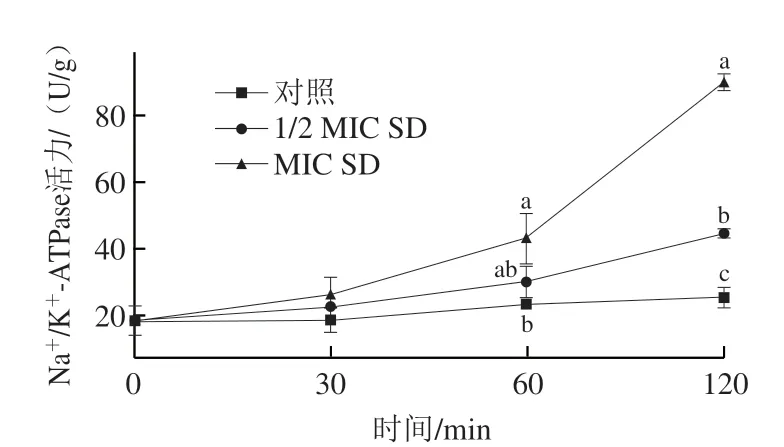
图7 SD处理对P. digitatum菌丝体胞内Na+/K+-ATPase活力的影响Fig. 7 Effect of SD on intracellular Na+/K+-ATPase activity of P. digitatum mycelia
2.8 SD处理对接种P. digitatum金柑果实绿霉病的影响
由表1和图8可知,对照组果实在接种第2天即发病,金柑表面伤口处呈现水渍状病症,随着接种后贮藏时间的延长,病斑面积逐渐扩大,在接种后第4天时,果实表面出现明显的绿色粉状霉层,在第6天时果实发病率达到100%,伤口处向内凹陷,整果腐烂。与对照相比,不同质量浓度的SD处理可不同程度地抑制果实绿霉病的发生和病斑面积扩大,抑制效果呈浓度依赖效应。低质量浓度的SD处理组(4 MFC和8 MFC)在接种第2天时同样发病,但发病率和发病症状明显低于对照。16 MFC SD处理组在第3天时才发病,在接种第6天时,发病率仍比对照低54.2%。

表1 SD处理对接种P. digitatum金柑果实发病率的影响Table 1 Disease incidence of inoculated kumquat fruit treated with SD%
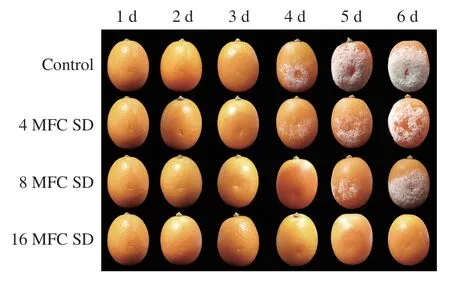
图8 SD处理对接种P. digitatum金柑果实绿霉病发生的影响Fig. 8 Disease progression in inoculated kumquat fruit treated with SD
3 讨 论
人们对使用常规化学杀菌剂带来的食品安全、环境污染、病原菌耐药性等问题的担忧,以及对无毒、无害和环境友好型抑菌剂的需求,为具有良好抑菌效果的盐类食品防腐剂提供了前所未有的发展机遇,且盐类食品防腐剂独特的阳离子赋予其更高的抑菌活性和水溶性[5,23-26]。然而,相比对盐类物质抑菌活性的研究,目前对包括SD在内的盐类物质抑菌机制仍知之甚少。
研究发现,盐类物质抑菌机理可能是不同阴离子和阳离子的直接毒性作用、渗透胁迫、pH值的改变和诱导宿主抗病机制相关的间接因素(木质化、苯丙烷通路上调和抗真菌相关化合物的生物合成或积累)[5,24,27-29]。对于碳酸钠和碳酸氢盐,其主要通过碳酸盐离子的缓冲作用和碱性环境的形成来发挥抑菌作用。相比菌丝体生长,产酸需要更多的能量[30]。P. digitatum在酸性条件下比在中性和碱性条件下生长得更好。本研究发现,SD处理P. digitatum菌丝体30 min时,菌丝体胞内SD的水平显著增加,且在整个处理期间维持相对较高的水平,表明在处理30 min时SD已进入细胞发挥作用。Na+/K+-ATPase活力明显增加表明SD处理激活了质膜上的钠-钾泵,促进了SD的主动运输,从而增加了胞内SD的水平。作为弱碱性的盐类物质,MIC的SD加入从初始就提高了病原菌胞外pH值,但1/2 MIC的SD没有明显提高胞外pH值,随处理时间的延长,两个处理质量浓度下的病原菌胞外pH值均提升,表明SD处理可能加速了胞内离子的泄漏,但SD具体的作用靶标仍有待研究。盐离子的缓冲作用和对环境pH值的调节可能是SD发挥抑菌作用的一个原因。
前期的研究表明,对细胞壁、细胞膜和线粒体等结构与功能的影响可能是盐类物质发挥抑菌作用的实质,但不同盐类物质对不同病原菌的影响存在一定差异[11-12,17-18]。几丁质作为细胞壁构成的重要组分,可与CFW染料结合,在紫外光下发出蓝色荧光,其强度的变化可以直观反映处理对细胞壁结构的影响[31]。如Ouyang Qiuli等[32]发现,肉桂醛处理可明显降低P. digitatum菌丝体的细胞壁荧光强度,抑制菌丝体生长,胞外APK的泄漏进一步证明肉桂醛破坏了酸腐菌细胞壁完整性。本研究发现,在整个处理过程中,不同质量浓度的SD均未显著影响P. digitatum菌丝体细胞壁荧光强度,且SD处理组的胞外AKP水平也与对照无显著性差异。Tang Xu等[12]也发现SD处理未损伤酸腐菌的细胞壁。由此推测,细胞壁可能不是SD发挥抑菌作用的直接靶标。功能正常的细胞膜对物质具有选择透性,而在其遭受破坏时细胞透性增加。PI染料可在细胞膜受损时进入细胞与DNA结合,在荧光下出现红色荧光[33]。本研究中,对照菌丝体在整个过程未出现红色荧光,而SD处理组30 min时即出现红色荧光,且红色荧光随着SD质量浓度的增加而增强。这表明SD处理破坏了P. digitatum细胞膜的完整性。进一步的细胞膜总脂质含量测定结果表明,SD处理显著降低了菌丝体细胞膜总脂质水平,且MIC SD处理组降低效果更明显。这是导致SD处理组胞外pH值升高的重要原因,pH值的升高不利于孢子萌发和菌丝体在果实表面的定植,从而可减少果实的发病[34]。这些结果表明,SD可通过直接破坏P. digitatum菌丝体细胞膜结构完整性和功能来发挥其抑菌作用。线粒体作为细胞能量供应的主要场所,对细胞内各种需能反应的正常进行至关重要,因此,也常成为多种抑菌物质的作用靶标[35-36]。本实验检测了菌丝体线粒体的膜电位和能量变化,结果发现SD处理能够降低线粒体膜电位和细胞能荷水平。但对于ATP和ADP,SD处理期间并未直接降低细胞ATP水平,也只是在后期降低了细胞ADP的水平,表明SD破坏细胞膜的同时间接影响了线粒体的功能。这与Tang Xu等[12]研究SD处理酸腐菌的结果一致,表明线粒体不是SD起抑菌作用的直接靶标,但对其间接的影响也增强了SD的抑菌作用。
综上,SD可通过主动运输进入P. digitatum菌丝体细胞,直接损伤细胞膜,导致胞内离子泄漏和胞外pH值升高,最终影响线粒体的能量供应,引起菌丝体的凋亡,从而发挥其抑菌活性,减少柑橘绿霉病的发生。对SD是否还有其他作用靶标及其抑菌的分子机制仍有待进一步研究。

