基于量子化学计算分析裸燕麦源两种活性肽抗氧化机理
付 媛,张美莉,张 宇,高韶辉
(1.内蒙古农业大学理学院,内蒙古 呼和浩特 010018;2.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
抗氧化剂可以清除自由基,并在维持细胞功能方面发挥关键作用[1]。其中,抗氧化肽可通过抑制脂质氧化、螯合金属离子等多种方式来提高机体的抗氧化、抗衰老、抵抗疾病能力,是备受青睐的一类抗氧化剂[2-3]。最近的研究表明,抗氧化肽的抗氧化活性与肽段大小、组成以及肽序列都有很大关系[4-5]。芦鑫[6]研究发现,芝麻抗氧化肽中天冬氨酸、苯丙氨酸、谷氨酸出现的几率大;Luo Xiaoyu等[7]分离出氨基酸序列分别为GEVPW、YMENF、AFYRW的3种抗氧化肽,均表现出较好的抗氧化效果;付媛等[8]从裸燕麦中分离出的活性肽(苯丙氨酸-亮氨酸-色氨酸-甘氨酸-苏氨酸-亮氨酸)表现出较好的自由基清除性能,经结构分析发现,该活性肽链中亮氨酸也出现在末端,并且肽链中也出现色氨酸,推测其可能起到促进抗氧化作用。然而,目前活性肽在体内的抗氧化机理研究仍面临很大的挑战,一些研究利用各种动植物蛋白水解产物中分离得到的多肽片段,通过氨基酸测序确定其一级结构,试图分析其构效关系,但是由于抗氧化肽氨基酸组成和空间结构复杂,实验手段很难准确获得多肽抗氧化活性的作用位点和电子转移路径[9-10]。在这种情况下,量子化学模拟方法体现出更大的优势。文超婷[11]采用量子化学对西瓜籽抗氧化肽P1-P5的化学结构进行分子模拟,计算P1-P5的前线分子轨道分布和能量、原子净电荷分布和键长,并推测出P1-P5的活性位点;聂挺等[12]采用半经验AM1和密度泛函理论(density functional theory,DFT)研究了天然抗氧化肽的活性位点,并提出了抗氧化肽自由基清除活性机理。
本课题组前期从燕麦中分离出两种多肽(燕麦活性肽I及II),并确定了活性肽I的氨基酸序列结构,前期研究证明,裸燕麦源多肽确实可通过改变代谢通路来实现抗氧化的作用[8],但是对于多肽氨基酸序列结构与抗氧化性之间的构效关系并没有阐明。本实验对活性肽II的氨基酸序列结构进行确定,并利用动物实验测定了两种多肽以及对照物分子VC的抗氧化活性,进一步通过量子化学计算获得两种裸燕麦源多肽的电子结构和分子构型,推测其清除自由基的活性位点,以期揭示裸燕麦源多肽清除自由基的机理,为裸燕麦抗氧化产品的开发和生产提供参考。
1 材料与方法
1.1 动物、材料与试剂
健康昆明种小白鼠,雄性,体质量(20±2)g,购自内蒙古大学实验动物部。生产许可证号:SCXK(蒙)2016-0001,使用许可证号:SYXK(蒙)2010-0006。
裸燕麦产自内蒙古自治区武川县,晒干、粉碎后过60 目筛备用。
D-半乳糖 美国Sigma公司;碱性蛋白酶(200 000 U/g)英国BDH公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、单胺氧化酶-B(monoamine oxidase-B,MAO-B)试剂盒、总蛋白定量测试盒 南京建成生物工程研究所。
1.2 仪器与设备
SCIENTZ-12N冷冻干燥机 宁波新芝生物科技股份有限公司;Epoch2多功能微孔板检测仪 美国BioTek公司;H2500R-2高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;Triple TOF 5600+质谱(mass spectrometry,MS)仪 美国SCIEX公司;1290 Infinity高效液相色谱(high performance liquid chromatography)系统 美国Agilent公司。
1.3 方法
1.3.1 燕麦源活性肽的制备
按本课题组前期研究[8-10]方法,以裸燕麦为原料制备两种活性肽(活性肽I及II),并采用HPLC-MS/MS鉴定活性肽II氨基酸序列。
1.3.2 实验动物分组及处理
50 只昆明种健康小鼠随机分为5 组:正常对照组、衰老模型组、活性肽I治疗组、活性肽II治疗组及VC阳性对照组。除正常对照组外,其他各组按120 mg/(kgmb·d)剂量颈背部皮下注射D-半乳糖,正常对照组注射等量生理盐水;活性肽I治疗组、活性肽II治疗组分别灌胃1 000 mg/(kgmb·d)活性肽I或活性肽II,VC阳性对照组灌胃100 mg/(kgmb·d)VC。每日定时灌胃、注射一次,连续6 周[13-15]。
1.3.3 生化指标的测定
参考本课题组前期研究[10]方法,利用相应试剂盒分别测定小鼠血清中SOD、GSH-Px、CAT活力以及脑组织中GSH-Px、MAO活力和MDA含量。
1.3.4 量子化学计算
本实验所有计算均基于DFT平面波超软赝势法,运用Materials Studio 17.2软件中的Dmol3模块进行计算与分析[16]。计算时采用广义梯度近似(generalized gradient approximation,GGA)中的PBE(Perdew-Burke-Ernzerhof)泛函。使用Grimme的DFT-D经验修正方案,研究范德华相互作用。优化收敛公差集设置为1.0×10-5Ha(能量)、2.0×10-3Ha/Å(梯度)、5.0×10-3Å(位移)和1.0×10-6(自洽场(self consistent field,SCF)精度)。迭代子空间的直接反转(direct inversion in the iterative space,DIIS)尺寸设置为6,自旋极化设置为不受限制。通过测定的氨基酸序列连接氨基酸分子建立活性肽I及活性肽II的初始结构,对照物VC分子的初始结构取自Materials Studio 17.2软件数据库。依据多肽分子优化后的构型使用公式(1)、(2)计算评估自由基进攻能力的f0(r)指数[17]。
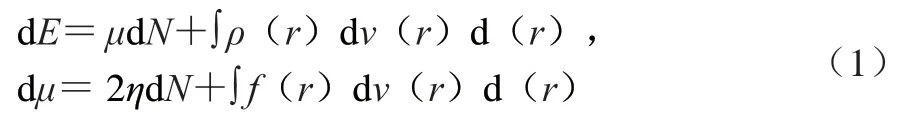
式中:E表示基态电子能;μ表示化学势;N表示物质所含电子数;v表示外势;ρ(r)表示电子密度;η表示硬度;f(r)表示Fukui函数。
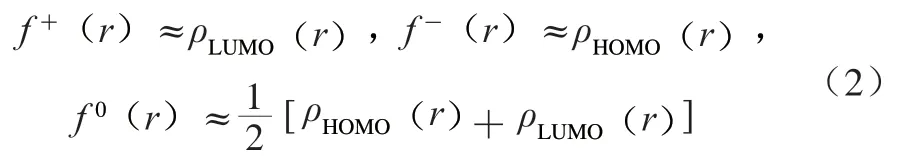
式中:ρHOMO(r)和ρLUMO(r)分别表示分子受到亲电攻击、亲核攻击时,分子中原子的最高占用分子轨道(highest occupied molecular orbital,HOMO)和最低未占用分子轨道(lowest unoccupied molecular orbital,LUMO)上的电荷密度;f0(r)为自由基攻击指数,其反映自由基进攻的能力;f+(r)为亲核攻击指数;f-(r)为亲电攻击指数。
1.4 数据处理与分析
采用SPSS 20.0软件对结果进行t检验统计学处理,测定结果数据均用表示。
2 结果与分析
2.1 裸燕麦源活性肽的结构
采用HPLC-MS/MS技术鉴定活性肽II结构,结果如图1所示,活性肽II的氨基酸序列为缬氨酸-苯丙氨酸-天冬酰胺-天冬氨酸-精氨酸-亮氨酸(Val-Phe-Asn-Asp-Arg-Leu,VFNDRL);结合本课题组前期工作[8],已知活性肽I的氨基酸序列为苯丙氨酸-亮氨酸-色氨酸-甘氨酸-苏氨酸-亮氨酸(Phe-Leu-Trp-Gly-Thr-Leu,FLWGTL),显然二者含有不同的氨基酸排列次序,由此可推测其抗氧化能力应该有所不同。
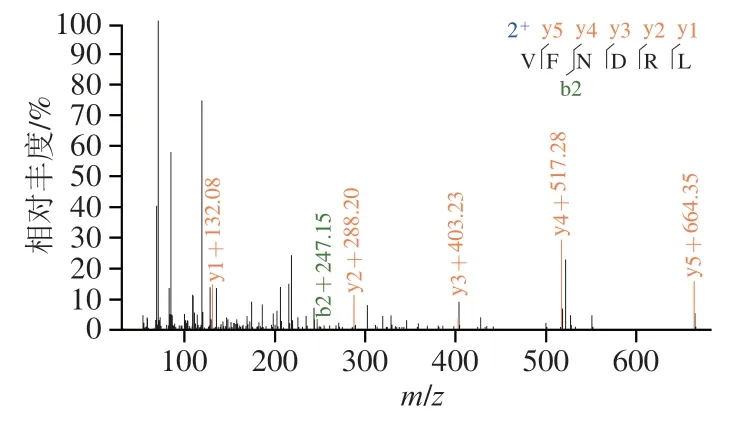
图1 活性肽Ⅱ的二级质谱图Fig. 1 Secondary mass spectrum of peptide Ⅱ
为分析多肽氨基酸序列结构与抗氧化性之间的构效关系,对活性肽I活性肽II的电子结构进行计算。首先根据活性肽I及活性肽II的氨基酸序列,构建活性肽的结构模型图,并使用Dmol3模块对构型优化,得到两个活性肽的能量最稳定结构,如图2A和2B所示。同时计算对照物VC的构型,其初始构型取自Materials Studio模型库,得到的优化结构如图2C所示。
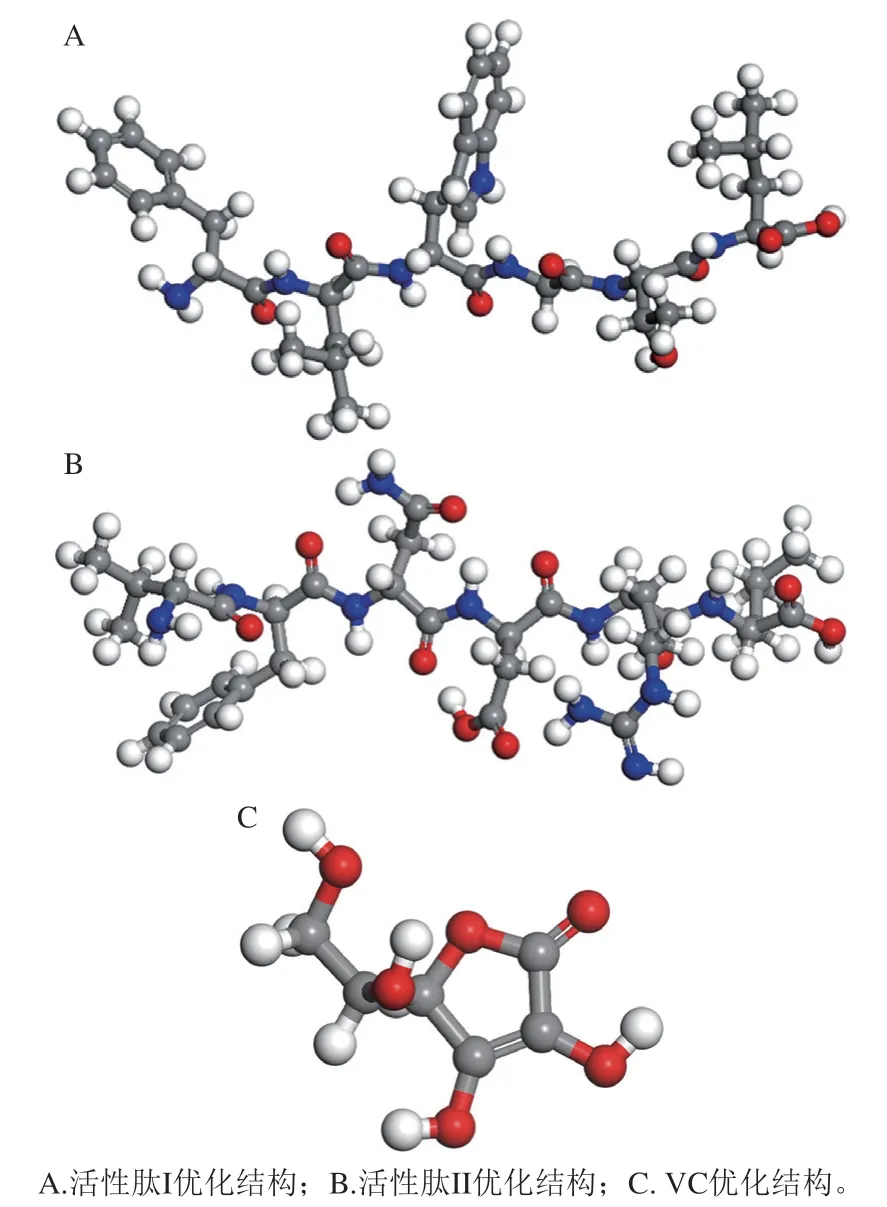
图2 两种活性肽及VC的优化结构示意图Fig. 2 Optimal geometric structures of peptides I and II and VC
2.2 两种活性肽在衰老小鼠血清及脑组织中抗氧化活性的比较
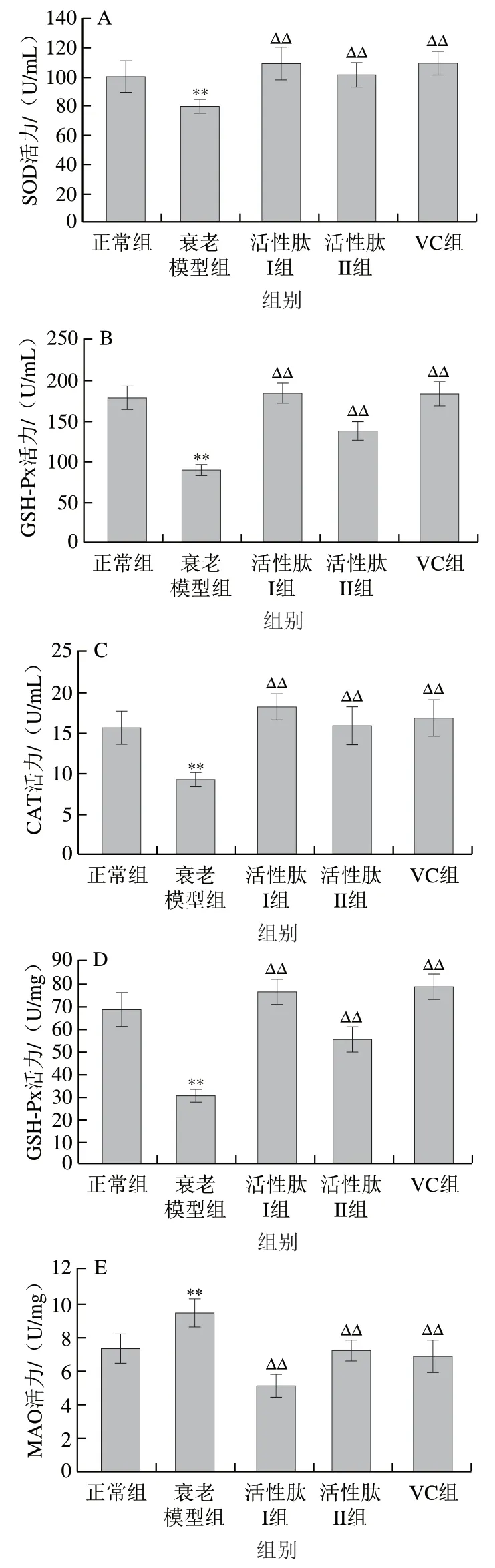
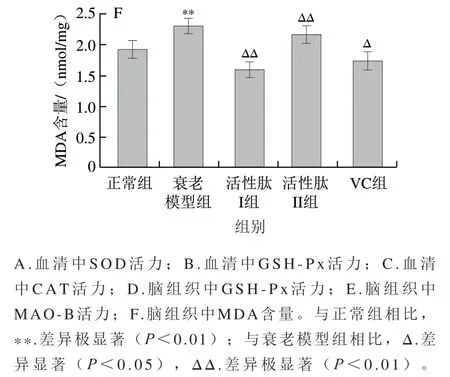
图3 两种活性肽在衰老小鼠血清及脑组织中抗氧化活性(,n=10)Fig. 3 Antioxidant activity of two bioactive peptides in serum and brain tissues of aging mice (, n = 10)
2.3 两种活性肽的结构特征及其抗氧化机理分析结果
采用Materials Studio 17.2软件中的Dmol3模块,利用GGA-PBE泛函,并通过Grimme的DFT-D经验修正方案分别计算活性肽I、活性肽II和VC分子的Fukui指数f0(r)、自由基反应活性位点、活性位点处电荷、键长、HOMO能级(EHOMO)和LUMO能级(ELUMO)等电子结构特征指标。
2.3.1 两种活性肽及VC的Fukui指数f0(r)、自由基反应活性位点
Fukui指数f0(r)可反映局部反应活性,f0(r)越大,表明是自由基反应活性位点的可能性越高[23],通过分析计算的结构,f0(r)最大的5个原子如表1所示,这些原子位点更容易发生自由基清除反应,这些反应位点在分子中的位置如图4所示(红色圆圈处)。
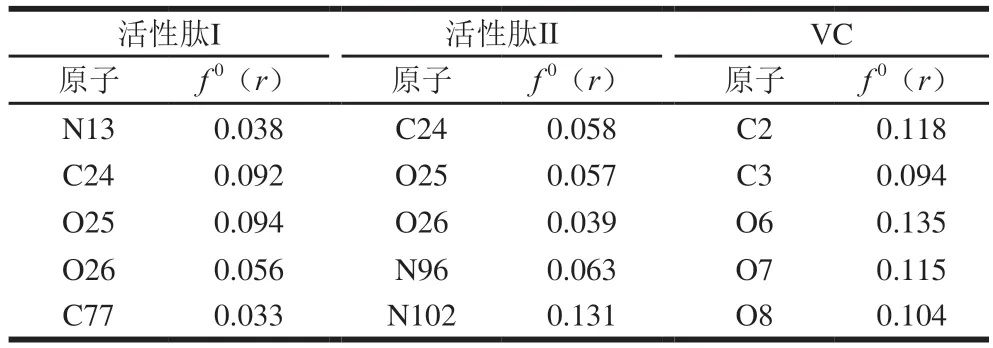
表1 两种活性肽及VC中高活性原子的Fukui指数Table 1 Fukui indices of the active atoms in two bioactive peptides and VC
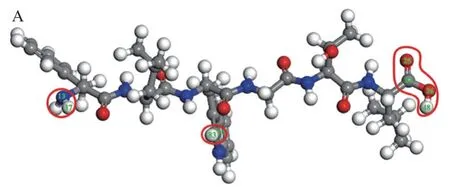
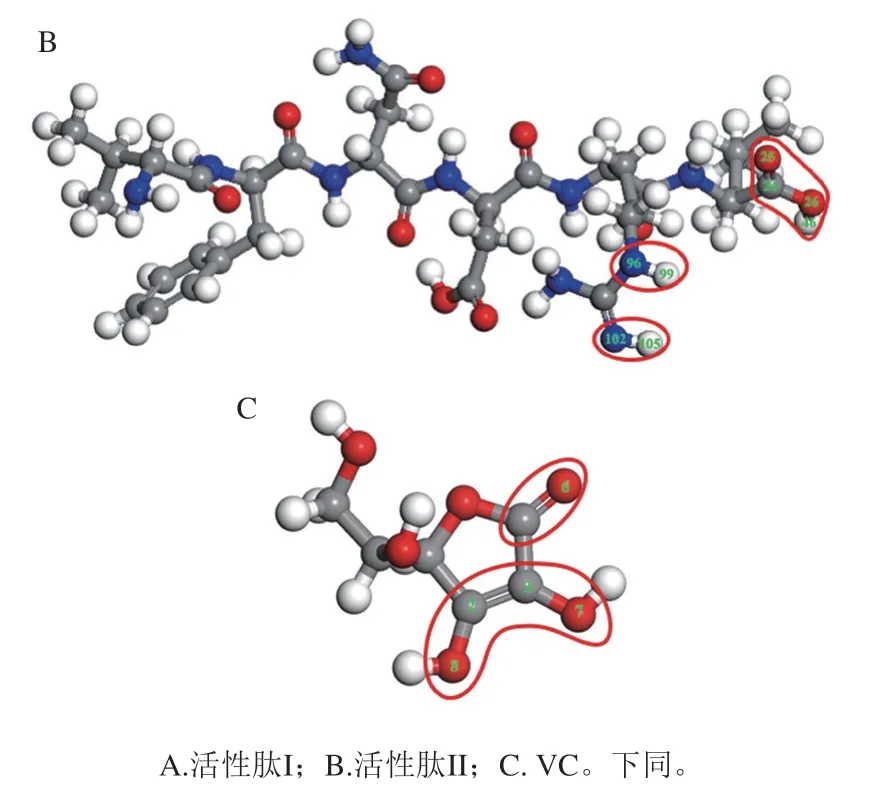
图4 两种活性肽及VC的Fukui指数f0(r)活性原子示意图Fig. 4 Schematic diagram of the active atoms with higher f0(r) of bioactive peptides I and II and VC
结合表1和图4可知,活性肽I的活性位点在亮氨酸的羧基、苯丙氨酸的胺基以及色氨酸吲哚环的双键上;活性肽II的活性位点在亮氨酸的羧基以及精氨酸胍基的两个胺基上。而VC的活性位点在五元环上的酯基以及另外两个羟基上。
2.3.2 两种多肽活性位点处电荷及键长
由表2可知,活性肽I中键长较长的分别是亮氨酸中的羧基、苯丙氨酸中的胺基、色氨酸吲哚环中的双键;活性肽II中键长较长的分别是亮氨酸中的羧基和精氨酸胍基上的两个胺基。化学键键长越长越容易断裂,说明上述位点是自由基清除反应的活性位点。
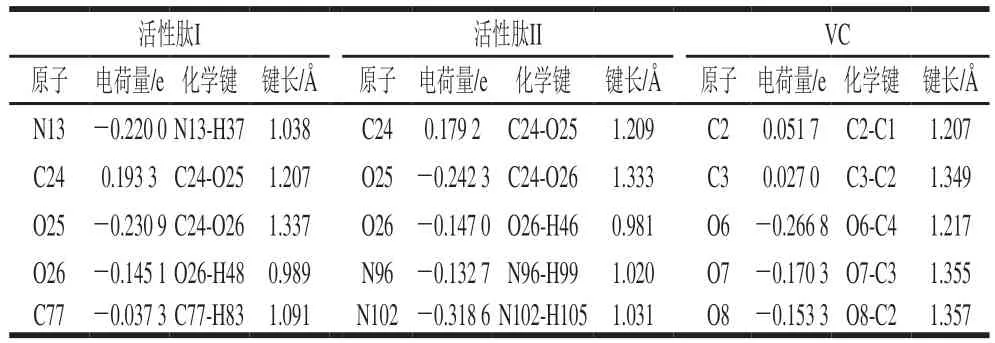
表2 两种活性肽及VC活性点位处电荷及键长Table 2 Atomic charges and bond lengths at the active sites of bioactive peptides I and II and VC
综合图4、表1及表2可推测得出:1)活性肽I、II中C端的亮氨酸残基可释放活泼氢与自由基发生反应,终止自由基破坏生物大分子,起到抗氧化的作用,而亮氨酸残基转化为羧基自由基,羧基自由基进一步脱除CO2。这个反应过程中,因为有CO2的生成,使得体系熵增大,并且亮氨酸的支链使空间位阻增大,均有利于反应进行。有研究显示,亮氨酸羧基可脱除CO2,并伴随着羧基上H的迁移[24-25],另外,一些研究证明支链氨基酸,尤其是亮氨酸,可有效减缓氧化应激,降低脂质过氧化水平,保持机体抗氧化系统的平衡[26],而且细胞中自由基的生成位点在线粒体中,如果抗氧化肽的N端含有疏水性氨基酸残基,则会增大其在脂质-水界面的溶解性,使其易于进入线粒体中,发挥自由基清除作用[27]。活性肽I中N端为苯丙氨酸残基,活性肽II中N端为缬氨酸残基,二者均属于疏水性氨基酸,故两种活性肽在脂质-水界面的溶解性都会增大,有利于清除自由基。2)活性肽I中苯丙氨酸的N—H键明显偏长,说明残基上的胺基容易释放活泼氢,其N原子上的p电子与相邻C—H上的σ电子产生超共轭现象,使结构稳定,释放出活泼氢与自由基发生反应,起到抗氧化作用。此外,色氨酸残基吲哚环上容易发生离域π键共轭,可以使电荷的流动性增强,从而提供活泼氢来清除自由基[12]。3)活性肽II中精氨酸残基N原子带电较多,是碱性氨基酸,其与金属离子可发生螯合反应,从而阻止Cu2+、Fe2+对生物大分子的氧化损伤[28-30];另外,精氨酸残基的胍基释放出活泼氢后,胍基上存在超共轭及共轭现象,使得结构稳定,起到清除自由基的作用。
2.3.3 HOMO和LUMO结构及其能级
前线轨道(HOMO和LUMO)是量子化学中一个重要参数[31]。EHOMO越大,表示越可能提供电子;ELUMO越小,表明越容易接受电子;二者轨道能级差ΔE=ELUMOEHOMO是非常重要的指标,ΔE越小,表明活性越强,越易发生反应[32-33]。由图5可知,活性肽I的HOMO主要位于色氨酸的吲哚环上,其LUMO主要位于亮氨酸的羧基,说明电子转移是从色氨酸的吲哚环转移到精氨酸的羧基,和前述的电子流动方向和活性位点相符,而活性肽II的电子转移主要发生在末端亮氨酸的羧基及相邻的精氨酸胍基上,转移路径较短,离域范围小;同样,对照物VC的电子转移也发生在其自身的五元环内,因此,活性肽II和VC的抗氧化能力明显比活性肽I弱。由表3可知,活性肽I的ΔE为3.400 eV,活性肽II的ΔE为4.069 eV,VC的ΔE为3.763 eV,活性肽I的EHOMO最大,且相应的ΔE最小,因此其自由基清除能力最强,抗氧化性最强,优于VC和活性肽II;活性肽II的ΔE最高,其抗氧化性比VC略逊一筹,这与二者在衰老小鼠实验中的结果相符。
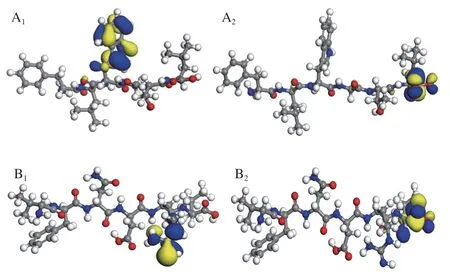
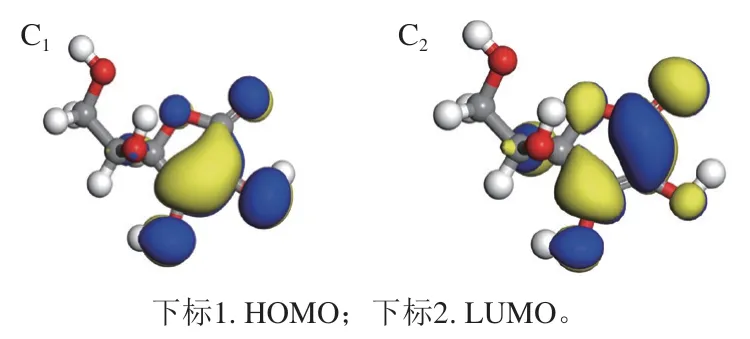
图5 两种活性肽及VC的HOMO与LUMO结构图Fig. 5 Highest occupied molecular orbital and lowest unoccupied molecular orbital of bioactive peptides I and II and VC

表3 两种活性肽及VC的前线分子轨道能及其能级差Table 3 Frontier orbital energies and energy differences of bioactive peptides I and II and VC
3 结 论
由衰老模型小鼠体内指标的测定结果可知,灌胃两种裸燕麦源活性肽后,各治疗组均显示出良好的抗氧化效果,其中活性肽I的治疗效果更好,表明活性肽I的抗氧化性更强。
通过量子化学理论计算,得到Fukui指数、键长、前线分子轨道能级及其能级差,结果表明,活性肽I的自由基反应活性位点在亮氨酸的羧基、苯丙氨酸的胺基以及色氨酸的吲哚环的双键上;活性肽II的自由基反应活性位点在亮氨酸的羧基以及精氨酸胍基的两个胺基上;活性肽I的电子离域范围大且ELUMO和EHOMO的能级差ΔE最小,因此其抗氧化活性最强,优于活性肽II和对照分子VC。

