绿鳍马面鲀幼鱼游泳运动及能量代谢的初步研究
党保成,陈四清,李雪梅,孙宇潇,李凤辉,葛建龙,孙以康,李美帅,常 青,边 力
(1 中国水产科学研究院黄海水产研究所,青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071;2 上海海洋大学水产与生命学院,上海 201306;3 浙江大学动物科学学院,浙江 杭州 316022)
水流是影响鱼类游泳的一个重要因子,它能够刺激鱼类的感觉器官产生趋流性;游泳是鱼类重要的生命活动之一,鱼的迁徙、猎食、繁殖及躲避敌害等都离不开游泳[1-2]。水流的变化会影响鱼类的游泳行为,让鱼产生顶流、趋流等行为[3-4],海洋中潮汐和波浪等引起的水流变化影响鱼的摄食、发育和生长。鱼类游泳过程中,通过鱼鳍的摆动来提供动力和平行,克服水的阻力逆流而上。趋流性是指鱼因水流刺激而引起的趋性,鱼会出现逆流和顺流两种状态,一般把逆流方向的概率称之为趋流率[5]。鱼类在运动中产生能量的代谢,依据鱼类对氧的需求可分为有氧运动和无氧运动两种类型,无氧运动的能量依靠无氧代谢提供,具有负荷强度高、很难长时间持续等特点,无氧代谢短时间会产生大量乳酸,导致肌肉疲劳不能持久,如鱼爆发式运动产生爆发游泳速度(Burst swimming speed,UB)和力竭性游泳(Exhaustive swimming)等运动方式等[6-7]。有氧运动的能量依靠有氧代谢提供,最大持续有氧运动速度被称为临界游泳速度(Critical swimming speed,UC),是最大有氧代谢能力评价的重要指标,也是最大持续游泳能力的生理指标之一[8],有氧运动强度低、持续性长,如鱼长时间在低流速下游泳。运动能量来源于体内代谢,当氧气供应不足时体内代谢会产生乳酸,肌乳酸的水平是评估无氧代谢能力的一个重要指标[9]。
绿鳍马面鲀(Thamnaconusseptentrionalis)主要分布于中国、日本、朝鲜半岛沿海,生活水深可达120 m,属外海暖温近底层洄游性鱼类,其肉质鲜美、营养价值高,市场需求量大,易于驯化养殖[10-11]。绿鳍马面鲀作为一个新的养殖种类,已经进行网箱养殖试验[12],海水网箱养殖中水域环境比较复杂,不同海域的流向、流速、水温变化都会影响鱼类的能量代谢,进而影响鱼类的生长[13-14],因此本研究自制游泳测定装置,观察绿鳍马面鲀幼鱼的趋流率、摆尾频率、背鳍频率和臀鳍频率来解其游泳行为,采用“流速递增法”测定临界游泳速度和爆发游泳速度来研究幼鱼的游泳能力[15],可补充绿鳍马面鲀的生物学特性,为绿鳍马面鲀养殖提供参考依据。
1 材料和方法
1.1 试验材料
试验基地为烟台开发区天源水产有限公司,样品来自公司2020年养殖的幼鱼。挑选健康的4个规格幼鱼各300尾,体质量分别为10.90±0.32 g、14.90±0.18 g、20.28±0.12 g、25.49±0.27 g,体长分别为8.30±0.10 cm、9.07±0.08 cm、9.97±0.40 cm、11.00±0.08 cm,各自暂养于直径1 m、高0.8 m的中心管排水的玻璃钢水槽中。试验用水为自然沙滤海水,暂养期间常流水、充气养殖。水温16±0.5 ℃,盐度32,pH 8.0±0.2,溶氧6 mg/L以上。暂养期间每天投喂2次配合饲料,以鱼接近饱食为准,投喂量约为鱼体质量的2%,暂养一周,试验前均禁食24 h。
1.2 游泳测定装置
如图1所示是一种鱼类行为学观察装置,其原理是通过水泵和溢流管保持水位高度、稳定水压,通过水阀和流量计调控游泳室水流速度,通过游泳室内部两端的卡槽固定筛板,筛板具有均匀水流和拦截试验鱼作用,通过游泳室上端的排气孔,排除游泳室内的气体,稳定游泳室水流。

图1 试验装置
1.3 试验方法
1.3.1 流速调节方法
通过变频水泵让箱内水位达到溢出高度,使水箱产生稳定的水位高度,利用流量、截面积、流速关系,通过调节流量计开关控制游泳室的流速。当试验鱼的最大横截面积小于10%的游泳室横截面积时,鱼体对水流流速的影响可以忽略,不需另外校正[16]。
v=Q/A
(1)
式中:Q为流量,cm3/s;A为横截面积,cm2;v为游泳室水流速度,cm/s。
1.3.2 临界游泳速度和爆发游泳速度测定方法
试验时将单尾试验鱼放入游泳管中适应1 h以上来消除转移的胁迫影响[16],适应期间水流速实测为0.9 cm/s,通过微流水维持溶氧含量。根据试验鱼特点,采用“递增流速法”在5 min之内将流速提高至24 cm/s,每隔20 min增加0.5 BL/s的流速(BL为鱼体体长,Body Length),待鱼因疲劳冲至筛板上,减小流速敲击装置,刺激鱼继续游泳,如鱼停留筛板超过20 s,则试验结束。爆发游泳速度按照临界游泳速度的测定方法,只需把流速递增的间隔20 min改为20 s,其他方法相同[17]。
1.3.3 临界游泳速度和爆发游泳速度的测定
从暂养水槽中挑选50尾规格为25 g幼鱼,分为5组,每组10尾。试验时自然海水水温16 ℃,通过加冰袋来降低水温和调节加热棒来升高水温,自然海水温度逐渐变化至试验设定温度的过程中,每次水温逐渐变化2 ℃,并让鱼适应1 h,逐渐达到试验设定水温。后暂养于温度为12 ℃、16 ℃、20 ℃、24 ℃和28 ℃水温的4个直径0.6 m、高0.8 m的玻璃钢水槽中,暂养周期为一周。试验前控制游泳测定装置为试验水温,按照上文方法来测定不同温度下的UC和UB,每次测试一条鱼,每组4个平行。
1.3.4 游泳行为和代谢的测定
设定1个静水组(0 m/s)及0.12 m/s、0.24 m/s、0.36 m/s、0.48 m/s共4个流速组,在16 ℃水温下,以25 g幼鱼进行游泳行为和能量代谢的试验。鱼鳍摆动频率的测定:在4个流速组下分别录像10 min,探究其尾鳍、背鳍和臀鳍的摆动频率随流速的变化情况。趋流率的测定:在5个试验组下,每组放10条鱼,探究趋流率随流速的变化情况。能量代谢的测定:4个流速下游分别游10 min、30 min和60 min,并作空白对照,试验时先让鱼适应1 h,每次试验装置测试一条鱼,每个试验组3个平行,试验结束后立即进行麻醉,称重并测量体长,真空管取血,在4 ℃静止2 h后低温离心(4 ℃,3 500 r/min,2 mL离心管离心10 min),然后取上清液置于-80 ℃保存待测,将取过血的鱼体立即放在冰块上,迅速取适量的尾部肌肉(尾肌)、臀鳍和侧线之间的肌肉(臀肌)和背鳍和侧线之间的肌肉(背肌)及肝脏用来测定乳酸和糖原含量,血清用于测量乳酸和血糖含量,指标测量均采用南京建成生物工程研究所生产的试剂盒。
1.4 数据的处理和计算
临界游泳速度和爆发游泳速度测定根据Brett(1964)的计算公式[15]:
UC=U+(t1/T1)ΔU
(2)
UB=U+(t2/T2)ΔU
(3)
式中:UC为临界游泳速度,m/s;UB为爆发游泳速度,m/s;U为能够完成设定时间的最大游泳速度,m/s;ΔU为速度增量,0.5 BL/s;T1为设定的持续游泳历时(T1=20 min),min;T2为设定的持续游泳历时(T2=20 s),s;t1为未能完成设定历时的实际持续游泳时长(t1<20 min),min;t2为未能完成设定历时的实际持续游泳时长(t2<20 s),s。
趋流率(Rheotaxis frequency)的计算公式:
R=∑ni/Nj·100%
(4)
式中:R为试验鱼逆流游泳次数占总观察次数的百分数,%;ni为第i(i=1、…、n)尾试验鱼在观察期间逆流游泳的次数;Nj为总的观察次数(每10 s观察记录一次,观察时间为10 min),测定微流水对照组试验鱼趋流率时,设定第一次观察到的试验鱼的游泳方向即为“逆流方向”。
背鳍频率(Dorsal fin frequency)、臀鳍频率(Anal fin frequency)和摆尾频率(Tail beat frequency)的计算公式[18]:
Df=DN/t
(5)
Af=AN/t
(6)
Tf=TN/t
(7)
式中:Df、Af、Tf为每尾鱼在被观察期间背鳍、臀鳍、尾部摆动频率,Hz;DN、AN、TN为每尾鱼被观察期间背鳍、臀鳍、尾部的摆动次数,Hz;t为观察时间,s。
1.5 数据处理
试验数据利用SPSS20.0软件进行分析,每组数据用“平均值±标准误”(Mean±SE)表示,在单因素方差分析的基础上,采用Duncan多重比较法检验组间差异(P<0.05)。
2 结果
2.1 绿鳍马面鲀幼鱼的爆发游泳速度和临界游泳速度
16 ℃的水温下,随着幼鱼体质量增加临界游泳速度(UC)和爆发游泳速度(UB)都呈升高趋势(表1),UB的10 g和15 g及15 g和20 g差异不明显(P>0.05),其他组之间差异显著(P<0.05)。UC的各规格之间差异性显著(P<0.05)。
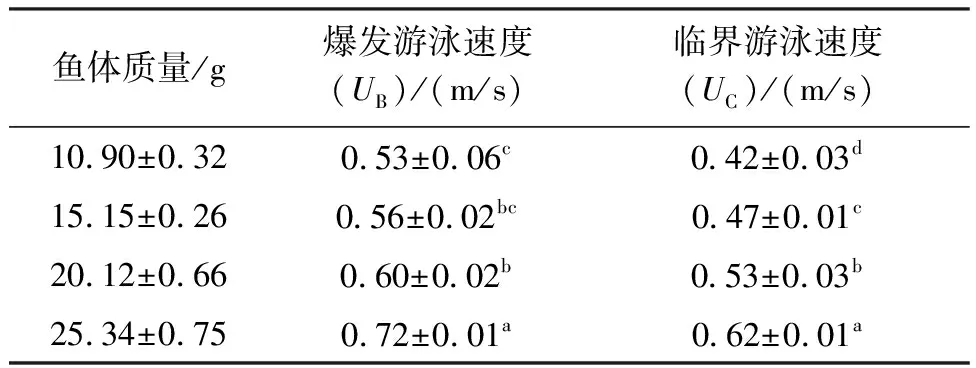
表1 不同体质量下幼鱼在16 ℃温度下的爆发游泳速度和临界游泳速度测定结果
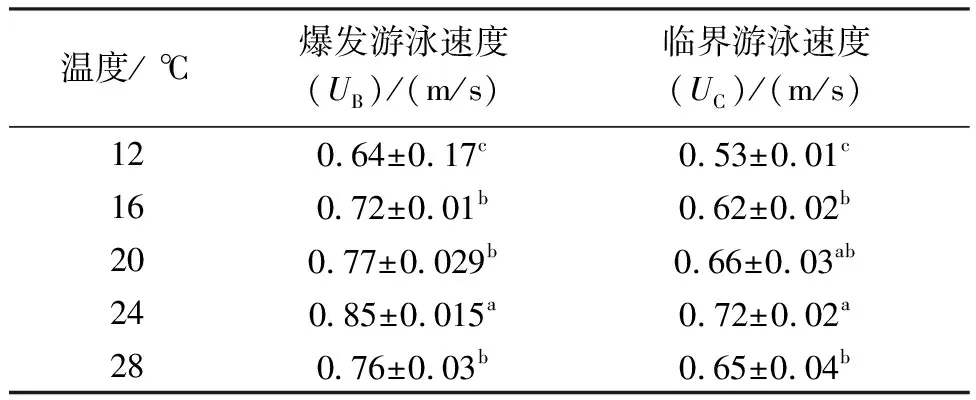
表2 25 g规格幼鱼在不同温度下的临界游泳速和爆发游泳速度测定结果
UB随温度的升高呈先上升后下降趋势,在24 ℃时流速达到最大值且与其他组差异显著(P<0.05),12 ℃组与其他组差异显著,16 ℃、20 ℃、28 ℃组之间差异不显著(P>0.05)。UC随温度的升高呈先上升后下降趋势,24 ℃、16 ℃和12 ℃组之间差异显著(P<0.05),20 ℃组与24 ℃和16 ℃组差异不显著(P>0.05),20 ℃、24 ℃和28 ℃之间差异不显著(P>0.05),温度低于12 ℃时或高于28 ℃时,鱼的游泳能力降,鱼出现不游和反应迟缓等现象。
2.2 绿鳍马面鲀幼鱼在不同流速下的游泳行为
随着流速的增加幼鱼摆尾频率不断加快(表3),从静水组的1.21 Hz增加到0.48 m/s组的6.86 Hz,各组之间差异显著(P<0.05),背鳍摆动频率随着水流速的增加而加快,0.12 m/s和0.24 m/s组差异不显著(P>0.05),0.36 m/s和0.48 m/s组差异也不显著(P>0.05),其他组之间差异显著(P<0.05)。臀鳍的摆动频率也随流速的增加而加快,0.24 m/s和0.36 m/s及0.36 m/s和0.48 m/s之间差异不显著(P>0.05),静水组、0.12 m/s组之间差异显著(P<0.05)。在微流水中,幼鱼游泳的方向随机,随着流速增加,趋流方向逐渐转为逆流,趋流率由对照组的(51.67±0.56)%增加到0.12 m/s组的(93.89±0.57)%,0.24 m/s组后趋流率接近100%,0.48 m/s组达到100%,0.24 m/s、0.36 m/s和0.48 m/s组差异不显著(P>0.05)。

表3 不同流速下幼鱼的摆尾频率、趋流率、背鳍频率和臀鳍频率测定结果
2.3 绿鳍马面鲀幼鱼随流速、时长的代谢变化
肌乳酸含量从0.36 m/s(10 min)的组开始变化且与对照差异显著(P<0.05)(图2),随着流速、时间增加3个部位肌肉乳酸呈增加趋势,0.48 m/s(60 min)组3个部位的肌肉乳酸含量达到最大值。
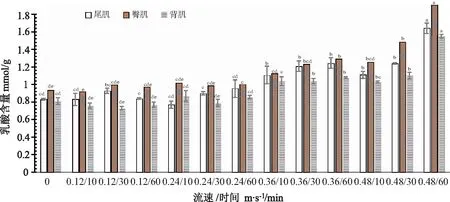
注:不同字母表示同一部位组织在不同试验组间存在显著差异(P<0.05),下同
背肌、臀肌和尾肌糖原随着流速和时间增加,糖原含量呈下降趋势(图3),0.36 m/s(60 min)和0.48 m/s(60 min)组肌肉糖原含量较低。肝脏乳酸含量从0.36 m/s组开始明显升高,0.48 m/s(60 min)组乳酸含量最高(表4)。肝糖原从0.36 m/s(30 min)呈下降趋势,在0.48 m/s(60 min)组糖原含量最低。
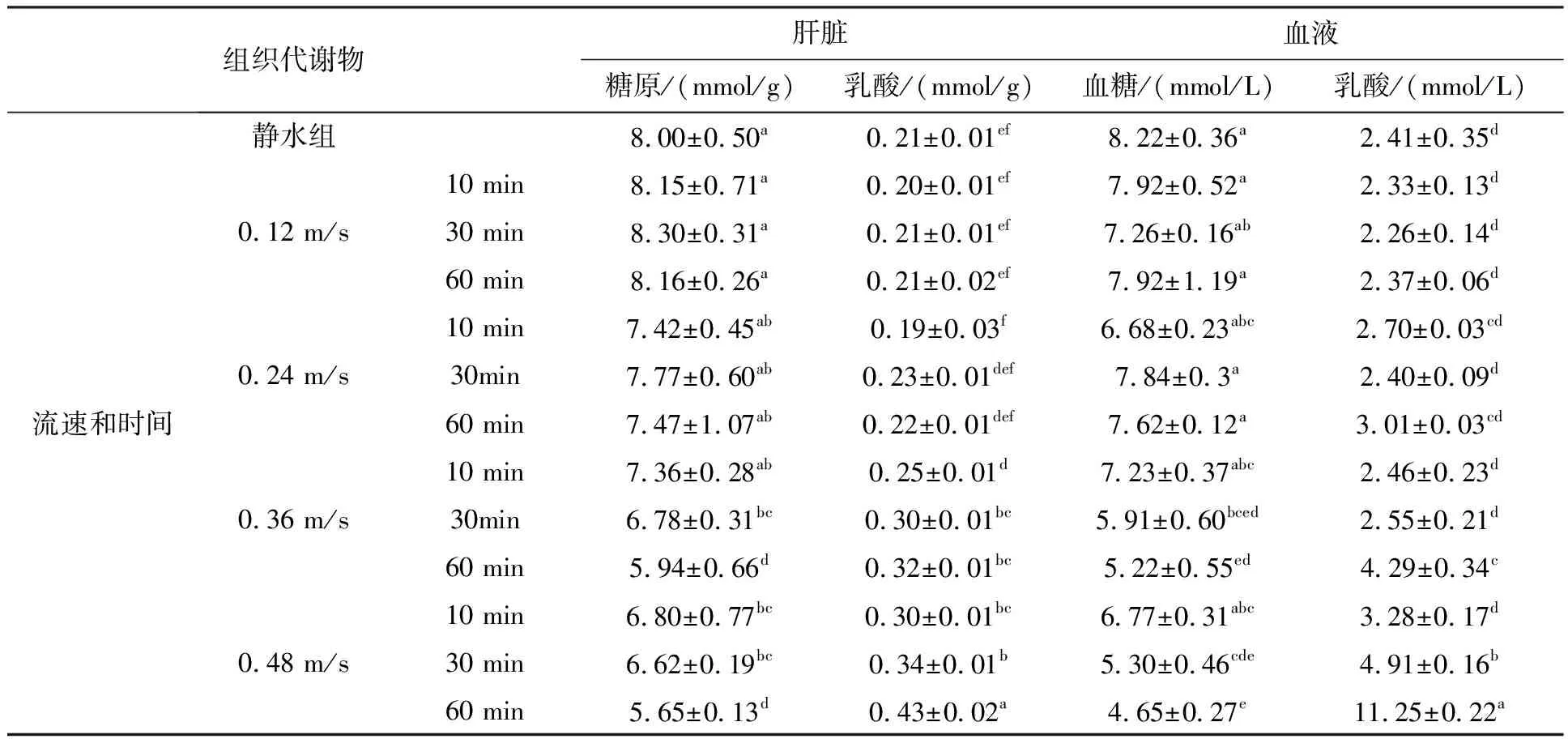
表4 不同流速和时间下绿鳍马面鲀幼鱼组织的代谢物变化(平均值±标准误,n=3)
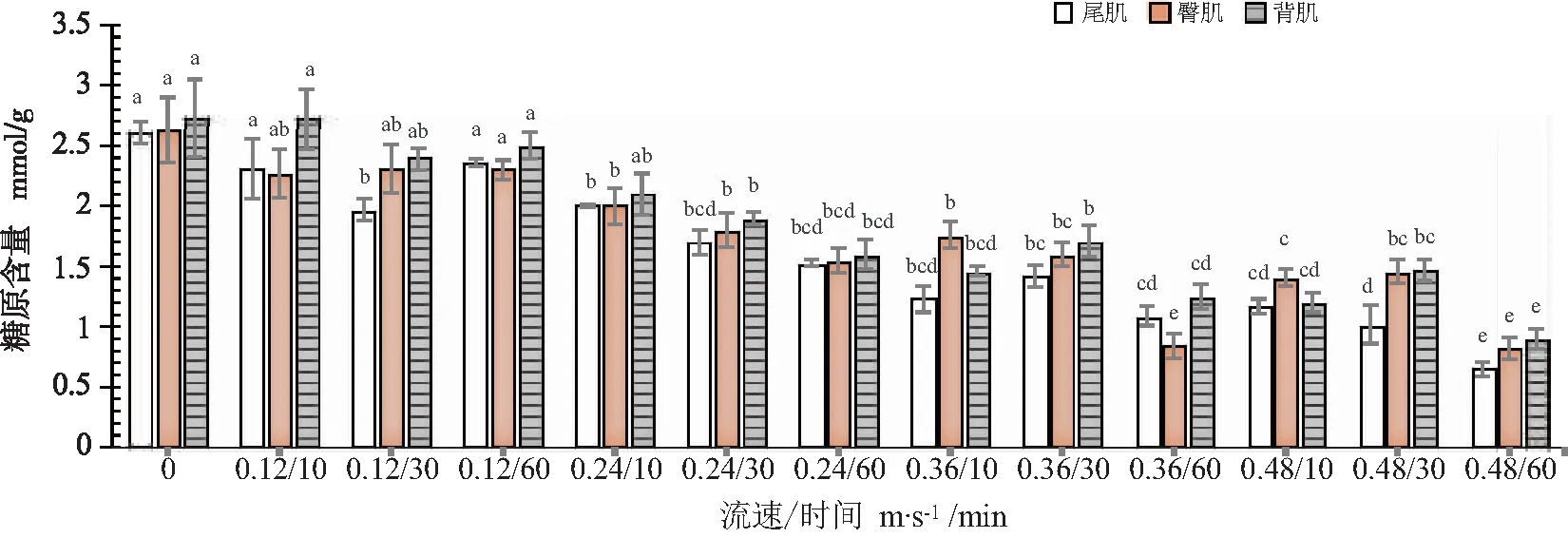
图3 不同流速下和时间下肌肉糖原含量的变化
血液乳酸含量0.36 m/s组呈上升趋势,从0.36 m/s(60 min)组开始,乳酸的含量与对照组差异显著(P<0.05),其中0.48 m/s(60 min)组的乳酸含量最高,血糖的含量从0.36 m/s(60 min)及0.48 m/s的30 min和60 min有明显的下降趋势,且在0.48 m/s(60 min)组最低。
3 讨论
3.1 体质量、温度对幼鱼游泳能力的影响
游泳能力对鱼类的生存起着至关重要,鱼类因捕食、躲避敌害等情况出现爆发式的运动现象[18-19],爆发游泳速度(UB)是评价鱼游泳能力的重要指标[20]。绿鳍马面鲀幼鱼随着体质量增加UB呈上升趋势,这与史航等[21]测定大泷六线鱼(Hexagrammosotakii)的变化的趋势一致,绿鳍马面鲀幼鱼在10~25 g范围内,瞬间最大顶流能力由0.53 m/s提升至0.72 m/s,随着体质量增加UC也不断升高,这与史航等[21]和李会锋等[22]UC的变化趋势相似,幼鱼的UC由0.42 m/s增至0.62 m/s左右且4个规格差异显著(P<0.05),说明相差5 g幼鱼的游泳能力提升显著,随着体质量的增加,绿鳍马面鲀幼鱼的顶流能力不断提高,UB和UC的快速提高为绿鳍马面鲀幼鱼捕食、逃避敌害、繁殖等提供支持,作为洄游性鱼类[23],绿鳍马面鲀幼鱼能够在生长中快速提高游泳能力来适应迁徙活动。史航等[21]研究得出14 ℃时10 cm的许氏平鲉(Sebastesschlegelii)UC和UB约为0.45 m/s和0.77 m/s,10 cm的大泷六线鱼UC和UB约为0.42 m/s和0.82 m/s,16 ℃时绿鳍马面鲀幼鱼UC和UB约为0.62 m/s和0.72 m/s,可以看出绿鳍马面鲀幼鱼UC高于许氏平鲉和大泷六线鱼,而爆发游泳速度低于两者,主要原因是本试验UB研究方法是鱼从初始流速一直到极限流速整个时段内累积的游泳能力,而史航等[21]研究的是鱼受到刺激的瞬间游泳速度,因此顶流节省体力。资料显示,43.9 g的大黄鱼(Larimichthyscrocea)的UC约为0.32 m/s[24],远低于绿鳍马面鲀幼鱼,本试验递增周期为20 min,而测量大黄鱼的递增周期为30 min,通常时间间隔越短试验鱼在某一流速下的持续顶流时间就越短,为下一流速水平顶流节省体力越多,将有利于提高临界速度[25],相对于这些鱼类,绿鳍马面鲀头、体较侧扁,呈长椭圆形,水的阻力较小,总的来说绿鳍马面鲀幼鱼的游泳能力较强。
温度是影响鱼类游泳能力的重要因素,鱼类作为变温性动物,水温的变化直接影响鱼体温。温度的变化影响鱼体的酶活性和氧气的运输及传递,进而鱼类的生理功能受到影响,同时也影响鱼类的肌肉收缩率和游泳能力[26-27]。温度对鱼类游泳能力的影响可以用来推测其适宜生长温度,并在鱼最适合的温度时UB和UC达到最大值[25],本研究得出绿鳍马面鲀幼鱼的UB和UC在12~28 ℃呈先上升后下降趋势,顶流的速度随温度的变化趋势与徐革锋等的结果相似[29],在24 ℃达到最大值,这符合24 ℃是绿鳍马面鲀幼鱼的最适生长温度[30],如黑鲈(Micropterussalmoides)在适宜的温度24.4 ℃时达到最大UC[31],适宜温度下游泳能力显著提升为鱼类在海洋中快速生长提供保障。研究过程中发现在低于12 ℃和高于28 ℃时,绿鳍马面鲀幼鱼游泳能力急剧下降,出现不游、侧身、贴壁等现象,说明温度过高或过低降低绿鳍马面鲀幼鱼的游泳运动。
3.2 流速对绿鳍马面鲀幼鱼行为的影响
水流作为非生物因子能够刺激鱼类的感觉器官,引起鱼的趋流行为,鱼类会根据水流的大小和方向调节自身的游泳速度和方向[32-33],试验过程中为了满足静水组试验用鱼对溶氧需求,静水组水流保持微水流状态,实际为流速为0.009 m/s,微流状态的趋流率接近50%,说明微流水条件下近似静水下幼鱼的游泳状态,趋流率由静水组的52%增加至流速组的100%,幼鱼由静水到流速组,幼鱼逆流率增加的趋势与李丹的杂交鲟鱼(HusoduricusGeorgi♂×AcipenserschrenckiBrandt♀)[33]和钟金鑫等的鱇白鱼(Anabariliusgrahami)结果相似,当流速0.12 m/s时绿鳍马面鲀幼鱼趋流率达到94%,远远高于静水组的52%,这说明流速较低时对幼鱼的刺激程度不够、敏感度不高,一定的流速是保持较高趋流率的必要条件,在工厂化养殖过程中,绿鳍马面鲀幼鱼喜集群围绕养殖池逆流游泳。
鱼鳍是鱼类游泳的重要器官,在游泳过程中为鱼类提供动力和平衡,其中尾鳍为鱼类游动提供主要的动力[35],摆尾频率作为衡量运动强度的指标之一,随着流速增加呈正相关,各流速组之间差异显著(P<0.05),说明随着流速的增大逆流游泳所需的动力也相应增加,幼鱼通过加大摆尾的频率保持逆流状态,这与钟金鑫等[34]的鱇白鱼(Anabariliusgrahami)和袁喜等[35]的细鳞裂腹鱼(Schizothoraxchongi)结果相似,从静水组到0.12 m/s组尾鳍、背鳍和臀鳍的摆动频率增加的百分比分别为:240.18%、76.74%、58.15%,从0.12 m/s到0.48 m/s组的摆动频率增加的百分比分别为:80.05%、24.97%和38.65%,尾鳍频率增加的百分比大于背鳍和臀鳍,但结果发现随着流速的增加,鱼尾部的摆动转变为尾部和躯干部的共同摆动,观察还发现尾部的摆动幅度比背鳍和臀鳍大得多,闫东娟等[36]和杨晗等[37]通过切除尾鳍发现会导致鲫(Carassiusauratus)和宽鳍鱲(Zaccoplatypus)的迅速启动能力,这说明幼鱼主要通过尾鳍摆动提供主要动力,来保障在一定流速下趋流率接近100%。有研究表明鱼类的背鳍和臀鳍起平衡作用[38],背鳍的缺失对胭脂鱼(Myxocyprinusasiaticus)幼鱼游泳能力没有显著的影响[39],以上研究说明背鳍和臀鳍在幼鱼游泳过程中起辅助作用。
3.3 流速、时间对幼鱼代谢的影响
水流能够刺激鱼类的感觉器官,使其产生逆流和持续的游泳运动[36],鱼在长时间处于剧烈的运动状态下会增加糖原、血糖的消耗和乳酸的产生[40],乳酸作为评估无氧代谢能力的一个重要指标,可以依照乳酸的显著增加来判断鱼类的无氧代谢情况[41]。本研究表明尾肌、臀肌和背肌的糖原含量分别从2.61 mmol/g、2.30 mmol/g和2.73 mmol/g降低至0.65 mmol/g、0.82 mmol/g和0.90 mmol/g(图2),在鱼类运动过程中,依靠鱼鳍肌肉的收缩摆动来提供动力,说明运动过程中肌糖原被消耗来为幼鱼肌肉的摆动提供能量,0.12 m/s组糖原含量下降不明显,说明低流速下消耗糖原较少,低流速下糖原含量下降不明显与朱晏苹等[9]研究的瓦氏黄颡(Pelteobagrusvachelli)幼鱼的结果相似。0.24 m/s组开始幼鱼肌糖原下降量开始显著(P<0.05),说明加剧消耗肌糖原为游泳提供能量,时间长、流速大都会加剧肌糖原的分解,并在0.48 m/s(60 min)组时三个部位肌糖原含量最小。0.12 m/s(10 min)组~0.24 m/s(60 min)组肌肉的乳酸含量变化与静水组相差不显著(P>0.05),鱼类适宜的游泳状态下肌糖原分解产物是H2O和CO2并为肌肉运动供能。0.36 m/s(10 min)组开始乳酸的含量开始增加,在最高组0.48 m/s(60 min)乳酸含量达到最大值(图3),此时尾肌、臀肌和背肌的乳酸含量分别约为1.64 mmol/g、1.70 mmol/g和1.55 mmol/g,鱼类在剧烈运动后肌糖因分解供能而含量迅速下降,但由于氧气供给不足导致乳酸浓度迅速上升,此时肌糖原不能直接分解成葡萄糖,必须先分解生成乳酸[43],说明在此流速开始无氧代谢增强,0.36 m/s(10 min)组开始随着流速增加幼鱼因受水流胁,体内进行能量消耗时因氧气供应不足导致无氧呼吸增强从而产生乳酸。三个部位的肌肉是相互联系存在物质和能量的交换,因此三个部位的糖原和乳酸含量无法比较,但可以看出,运动过程中不仅是鱼类尾部肌肉,其他部位肌肉也参与进行物质分解及能量的代谢。
鱼类运动过程中肝糖原分解葡萄糖,后释放入血液中,主要作用是不断补充血糖的消耗,以维持血糖的正常水平,保证生命活动及运动能力[44],本研究肝糖原从0.24 m/s(10 min)组开始下降(表4),在0.36 m/s(30 min)时糖原的含量与对照组差异显著(P<0.05),同流速,时间越长,糖原含量越低,肝糖原从对照组的8.00 mmol/g降低至5.65 mmol/g。鱼类运动剧烈的状态下肝糖分解中因缺氧造成乳酸的积累,在0.12 m/s和0.24 m/s低流速下由于运动过程中幼鱼呼吸代谢的氧气充足组输送到肝脏,因此肝脏的代谢为有氧代谢。乳酸含量从0.36 m/s流速组开始变化且都与静水组差异显著(P<0.05),说明无氧代谢产物与对照组差异显著。乳酸从静水组至0.48 m/s(60 min)组上升了0.22 mmol/g,低于肌肉乳酸的0.9 mmol/g。
血糖在为鱼类运动供能起着重要的作用,研究发现0.24 m/s和0.12 m/s组血糖含量与对照组相差不显著(P>0.05)(表4),从0.36 m/s的30 min开始与对照组相差显著(P<0.05),说明在较高流速和长时间下幼鱼运动消耗血糖加快肝糖原和血糖同步减少,这是因为试验鱼运动过程中,肝糖原不断分解减少,为血液提供葡萄糖,Richards等[43]和李黎等[42]也有其相同规律,血糖从对照组的8.22 mmol/L下降至0.48 m/s(60 min)组的4.65 mmol/L,说明长时间且高速下会加大血液能量的消耗。血乳酸从对照组的2.41 mmol/L升至11.25 mmol/L,运动过后血液乳酸的含量变化明显,0.12 m/s和0.24 m/s流速组与对照组无差异(P<0.05),说明此流速下幼鱼主要为有氧运动。0.36 m/s(30 min)组与对照组相差无异,而60 min时差异显著,乳酸的含量上升显著,说明同流速时间越长试验鱼容易出现力竭状态,同样对于0.48 m/s组也是,随着时间增加血液中积累的乳酸越多,说明幼鱼由于长期处于高于0.36 m/s的流速下血液中会积累乳酸。
在16 ℃下25 g幼鱼的UC为0.62 m/s,0.36 m/s和0.48 m/s流速分别接近UC的60%和80%,临界游泳速度是鱼类最大的有氧运动速度,从结果来看在接近临界游泳速度时存在无氧代谢,这也符合鱼类在到达UC之前存在一定比例的无氧代谢[45]。
4 结论
本研究通过测定绿鳍马面鲀幼鱼在不同体质量和温度下的临界游泳速度及爆发游泳速度,并记录观察幼鱼的鱼鳍摆动频率和趋流性,来分析绿鳍马面鲀的游泳行为,结果表明,幼鱼具有较强的游泳能力,在工厂化养殖和网箱养殖中,要控制好养殖水环境的流速条件,瞬间水流不要超过其爆发游泳速度,也不能长期处于其临界游泳速度的水环境。从代谢方面来看,幼鱼长时间处于0.36 m/s和0.48 m/s流速下时,体内会出现无氧代谢过程并加剧糖原和血糖的消耗,因此在养殖水流速不要长期高于0.36 m/s。
□

