PELGE-克班宁纳米粒在大鼠体内的组织分布及药动学研究Δ
崔利利,孔淑君,王辉黄秋艳汪红梅马云淑(.云南中医药大学中药学院,昆明 6000;2.南京中医药大学药学院,南京 2002;.迪沙药业集团有限公司,山东 威海 264200;4.云南省高校外用给药系统与制剂技术重点实验室,昆明 6000;.云南省傣医药与彝医药重点实验室,昆明 6000)
克班宁[crebanine(Cre),化学结构式见图1]是从防己科千金藤属云南地不容Stephania yunnanensisH. S.Lo中提取的生物碱[1],具有抗炎、抗心律失常、抗肿瘤作用,临床价值较高[2-9]。但有研究表明,Cre的半数致死量(median lethal dose,LD50)为9.382 mg/kg,毒性较大,使得其研发和应用受到了限制[6]。聚乙二醇-(聚乳酸-羟基乙酸)-聚乙二醇三嵌段共聚物[polyethylene glycolpoly lactide(acid-hydroxyacetic acid)-poly ethylene glycol triblock copolymer),PELGE]的生物相容性较好,可延长药物在血液中的循环时间,并缩短其代谢时间[10-11],故本课题组前期制备了以PELGE为载体的Cre纳米粒(PELGE-Cre-NPs)。相关药动学研究结果显示,与Cre注射液相比,PELGE-Cre-NPs在家兔体内的滞留时间显著延长[12]。有研究指出,药物在不同生物体内存在质或量的种属差异[13]。基于此,本研究拟进一步探讨PELGE-Cre-NPs在大鼠体内的组织分布情况及组织药动学特征,以期为该制剂后续的药效学研究提供理论基础支撑。

图1 Cre的化学结构式
1 材料
1.1 主要仪器
本研究所用主要仪器包括1260 Infinity型高效液相色谱(HPLC)仪(美国Agilent公司)、HSC-12A型氮吹仪(天津市恒奥科技发展有限公司)、XHF-1型内切式匀浆机(宁波新芝生物科技股份有限公司)、TGL-16G型台式离心机(上海安亭科学仪器厂)、XK96-A型快速混匀器(姜堰市新康医疗器械有限公司)等。
1.2 主要药品与试剂
PELGE-Cre-NPs(批号 2016011003,Cre含量 1.5 mg/mL,包封率90.32%)、Cre对照品(批号20141101,纯度99.2%)均由云南中医药大学药剂实验室自制(制备方法参考文献[14]);盐酸维拉帕米对照品(内标,批号100223-200102,供含量测定用)购自中国食品药品检定研究院;氯化钠注射液(批号2106304B,规格500 mL∶4.5 g)购自安徽双鹤药业有限责任公司,作生理盐水用;75%乙醇(批号121002)购自昆明远方生物制品有限公司;甲醇为色谱纯,乙酸乙酯等其余试剂均为分析纯,水为纯化水。
1.3 实验动物
SPF级SD大鼠54只,雌雄各半,体质量180~220 g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)2019-0004。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 精密称取Cre对照品适量,用甲醇溶解制成质量浓度为1 000 μg/mL的储备液,再用甲醇进一步稀释制成质量浓度为 520、260、130、65、32.5、16.25、8.125 μg/mL的系列标准溶液,于4 ℃条件下保存,备用。
2.1.2 内标溶液 精密称取内标2 mg,置于10 mL容量瓶中,用甲醇溶解并稀释至刻度,制成质量浓度为200 μg/mL的内标溶液,于4 ℃条件下保存,备用。
2.2 生物样品处理方法
取大鼠的心、肝、脾、肺、肾、脑组织样品各适量,精密称定,分别加生理盐水少许,用组织匀浆机以5 000 r/min匀浆,再加生理盐水,制成每3 mL含1 g组织的样品。精密吸取上述组织样品0.5 mL,置于离心管中,精密加入“2.1.2”项下内标溶液20 μL、甲醇20 μL、乙酸乙酯3 mL,涡旋萃取3 min,再以4 000 r/min离心10 min,吸取上层有机相2.4 mL,置于5 mL离心管中,于50 ℃水浴中以氮气流吹干,残渣加甲醇200 μL,涡旋1.5 min复溶,经0.22 μm滤膜滤过,取续滤液20 μL进行HPLC分析。
2.3 样品分析方法的建立与验证
2.3.1 色谱条件 以Agilent ZORBAX Extend-C18(4.6 mm×250 mm,5 μm)为色谱柱,甲醇-0.01%三乙胺溶液(75∶25,V/V)为流动相;流速为1 mL/min;检测波长为280 nm;柱温为30 ℃;进样量为20 μL。
2.3.2 方法学考察 (1)专属性考察:分别取未给药大鼠的心、肝、脾、肺、肾、脑组织适量,除不加Cre对照品和内标溶液外,其余按“2.2”项下方法处理后,制成空白组织匀浆液,按“2.3.1”项下色谱条件进样分析,得大鼠空白组织样品色谱图(图略);将一定量的Cre对照品溶液(5 μg/mL)加入空白组织匀浆液中,按“2.2”项下方法处理后,再按“2.3.1”项下色谱条件进样分析,得含对照品和内标空白组织样品的色谱图(图2A);尾静脉给药后5 min处死大鼠,取各组织并制备得含药的心、肝、脾、肺、肾、脑组织匀浆液样品,按“2.2”项下方法处理后,再按“2.3.1”项下色谱条件进样分析,得含药组织样品的色谱图(图2B)。由图2可知,大鼠各组织中的内源性物质对Cre和内标的测定无干扰。
图2 Cre专属性考察的HPLC图
(2)标准曲线绘制与定量下限考察:精密量取大鼠空白心、肝、脾、肺、肾、脑组织匀浆液0.5 mL,置于10 mL离心管中,分别加入“2.1.1”项下Cre系列标准溶液适量,制成 Cre质量浓度分别为 0.312 5、0.625、1.25、2.5、5 μg/mL的系列心组织样品,质量浓度分别为0.312 5、0.625、1.25、2.5、5、10、20 μg/mL的系列肺组织样品和质量浓度均分别为0.312 5、0.625、1.25、2.5、5、10 μg/mL的系列肝、脾、肾、脑组织样品。取上述系列组织样品,按“2.2”项下方法处理后,再按“2.3.1”项下色谱条件进样分析,记录峰面积。以Cre质量浓度为横坐标(c)、Cre与内标的峰面积比值为纵坐标(A)进行线性回归,结果见表1。由表1可见,各组织样品中,Cre在各自检测质量浓度范围内与峰面积比值的线性关系均良好(R2>0.999),定量下限质量浓度均为0.312 5 μg/mL。

表1 大鼠各组织样品中Cre的回归方程和线性范围
(3)精密度与准确度试验:分别于同日内6个不同时间点和3 d内按“2.3.2(2)”项下方法配制Cre低、中、高质量浓度和定量下限质量浓度的心、肝、脾、肺、肾、脑组织样品,按“2.2”项下方法处理后,再按“2.3.1”项下色谱条件进样分析,以RSD考察日内、日间精密度,以实测质量浓度与理论质量浓度的比值考察准确度,结果见表2。由表2可知,Cre各组织样品的日内、日间RSD均小于10%,准确度为81.85%~118.83%。
(4)稳定性试验:分别按“2.3.2(2)”项下方法配制Cre低、中、高质量浓度的各组织样品,按“2.2”项下方法处理后,分别于室温放置24 h、-20 ℃放置24 h、反复冻融(-20 ℃~室温)3次后,按“2.3.1”项下色谱条件进样分析,记录峰面积。结果显示,各样品中Cre峰面积的RSD均小于10%,符合生物样品方法学考察的相关要求[15]。
2.4 PELGE-Cre-NPs在大鼠各组织样品中的分布情况
将大鼠分为9组(每个时间点为1组),每组6只,雌雄各半。大鼠禁食、不禁水24 h后,以5 mg/kg的剂量(以Cre质量计,剂量设置参考文献[16])尾静脉注射PELGE-Cre-NPs,随后分别于5、15、30、60、90、120、180、240、300 min时解剖大鼠,取心、肝、脾、肺、肾、大脑组织样品,用生理盐水清洗表面,以滤纸吸干后,按“2.2”项下方法处理后,再按“2.3.1”项下色谱条件进样分析,记录峰面积,以内标法计算各组织样品中Cre的含量。大鼠尾静脉注射PELGE-Cre-NPs后各时间点心、肝、脾、肺、肾、脑组织样品中Cre含量的变化情况见图3。由图3可知,给药后5、15、30、60、90 min,Cre在大鼠各组织样品中的含量由高到低依次为肺、肾、脾、肝、脑、心;给药后120、180、240、300 min,Cre在大鼠各组织样品中的含量由高到低则变为肺、脾、肾、肝、脑、心。与本课题组前期研究[17]的Cre注射剂相比,PELGE-Cre-NPs在大鼠各组织中的分布明显增加,代谢时间有所延长,初步达到了长循环的目的。
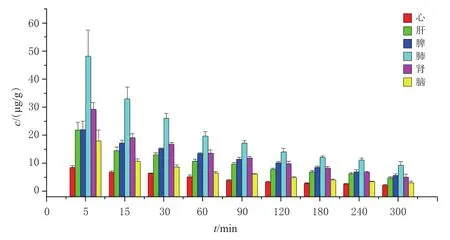
图3 尾静脉注射PELGE-Cre-NPs后不同时间点大鼠各组织样品中Cre含量的变化情况
2.5 PELGE-Cre-NPs在大鼠各组织样品中的药动学特征
使用DAS药动学软件对大鼠各组织样品中Cre的浓度数据进行非房室模型拟合,大鼠6个组织的平均药-时曲线见图4,主要药动学参数见表3。以药-时曲线下面积(AUC0-t)为Cre组织分布的评价指标[18],结果显示,Cre在大鼠各组织样品中的分布由高到低依次为肺、肾、脾、肝、脑、心;以平均滞留时间(MRT0-t)为Cre滞留的评价指标,结果显示,Cre在大鼠各组织样品中滞留时间由长到短依次为脾、肝、心、肺、肾、脑;此外,Cre在心、肝、脾、肺、肾、脑组织中的末端消除半衰期(t1/2z)分别为4.83、5.93、3.75、4.99、3.89、3.95 h。
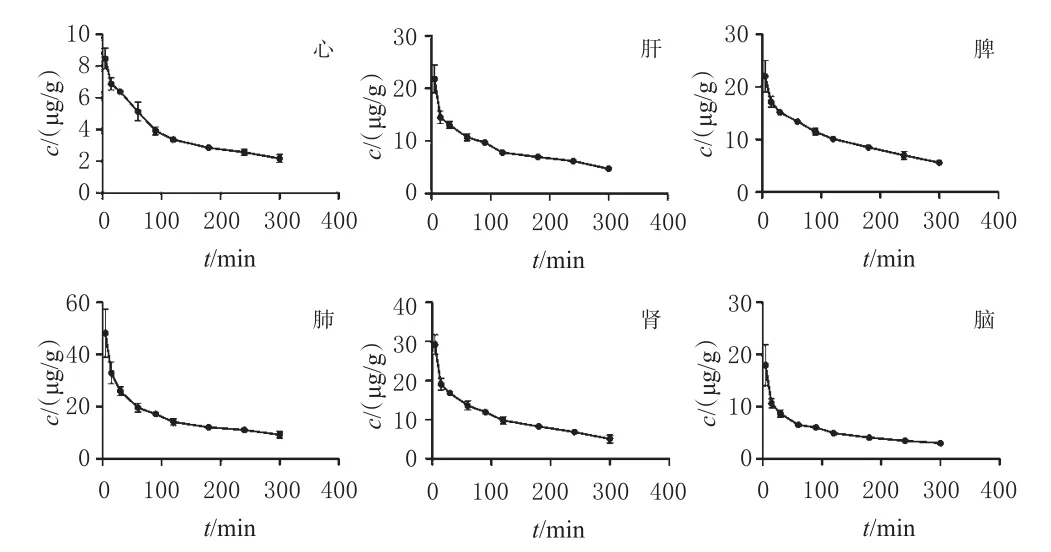
图4 尾静脉注射PELGE-Cre-NPs后大鼠各组织样品中Cre的平均药-时曲线(±s,n=6)
表3 尾静脉注射PELGE-Cre-NPs后大鼠各组织样品中Cre的主要药动学参数(非房室模型,±s,n=6)
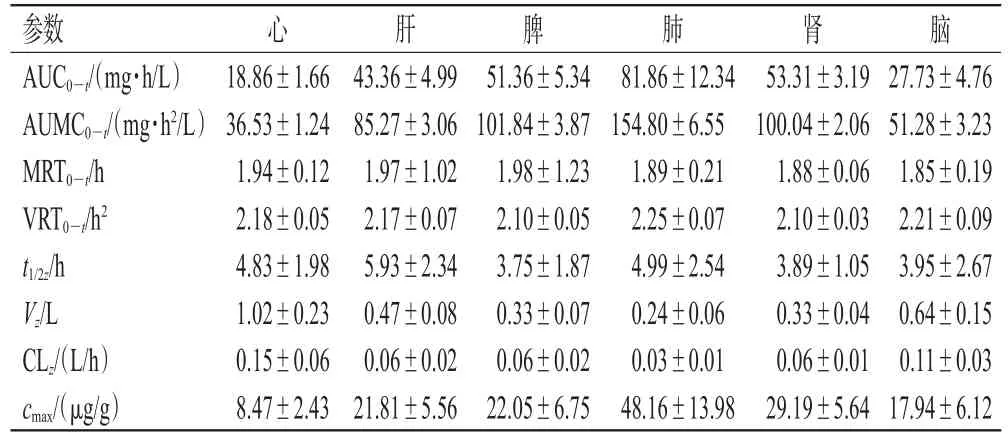
表3 尾静脉注射PELGE-Cre-NPs后大鼠各组织样品中Cre的主要药动学参数(非房室模型,±s,n=6)
AUMC0-t:药物与时间乘积对时间t的积分;VRT0-t:滞留时间的方差;Vz:分布容积;CLz:清除率;cmax:达峰浓度
参数AUC0-t/(mg·h/L)AUMC0-t/(mg·h2/L)MRT0-t/h VRT0-t/h2 t1/2z/h Vz/L CLz/(L/h)cmax/(μg/g)心肝脾肺肾脑18.86±1.66 36.53±1.24 1.94±0.12 2.18±0.05 4.83±1.98 1.02±0.23 0.15±0.06 8.47±2.43 43.36±4.99 85.27±3.06 1.97±1.02 2.17±0.07 5.93±2.34 0.47±0.08 0.06±0.02 21.81±5.56 51.36±5.34 101.84±3.87 1.98±1.23 2.10±0.05 3.75±1.87 0.33±0.07 0.06±0.02 22.05±6.75 81.86±12.34 154.80±6.55 1.89±0.21 2.25±0.07 4.99±2.54 0.24±0.06 0.03±0.01 48.16±13.98 53.31±3.19 100.04±2.06 1.88±0.06 2.10±0.03 3.89±1.05 0.33±0.04 0.06±0.01 29.19±5.64 27.73±4.76 51.28±3.23 1.85±0.19 2.21±0.09 3.95±2.67 0.64±0.15 0.11±0.03 17.94±6.12
3 讨论
组织分布实验结果显示,尾静脉注射PELGE-Cre-NPs后,Cre在大鼠体内的各个组织中均有分布:给药后5、15、30、60、90 min,Cre在大鼠各组织中的含量由高到低依次为肺、肾、脾、肝、脑、心;给药后120、180、240、300 min,Cre在大鼠各组织中的含量由高到低则变为肺、脾、肾、肝、脑、心。此外,随着时间的推移,大鼠各组织样品中Cre的含量皆在下降,且不同组织间Cre含量的差异有缩小趋势。
组织药动学研究结果显示,Cre在肺组织中的AUC0-t最大[(81.86±12.34)mg·h/L],t1/2z较长[(4.99±2.54)h],提示PELGE-Cre-NPs在大鼠肺组织中的分布较多且消除较慢。Cre在肝组织中的AUC0-t居中[(43.36±4.99)mg·h/L],t1/2z最长[(5.93±2.34)h],MRT0-t也较长[(1.97±0.12)h],提示PELGE-Cre-NPs在大鼠肝组织中也有一定分布,且消除时间较长。Cre在心组织中的AUC0-t最小[(18.86±1.66)mg·h/L],但其MRT0-t[(1.94±0.12)h]长于该药在肺组织中的MRT0-t[(1.89±0.21)h],提示PELGE-Cre-NPs虽在心组织中的分布较少,但滞留时间较长。Cre在脑组织中亦有所分布,提示该药能透过血脑屏障,这可能与Cre为弱碱性的小极性化合物有关。
通过对比本课题组前期组织分布研究[17]结果发现,与Cre注射剂相比,制成PELGE-Cre-NPs后,Cre在心、肝、脾、肺、肾、脑组织中的平均含量(给药后120 min)分别由 1.39、1.66、1.56、2.53、1.56、1.42 μg/g 升至 3.37、7.82、10.11、14.11、9.82、4.93 μg/g,提示剂型的改变使Cre在大鼠各组织中的分布均有所增加,初步达到了长循环的目的。但由于2项实验的操作条件有所不同,故剂型的分布差异有待后续研究进一步验证。
综上所述,PELGE-Cre-NPs在大鼠各组织中均有分布,以肺组织为主,心组织较少;该药在各组织中的消除有所不同,在心、肺、肝组织中的消除较慢。

