基于肠脑轴探讨地黄饮子对APP/PS1转基因阳性小鼠神经功能的改善作用及机制Δ
陈靖,梁喜才,王健,王生化,宁天一(1.辽宁中医药大学教学实验中心,沈阳 110847;.辽宁中医药大学实验动物中心,沈阳 110847)
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经系统退行性疾病,患者发病多隐匿,且其症状可随年龄增长而不断加重,临床上以记忆认知障碍、情绪多疑、性格古怪、行为异常、智力下降等表现为主要特征,但具体病因未知[1]。据世界卫生组织估计,到2050年全球老年痴呆症患者数将突破1.5亿,其中AD患者约占2/3[2]。随着社会节奏的加快和人口老龄化的不断加剧,AD患者比例不断增高,给患者家庭和社会带来了沉重负担[3]。
本课题组前期研究发现,抑郁症可能是重要的AD致病危险因素,并且抑郁症状在AD临床诊断之前就已出现[4]。中医理论认为,在补肾填精的基础上,调畅气机有助于AD的防治[5]。地黄饮子出自金元四大家之一刘完素的《宣明论方》,以温补下元为主,摄纳浮阳并佐以开窍化痰[6]。该方用熟地黄、山萸肉滋补肾阴,肉苁蓉、巴戟天温补肾阳;配合附子和肉桂的辛热,助滋养下元、吸收浮阳、引火归原;石斛、麦冬和五味子润肺补肾,金水相生,滋水以降火;石菖蒲与远志、茯苓开窍化痰;再以姜枣调和诸药,共奏填精补髓、化浊开窍之功效[7]。地黄饮子是近年来临床中医辅助治疗AD的经典方,可显著改善AD患者的认知、学习和记忆能力,具有良好的临床疗效[7]。有研究证实,肠道菌群可通过肠脑轴这一途径调节大脑功能,调控神经递质或代谢产物生成,促进大脑神经细胞凋亡,从而发挥神经保护作用,与AD的发生发展密切相关[8]。基于此,本研究拟基于肠脑轴,从肠道菌群、细胞凋亡、神经保护的角度开展相关实验,旨在为进一步阐释该方治疗AD的潜在机制提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括WMT-100S型Morris水迷宫视频分析系统(成都泰盟软件有限公司),BX-50型光学显微镜(日本Olympus公司),801型形态学图像分析系统(南京捷达实验设备有限公司),164-5050型电泳仪、Trans-Blot Turbo型全能型蛋白快速转膜仪(美国Bio-Rad公司),Tanon 5200型全自动化学发光图像分析系统(上海天能科技有限公司),Miseq PE300型高通量测序平台(美国Illumina公司)等。
1.2 主要药品与试剂
地黄饮子组方为熟地黄30 g,姜枣3 g,巴戟天、山萸肉、石斛、肉苁蓉、炮附子、茯苓、石菖蒲、远志、肉桂、麦冬、五味子各10 g。上述各中药饮片(产地为安徽)均购自国药控股国大药房有限公司,由辽宁中医药大学药学院张建逵教授鉴定均为真品。
盐酸多奈哌齐片(批号139210401,规格5 mg)购自卫材(中国)药业有限公司;兔源Bcl-2抗体(批号BA0412)、鼠源Bax抗体(批号A00183)、兔源脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)抗体(批号PB9075)均购自武汉博士德生物工程有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(批号7074P2)购自美国CST公司;BCA法蛋白测定试剂盒(批号K20316)购自北京全式金生物技术股份有限公司;肠道菌群测定所用Agencourt AMPure XP核酸纯化试剂盒(批号A63880)购自美国Beckman Coulter公司;其余试剂均为分析纯,水为纯净水。
1.3 实验动物
SPF级APP/PS1转基因阳性(简称“APP转基因”)及APP/PS1转基因阴性(简称“APP野生型”)雄性小鼠,5月龄,体质量为20~25 g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证号为SCXK(京)2019-0010。所有小鼠均饲养于温湿度适中的隔离系统内,予清洁SPF级饲料喂养,自由摄食、饮水。本研究方案通过辽宁中医药大学实验动物伦理委员会审核,批准号为21000042021116。
2 方法
2.1 药液的制备
按“1.2”项下处方量称取地黄饮子各饮片,加适量水煎煮,以大火煮沸后,再以文火煎煮约20 min,滤过;药渣再次同法煎煮,滤过;合并两次滤液,于室温下浓缩成质量浓度为1 g/mL(以生药量计,下同)的中剂量灌胃药液;用水稀释制成质量浓度为0.5 g/mL的低剂量灌胃药液,或进一步浓缩成2 g/mL的高剂量灌胃药液,备用。
取盐酸多奈哌齐片,粉碎,以水为溶剂,先制成质量浓度为1 mg/mL的药液(以主药计,下同),再用水稀释,得质量浓度为0.03 mg/mL的灌胃药液,备用。
2.2 分组、造模与给药
取APP转基因小鼠30只,随机分成APP/PS1阳性模型组、地黄饮子高剂量组、地黄饮子中剂量组、地黄饮子低剂量组、西药组,每组6只;另取APP野生型小鼠6只,设为APP/PS1阴性正常组。适应性喂养1周后,地黄饮子高、中、低剂量组小鼠分别灌胃地黄饮子48、24、12 g/kg(取“2.1”项下0.5、1、2 g/mL地黄饮子药液,灌胃体积约为0.72 mL),西药组小鼠灌胃盐酸多奈哌齐0.8 mg/kg(取“2.1”项下盐酸多奈哌齐药液,灌胃体积约为0.72 mL),APP/PS1阳性模型组和APP/PS1阴性正常组小鼠灌胃同体积生理盐水,每天1次,连续28 d。各药物组剂量设置依据如下:地黄饮子按70 kg成人单日临床剂量143 g(以生药量计),参照《动物实验方法学》以人与小鼠体表面积比换算得小鼠等效剂量为24 g/kg,以此作为中剂量,其2倍作为高剂量,其1/2作为低剂量;盐酸多奈哌齐按70 kg成人单日临床剂量5 mg,参照《动物实验方法学》以人与小鼠体表面积比换算得小鼠等效剂量为0.8 mg/kg,以此作为给药剂量。
2.3 Morris水迷宫实验
末次给药后,所有小鼠进行Morris水迷宫实验。前4天为定位航行实验:在第3象限中心放置逃生平台(液面高出平台2 cm),将小鼠面对池壁,分别从4个不同的起始点(不同象限)放入水中,引导其在90 s内找到平台并停留10 s,记录其找到平台所用时间,作为逃避潜伏期;若小鼠在90 s内未能找到平台,则将其逃逸潜伏期记为90 s。最后1天进行空间探索实验:移去平台,将小鼠从第3象限对面的入水点放入水中,记录其穿过原平台所在位置的次数。
2.4 肠道菌群测定
检测APP/PS1阳性模型组、APP/PS1阴性正常组、地黄饮子中剂量组和西药组小鼠的肠道菌群。给药结束后,上述组所有小鼠禁食12 h,采用强制法(即轻轻挤压尾根和直肠末端),将要排出的粪便收集在无菌EP管中,于-80 ℃冷冻。用基因组提取试剂盒从小鼠粪便中提取DNA,并扩增细菌16Sr RNA的V3+V4区[引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和 806R(5'-GGACTACNNGGGTATCTAAT-3')]。取所得 PCR扩增产物,构建微生物多样性测序文库,采用高通量测序平台进行可变区检测,根据标签进行物种分类、操作分类单位(operational taxonomic units,OTU)分析、多样性分析、样品群落组成分析(维恩图)、细菌属分类水平和组间群落差异(LDA effect size,LEfSe)分析。上述实验委托北京奥维森基因科技有限公司完成。
2.5 海马组织CA1区神经细胞病理改变的观察
上述实验结束后,以颈椎脱臼法处死小鼠,取海马组织,置于4%多聚甲醛溶液中固定24 h,经常规包埋、切片、脱蜡后,行苏木精-伊红(HE)染色,再经梯度脱水、二甲苯透明,用中性树胶封片,置于光学显微镜下观察其海马组织CA1区神经细胞的病理改变,并使用形态学图像分析系统采集图像。
2.6 海马组织中Bcl-2、Bax蛋白表达检测
采用免疫组化法进行检测。取“2.5”项下石蜡切片,脱蜡后用水浸洗,消除内源性过氧化物酶活性并抗原修复后,滴加Bcl-2、Bax一抗(稀释比例均为1∶100)和HRP标记的IgG二抗(稀释比例为1∶300)。经DAB显色剂显色、苏木精复染、脱水透明后,用中性树脂封片,置于光学显微镜下观察(细胞质为棕色或深棕色的为相应蛋白表达阳性细胞)。于高倍镜下随机选取5个视野,采用Image Pro Plus 6.0软件对Bax、Bcl-2蛋白的表达进行定量分析,以平均光密度值作为结果。
2.7 海马组织中BDNF蛋白表达的检测
采用Western blot法进行检测。取各组小鼠海马组织适量,剪碎后加入裂解液,放入匀浆器充分裂解,于4 ℃下以12 000 r/min离心10 min,取上清液,采用BCA法测定蛋白浓度后加入上样缓冲液,取总蛋白50 μg,金属浴中加热8 min,使蛋白充分变性。取变性蛋白,经12%SDS-PAGE分离后转至硝酸纤维素膜上。以5%脱脂牛奶在室温下封闭1 h,加入BDNF、β-actin一抗(稀释比例分别为1∶500、1∶1 000),4 ℃孵育过夜;用TBST缓冲液洗膜洗涤5 min×3次,加入相应二抗(稀释比例为1∶1 000),室温孵育1 h;同法洗膜后,使用形态学图像分析系统进行扫描显影,采用Image J 5.0软件计算条带灰度值,并以目标蛋白与内参蛋白(β-actin)的灰度值比值作为目标蛋白的表达水平。
2.8 统计学方法
采用SPSS 23.0软件对数据进行统计分析。数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法检验。检验水准α=0.05。
3 结果
3.1 小鼠Morris水迷宫实验结果
定位航行实验结果显示,早期各组小鼠的逃逸潜伏期比较,差异均无统计学意义(P>0.05),但总体呈逐渐下降趋势(结果略)。第4天(表1),APP/PS1阳性模型组小鼠的逃避潜伏期显著长于APP/PS1阴性正常组(P<0.05),提示APP转基因小鼠存在空间学习障碍;与APP/PS1阳性模型组比较,地黄饮子中、高剂量组和西药组小鼠的逃避潜伏期均显著缩短(P<0.05)。
表1 各组小鼠水迷宫实验结果(±s,n=6)
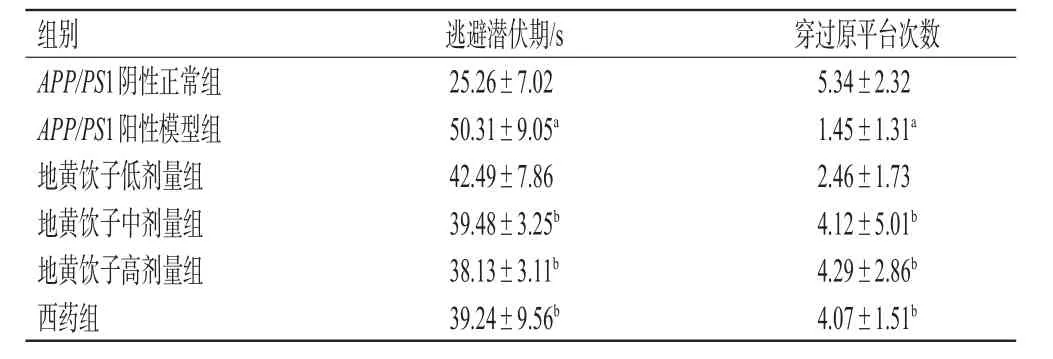
表1 各组小鼠水迷宫实验结果(±s,n=6)
a:与APP/PS1阴性正常组比较,P<0.05;b:与APP/PS1阳性模型组比较,P<0.05
穿过原平台次数组别 逃避潜伏期/s 5.34±2.32 1.45±1.31a 2.46±1.73 4.12±5.01b 4.29±2.86b 4.07±1.51b APP/PS1阴性正常组APP/PS1阳性模型组地黄饮子低剂量组地黄饮子中剂量组地黄饮子高剂量组西药组25.26±7.02 50.31±9.05a 42.49±7.86 39.48±3.25b 38.13±3.11b 39.24±9.56b
空间探索实验结果(表1)显示,APP/PS1阳性模型组小鼠穿过原平台次数显著少于APP/PS1阴性正常组(P<0.05),表明APP转基因小鼠的记忆能力明显下降;与APP/PS1阳性模型组比较,各药物组小鼠穿过原平台次数均有不同程度的提高,其中地黄饮子中、高剂量组和西药组小鼠该指标显著高于与APP/PS1阳性模型组(P<0.05)。
3.2 小鼠肠道菌群检测结果
3.2.1 肠道菌群α多样性分析 微生物群落的丰富度和多样性可通过多样性分析(α多样性)来反映,其中Chao1是用于估计群落中OTU数量的物种丰富度指数,Shannon则可用来评估样品中微生物的多样性[9]。由Chaos1指数检测结果(图1A)可知,APP/PS1阳性模型组的OTU数量显著高于其余组,地黄饮子中剂量组的OTU数量显著低于其余组(P<0.05)。由Shannon指数检测结果(图1B)可知,地黄饮子中剂量组的多样性显著高于APP/PS1阳性模型组和西药组(P<0.05),可推测中剂量的地黄饮子可降低APP转基因小鼠的某些优势菌种的数量,但可提高菌种的多样性。
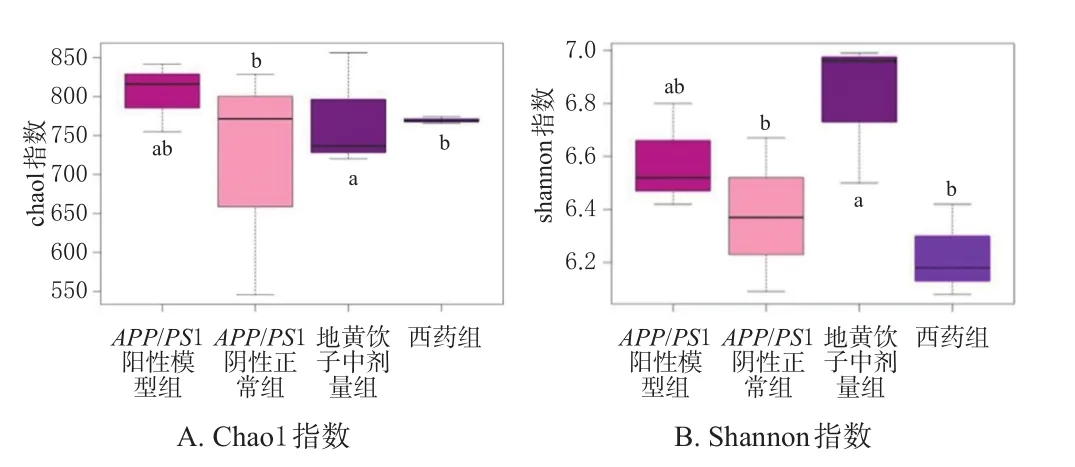
图1 各组小鼠肠道菌群的α多样性分析结果
3.2.2 样品群落组成分析 韦恩图中各组的交叉椭圆环可反映各样本之间共同存在和单独存在的OTU数量。由图2可知,4组之间共有的OTU为686个,占绝大多数。APP/PS1阳性模型组的OTU为892个,APP/PS1阴性正常组为854个,地黄饮子中剂量组为898个,西药组为877个。APP/PS1阴性正常组独有的OTU最多,为16个;APP/PS1阳性模型组独有13个,地黄饮子中剂量组和西药组分别独有9个和5个;仅地黄饮子中剂量组与APP/PS1阴性正常组共有的OTU数量为11个,多于仅西药组与APP/PS1阴性正常组共有的OTU(9个)。这说明中剂量的地黄饮子和盐酸多奈哌齐均能降低APP转基因小鼠的微生物菌群OTU丰度,但这两组的OTU丰度仍高于APP/PS1阴性正常组。
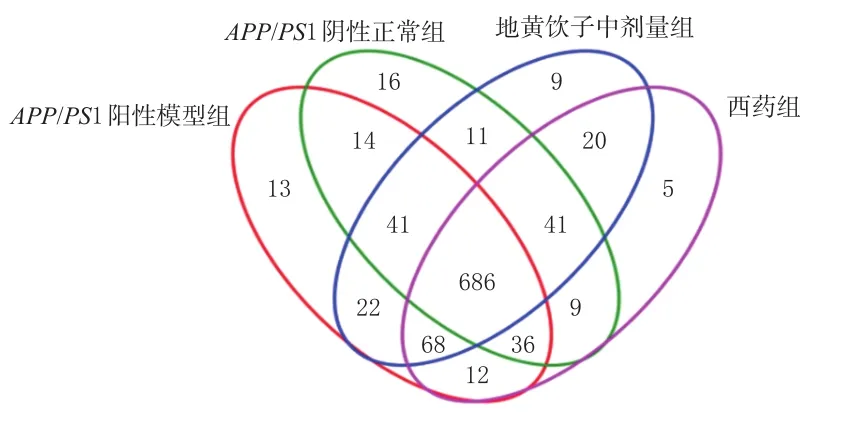
图2 各组小鼠肠道微生物OTU丰度的维恩图
3.2.3 细菌属分类水平的比较 在属水平(图3)上,APP/PS1阴性正常组小鼠粪便菌群的主要菌属是厚壁菌门中的g_Lachnospiraceae_NK4A136_group(13.8%)和杜氏杆菌属g_Dubosiella(2.6%);相较于APP/PS1阳性模型组的g_Lachnospiraceae_NK4A136_group(7.1%)和西药组g_Dubosiella(1.4%),地黄饮子中剂量组这两种菌属的丰度显著提高,分别为11.8%和3.4%。相对于地黄饮子中剂量组(0.1%),西药组疣微菌门阿克曼氏菌属g_Akkermansia菌属的丰度明显提高(2.7%)。相较于APP/PS1阳性模型组(11.1%),地黄饮子中剂量组和西药组普雷沃氏菌属g_Prevotellaceae_UCG-001的丰度(分别为4.7%和5.9%)均降低。

图3 各组小鼠细菌属分类水平的菌种丰度热图
3.2.4 肠道菌群LEfSe分析 LEfSe分析可实现多个组别的比较,还能进行亚组分析,从而找到在组间丰度上存在显著差异的物种[8]。由各组LEfSe分析结果(图4)可知,APP/PS1阴性正常组的优势菌种是f_Clos-tridium_methylpentosum_group,地黄饮子中剂量组的优势菌种是梭菌纲o_Clostridia_vadinBB60_group、疣微菌g_UCG_005,西药组的s_Bacteroides_acidifaciens_JCM_10556则是丰度差异高的菌种。
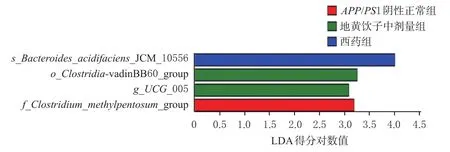
图4 各组小鼠肠道菌群LEfSe分析图
3.3 小鼠海马组织中神经细胞HE染色结果
HE染色结果(图5)显示,APP/PS1阴性正常组小鼠海马组织CA1区神经细胞排列整齐,核染较为均匀,边界层次分明,结构清晰,神经细胞排列紧密。APP/PS1阳性模型组小鼠海马组织CA1区神经细胞数量减少、分布不均匀,排列稀疏,细胞质不丰富;地黄饮子中、高剂量组和西药组小鼠海马组织CA1区神经细胞核排列较紧密,细胞形态有不同程度的改善,神经细胞数量较多且结构较为完整。

图5 各组小鼠海马HE染色观察显微图
3.4 小鼠海马组织中Bcl-2和Bax蛋白的表达水平
与APP/PS1阴性正常组比较,APP/PS1阳性模型组小鼠海马组织中Bcl-2蛋白显著下调,Bax蛋白显著上调(P<0.05);与APP/PS1阳性模型组比较,地黄饮子中、高剂量组和西药组小鼠海马组织中Bcl-2蛋白显著上调,Bax蛋白显著下调(P<0.05),而地黄饮子低剂量组上述蛋白表达水平差异均无统计学意义(P>0.05),详见表2。免疫组化染色结果显示,Bcl-2和Bax蛋白阳性表达均呈棕黄色,主要位于胞浆与胞膜,详见图6、图7。
表2 各组小鼠Bcl-2和Bax平均光密度值比较(±s,n=6)
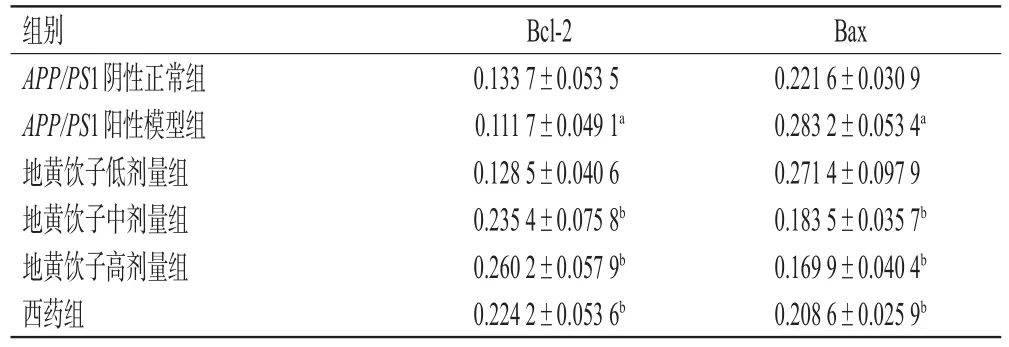
表2 各组小鼠Bcl-2和Bax平均光密度值比较(±s,n=6)
a:与APP/PS1阴性正常组比较,P<0.05;b:与APP/PS1阳性模型组比较:P<0.05
Bax 0.221 6±0.030 9 0.283 2±0.053 4a 0.271 4±0.097 9 0.183 5±0.035 7b 0.169 9±0.040 4b 0.208 6±0.025 9b组别APP/PS1阴性正常组APP/PS1阳性模型组地黄饮子低剂量组地黄饮子中剂量组地黄饮子高剂量组西药组Bcl-2 0.133 7±0.053 5 0.111 7±0.049 1a 0.128 5±0.040 6 0.235 4±0.075 8b 0.260 2±0.057 9b 0.224 2±0.053 6b

图6 各组小鼠海马区Bcl-2蛋白表达

图7 各组小鼠海马区Bax蛋白表达
3.5 小鼠海马组织中BDNF的表达水平
与APP/PS1阴性正常组比较,APP/PS1阳性模型组小鼠海马组织BDNF的表达水平显著降低(P<0.05);与APP/PS1阳性模型组比较,地黄饮子中、高剂量组和西药组小鼠BDNF的表达水平均显著升高(P<0.05),地黄饮子低剂量组该蛋白表达水平差异无统计学意义(P>0.05),详见图8。

图8 各组小鼠海马区BDNF表达水平比较
4 讨论
AD的发病机制尚不十分清楚,主要涉及以下理论:胆碱能理论、tau蛋白假说、神经血管理论、氧化应激理论和β淀粉样蛋白瀑布理论等[10]。目前,临床尚无有效治疗AD的方法,其中西医所用药物(如多奈哌齐和尼莫地平)通常与神经递质和脑血管扩张有关,上述药物的临床疗效有限,且有引发心血管反应(心动过缓、晕厥)、头痛、头晕、失眠和消化道反应等不良反应的可能[11]。
近年有报道指出,AD的发生与肠道菌群的改变有关,肠道微生物与中枢神经系统相互作用的假说也成为AD的可能发病机制之一[8]。肠脑轴(肠道微生物群-脑轴)是连接消化道和中枢神经系统的重要生化信号,可影响从大脑发育到神经系统疾病进展的所有相关事件[8]。肠脑轴在AD的发病机制中起关键作用,肠道微生物群可通过神经、内分泌和免疫途径与中枢神经系统沟通,从而影响大脑的功能和行为[12];同时,肠道菌群失调可能导致脑内神经因子的异常表达,从而加重脑内神经细胞的损伤(如导致海马神经细胞凋亡)[13]。
本研究首先通过Morris水迷宫采集小鼠行为学数据,并用以评估小鼠的空间学习、记忆认知水平。结果显示,APP/PS1阳性模型组小鼠的逃避潜伏期显著延长,穿过原平台次数显著减少,表明APP/PS1阳性模型小鼠的学习记忆能力下降;经地黄饮子干预后,小鼠的逃避潜伏期显著缩短,穿过原平台次数显著增加,以中、高剂量组效果为优,提示地黄饮子可改善APP/PS1阳性模型小鼠的学习记忆能力。
本研究的肠道菌群检测结果显示,地黄饮子更倾向于提升菌群的多样性,尤其是厚壁菌门的菌种;其优势菌种的比例更接近于APP/PS1阴性正常组;LEfSe分析结果显示,地黄饮子中剂量组的优势菌种是梭菌纲o_Clostridia_vadinBB60_group,疣微菌g_UCG_005,也进一步证实了地黄饮子有助于提高厚壁菌门、芽孢杆菌属、乳杆菌属、毛螺旋菌属等菌种的多样性。有研究指出,上述微生物可有助于改善AD患者的认知症状[14]。例如,上述微生物可发酵膳食纤维,代谢生成以乙酸盐、丙酸盐、丁酸盐为主的短链脂肪酸(short-chain fatty acid,SCFA)。丁酸盐具有神经保护作用和血脑屏障恢复功能,可显著改善学习和记忆能力,具有明显的改善认知和缓解抑郁的作用[15];同时,丁酸盐可防治肠毒素进入大脑,具有一定的抗炎作用[16]。该SCFA已被证实与疣微菌g_UCG_005有关,而疣微菌门微生物可通过参与调节免疫反应和维持体内代谢平衡来影响宿主的健康[9]。此外,丙酸盐可通过产生多巴胺和5-羟色胺来调节情绪,在减轻精神压力和改善抑郁方面具有重要作用[15]。有研究发现,一些乳酸杆菌和双歧杆菌可抑制β淀粉样蛋白,可通过增加海马和大脑皮层中BDNF等神经营养因子的表达来提高小鼠的学习和记忆能力[17]。乙酰胆碱是中枢神经系统中一种重要的神经递质,通常在AD患者的大脑中减少,而芽孢杆菌可产生乙酰胆碱,并通过迷走神经来协助胆碱信号的传递[18]。
海马组织CA1区神经细胞HE染色结果显示,中、高剂量地黄饮子能有效改善海马神经细胞的病理改变,恢复细胞排列的紧密度,避免负责学习记忆功能的海马组织受到损伤。Bcl-2家族中2个重要成员Bcl-2和Bax是细胞凋亡调控系统的重要组成,Bcl-2蛋白可通过稳定细胞线粒体膜来抑制细胞凋亡[19];Bax蛋白则可进入细胞线粒体膜,诱导细胞凋亡[20]。当Bcl-2表达增加时,其可与Bax形成异源二聚体,从而减弱Bax的促凋亡作用,减少细胞凋亡[21]。本研究结果显示,中、高剂量的地黄饮子能显著上调小鼠海马组织中Bcl-2的表达,下调Bax的表达,提示地黄饮子可通过抑制中枢神经元凋亡来发挥对大脑神经元的保护作用。
BDNF作为脑源性神经营养因子,对神经元发育、分化和突触可塑性等具有维持、促进的作用,其编码基因在海马组织中的表达受神经元与神经递质相互作用的影响[22]。有研究证实,AD患者脑组织和血清中BDNF水平明显降低,肠道菌群可通过调节BDNF的水平来影响宿主的认知功能,从而诱发AD[23];此外,BDNF的分泌减少也常伴有海马组织中大量神经细胞的凋亡[24]。本研究结果证实,中、高剂量的地黄饮子可有效提高APP/PS1阳性模型小鼠海马组织中BDNF水平。
综上所述,地黄饮子可增加肠道菌群的多样性,改变优势菌种,并能抑制大脑海马神经细胞凋亡,提高BDNF水平;其作用机制可能是借助肠脑轴来保护神经细胞,从而提高APP/PS1阳性模型小鼠的学习和认知能力。

