阳离子型木质素基水凝胶对甲基橙的吸附研究
张 政,徐 奥,张晓玉,陈 武*
(1.长江大学化学与环境工程学院,湖北 荆州 434023;2.中国石油HSE重点实验室(长江大学),湖北 荆州 434023)
木质素基水凝胶由于含有羧基、酚羟基、季铵基等活性官能团,亲水性较好,具有较强的吸附能力[1-2],且其主要原料木质素具有来源广、成本低、可生物降解等特点,在污染治理方面展示出潜在的应用前景。研究发现,木质素基水凝胶对染料[3-4]及重金属离子Cu2+、Pb2+、Mn2+、Zn2+、Ni2+等[5-7]的吸附效果较好。徐继红等[8]以木质素磺酸钠(LS)、2-丙烯酰氨基-2-甲基丙磺酸(AMPS)、丙烯酸(AA)等为原料,合成了一种木质素基水凝胶吸附剂LS-g-PAMPS/AA,并考察了其对亚甲基蓝的吸附性能,结果表明,在优化条件下LS-g-PAMPS/AA对亚甲基蓝的吸附率高达95%;Li等[9]合成了一种具有三维结构的TiO2-石墨烯水凝胶,其对水溶液中Cr(Ⅵ)的去除率达到100%。在此,作者以木质素基水凝胶为基础,引入一种阳离子单体丙烯酰氧乙基三甲基氯化铵(DAC)进行化学改性,合成一种阳离子型木质素基水凝胶(D-LH),通过FTIR、SEM对其结构进行表征,评价D-LH的溶胀与消溶性能及对甲基橙(MO)的吸附性能,并通过吸附动力学、等温吸附模型、吸附热力学探讨吸附机理,以期为新型吸附剂的开发提供参考。
1 实验
1.1 试剂与仪器
木质素磺酸钠(LS)、N,N′-亚甲基双丙烯酰胺(MBA),天津光复精细化工研究所;丙烯酰胺(AM),天津科密欧化学试剂有限公司;过硫酸钾(KPS),天津北联精细化学品开发有限公司;N,N,N′,N′-四甲基乙二胺(TEMED)、丙烯酰氧乙基三甲基氯化铵(DAC),上海源叶生物科技有限公司;甲基橙(MO),天津福晨化学试剂厂;所用试剂均为分析纯,实验用水为去离子水。
SP-2100型可见分光光度计,上海光谱仪器有限公司;IR400型傅立叶变换红外光谱仪(FTIR),日本岛津;Mira3型场发射扫描电子显微镜(SEM),捷克泰斯肯。
1.2 D-LH的合成[4]
准确称取0.4 g LS、1.4 g AM和0.036 g交联剂MBA于烧杯中,加入10 mL去离子水并置于40 ℃水浴锅中充分溶解,得溶液A;准确称取0.22 g KPS于另一烧杯中,加入10 mL去离子水并置于40 ℃水浴锅中充分溶解,得溶液B。10~15 min后,将溶液A与溶液B混合,摇匀,加入70 μL TEMED和一定量的阳离子单体DAC,快速摇匀,置于40 ℃恒温水浴锅中进行反应,直至反应体系出现胶状固体,取出并置于去离子水中浸泡24 h后,将其切成块状于60 ℃烘箱中烘干至恒重,即得干燥的D-LH。
1.3 表征
FTIR分析:采用溴化钾压片法制备木质素磺酸钠及D-LH吸附前后的样品,使用傅立叶变换红外光谱仪在4 000~400 cm-1范围内扫描10次,分辨率4 cm-1。
SEM分析:室温下将干燥的D-LH于去离子水中溶胀至平衡,取出后用滤纸擦去其表面水分,于-50 ℃冷冻干燥机中除水24 h后,转入液氮中冷冻10 min,淬断,然后喷金制样,使用场发射扫描电子显微镜在10 kV加速电压下观察D-LH的微观结构。
1.4 D-LH的性能评价
1.4.1 溶胀与消溶性能
采用质量法评价D-LH的溶胀与消溶性能。将0.1 g干燥的D-LH用25 ℃去离子水浸泡,每隔一段时间称重,按式(1)计算溶胀比;将溶胀平衡的D-LH放入无水乙醇中,每隔一段时间称重,按式(2)计算消溶率。同时在10 ℃下进行溶胀与消溶重复性测试。

(1)

(2)
式中:m0为干燥的D-LH的质量,g;mt为t时刻D-LH的质量,g;me为溶胀平衡时D-LH的质量,g。
1.4.2 吸附性能
1.4.2.1 甲基橙标准曲线的绘制
配制系列浓度(c,1~10 mg·L-1)的甲基橙溶液,室温下测定463 nm处吸光度(A),拟合得到标准曲线方程A=0.0643c+0.0083(R2=0.999)。
1.4.2.2 吸附实验
称取一定质量(0.05~0.30 g)干燥的D-LH于去离子水中,溶胀平衡后,置于150 mL具塞锥形瓶中;加入50 mL一定浓度(50~300 mg·L-1)的甲基橙溶液,并调节溶液pH值(1~13),将锥形瓶置于一定温度(30~65 ℃)水浴锅中,150 r·min-1振荡一定时间(30~300 min)后,取样测定吸光度。根据标准曲线方程计算甲基橙剩余浓度,分别按式(3)、式(4)计算吸附率(%)和吸附量(mg·g-1)。

(3)

(4)
式中:c0、ce和ct分别为甲基橙的初始浓度、吸附平衡时浓度和吸附t时间后浓度,mg·L-1;V为甲基橙溶液体积,mL;m为干燥的D-LH质量,g。
2 结果与讨论
2.1 FTIR分析(图1)

图1 木质素磺酸钠及D-LH吸附前后的FTIR图谱Fig.1 FTIR spectra of lignosulfonate sodium and D-LH before and after adsorption
从图1可以看出:(1)与木质素磺酸钠相比,D-LH的FTIR图谱中出现了较多新的特征吸收峰。其中,3 190 cm-1、1 665 cm-1处分别为N-H的对称伸缩振动吸收峰和-CONH2中-C=O的伸缩振动吸收峰,表明丙烯酰胺成功接枝到木质素磺酸钠上;1 736 cm-1、1 166 cm-1处分别为酯基和季铵基中甲基的伸缩弯曲振动吸收峰,952 cm-1处为季铵基的吸收峰,表明DAC成功接枝到木质素磺酸钠上。说明合成的D-LH中含有丙烯酰胺及DAC的特有功能基团。(2)D-LH在吸附甲基橙后,3 403 cm-1(芳环上酚醇中O-H的伸缩振动吸收峰)、1 166 cm-1、1 665 cm-1、3 190 cm-1处的吸收峰均发生了蓝移,分别移至3 415cm-1、1 222 cm-1、1 666 cm-1、3 200 cm-1处,说明D-LH中含N、O的官能团与甲基橙之间存在氢键作用[10];另外,烯烃和芳烃中C-H的变形振动(875 cm-1)和酯基的伸缩振动(1 736 cm-1)吸收峰消失,说明D-LH与甲基橙之间发生了化学反应,存在化学吸附作用[11]。
2.2 SEM分析(图2)

a.放大453倍 b.放大333倍
从图2可以看出,D-LH呈密集蜂窝状孔洞结构,孔洞分布较为规整,大小较为均匀,与文献[12-14]报道的结构特点类似。D-LH内部的孔洞结构,有利于凝胶溶胀,同时D-LH富含的羟基、羧基等亲水基团能够与大量的水分子结合,使得凝胶内部的孔洞结构打开,提供了大量的传输通道,有利于D-LH对甲基橙的吸附。
2.3 D-LH的溶胀与消溶性能(图3)

图3 D-LH的单次(a)和重复(b)溶胀与消溶结果
从图3a可以看出,在溶胀过程中,180 min前,D-LH处于快溶胀阶段,180 min时的溶胀比达到48.68 g·g-1,这与D-LH富含的羟基、羧基、磺酸基、季铵基等亲水基团有关[15],这些基团为水分子提供了大量的结合位点,从而促使凝胶快速溶胀;180 min后,D-LH处于慢溶胀阶段,由于其内部的亲水基团不断被结合占据,剩余吸附位点逐渐减少,使得溶胀速率明显减慢并趋于稳定。在消溶过程中,60 min前,D-LH消溶较快,这与初始阶段渗透压相差较大、水与乙醇相似相溶等因素有关,使得水分子从D-LH到无水乙醇转移速率较快[16];60 min后,D-LH处于慢消溶阶段,这是因为,溶液渗透压减小和凝胶内部水分子数目减少,使得单位时间转移的水分子数目减少;240 min时,D-LH基本消溶平衡,此时消溶率为98.42%。
从图3b可以看出,重复溶胀与消溶10次,溶胀比和消溶率均处于较优水平,其中第10次的溶胀比、消溶率分别为31.72 g·g-1、95.70%,表明D-LH具有良好的溶胀与消溶性能。
2.4 D-LH的吸附性能影响因素优化
2.4.1 单因素实验结果
2.4.1.1 DAC用量对吸附效果的影响
按1.2方法以不同DAC用量合成干燥D-LH,分别取0.1 g干燥D-LH于去离子水中溶胀平衡后,加入到50 mL初始浓度为100 mg·L-1的甲基橙溶液中,25 ℃下振荡吸附120 min后测定吸光度,考察DAC用量对吸附效果的影响,结果如图4所示。

图4 DAC用量对吸附效果的影响Fig.4 Effect of DAC dosage on adsorption
从图4可以看出,随着DAC用量的增加,吸附率和吸附量均迅速上升;当DAC用量超过2.1 g后,吸附率和吸附量升幅趋缓。这是因为,随着DAC用量的增加,D-LH中接枝季铵基等特征基团增多,对甲基橙的吸附能力相应增强;但由于一定量木质素磺酸钠的活性位点数量有限,继续增加DAC用量,D-LH中接枝DAC量趋于饱和,D-LH对甲基橙的吸附量变化不大。因此,综合考虑,DAC用量以2.1 g为宜。后续实验采用以DAC用量为2.1 g合成的D-LH。
2.4.1.2 pH值对吸附效果的影响
取0.1 g干燥D-LH于去离子水中溶胀平衡后,加入到50 mL初始浓度为100 mg·L-1的甲基橙溶液中,调节溶液pH值分别为1、3、5、7、9、11、13,30 ℃下振荡吸附120 min后测定吸光度,考察pH值对吸附效果的影响,结果如图5所示。
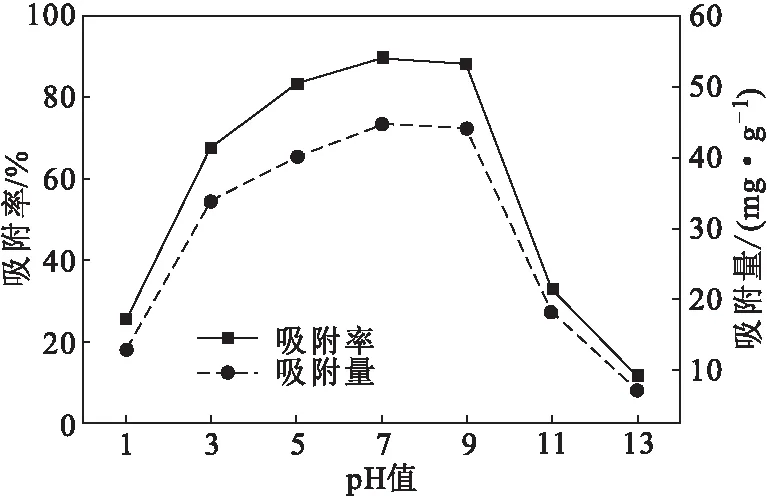
图5 pH值对吸附效果的影响Fig.5 Effect of pH value on adsorption
pH值不仅影响甲基橙的存在形式,而且影响D-LH内部官能团的电荷量[17]。从图5可以看出,随着pH值的增大,吸附率和吸附量均先逐渐上升后迅速下降,在pH值为7时,吸附效果最佳。这是因为,甲基橙是一种对氨基苯磺酸重氮盐,在中性和碱性条件下以磺酸钠盐的形式存在;在酸性条件下以磺酸的形式存在[18];而D-LH中含有大量的阳离子基团,在静电引力作用下,对阴离子具有一定的结合能力[19]。故当溶液呈中性时,D-LH对甲基橙的吸附量最大;而当溶液呈酸性时,磺酸根转化为磺酸,D-LH不具有电性,静电引力不起作用,对甲基橙的吸附量相应较小。
2.4.1.3 吸附时间对吸附效果的影响
将0.1 g干燥D-LH于去离子水中溶胀平衡后,加入到50 mL初始浓度为100 mg·L-1的甲基橙溶液中,调节溶液pH值为7,30 ℃下振荡吸附不同时间后测定吸光度,考察吸附时间对吸附效果的影响,结果如图6所示。

图6 吸附时间对吸附效果的影响Fig.6 Effect of adsorption time on adsorption
从图6可以看出,90 min前,吸附率和吸附量均迅速上升,表明吸附开始D-LH对甲基橙的吸附效果较好,这与D-LH中含有大量的吸附位点有关[20];90 min后,吸附率和吸附量缓慢上升后趋于稳定。这是因为,随着吸附时间的延长,D-LH表层吸附位点不断被结合,甲基橙继而向D-LH内部扩散被吸附,路径变长,耗时长,导致吸附率上升缓慢。综合考虑实际应用与经济效益,吸附时间以90 min为宜。
2.4.1.4 D-LH投加量对吸附效果的影响
取不同量干燥D-LH于去离子水中溶胀平衡后,分别加入到50 mL初始浓度为100 mg·L-1的甲基橙溶液中,调节溶液pH值为7,30 ℃下振荡吸附90 min后测定吸光度,考察D-LH投加量对吸附效果的影响,结果如图7所示。
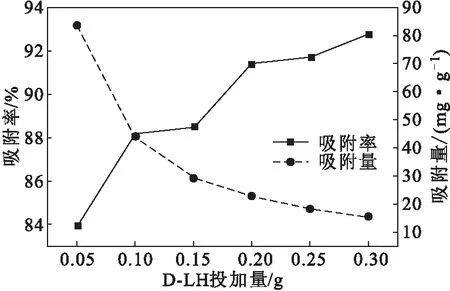
图7 D-LH投加量对吸附效果的影响Fig.7 Effect of D-LH dosage on adsorption
从图7可以看出,随着D-LH投加量的增加,吸附率逐渐上升,吸附量逐渐下降;当D-LH投加量超过0.2 g后,吸附率和吸附量的变化幅度均较小。这是因为,随着D-LH投加量的增加,吸附位点不断增多,溶液中大部分甲基橙被D-LH表层吸附位点结合,甲基橙不需扩散至D-LH内部就被吸附,吸附效率显著提升;继续增加D-LH投加量,剩余吸附位点也继续增多,导致吸附位点有效利用率下降。当D-LH投加量为0.1 g时,吸附率为88.12%,吸附量为44.12 mg·g-1,吸附效果较好。
2.4.1.5 甲基橙初始浓度对吸附效果的影响
将0.1 g干燥D-LH于去离子水中溶胀平衡后,加入到50 mL不同初始浓度的甲基橙溶液中,调节溶液pH值为7,30 ℃下振荡吸附90 min后测定吸光度,考察甲基橙初始浓度对吸附效果的影响,结果如图8所示。

图8 甲基橙初始浓度对吸附效果的影响Fig.8 Effect of initial concentration of Methyl Orange on adsorption
从图8可以看出,随着甲基橙初始浓度的增大,吸附率逐渐下降,吸附量逐渐上升。这是因为,甲基橙初始浓度越大,D-LH吸附位点数与甲基橙分子数的比值就越小[21],甲基橙溶液与D-LH表面浓度差越大,驱动力越大,吸附位点与甲基橙的碰撞就越多[22],有助于甲基橙由高浓度向低浓度扩散,吸附量相应增加;但当D-LH的吸附位点被结合达到饱和时,增大甲基橙初始浓度,吸附量也不会发生明显变化[23],吸附率反而会不断下降。当甲基橙初始浓度为150 mg·L-1时,吸附率为85.96%,吸附量为64.47 mg·g-1,吸附效果较好。
2.4.1.6 吸附温度对吸附效果的影响
将0.1 g干燥D-LH于去离子水中溶胀平衡后,加入到50 mL初始浓度为150 mg·L-1的甲基橙溶液中,调节溶液pH值为7,不同温度下振荡吸附90 min后测定吸光度,考察吸附温度对吸附效果的影响,结果如图9所示。
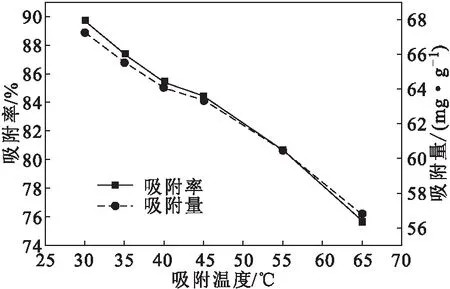
图9 吸附温度对吸附效果的影响Fig.9 Effect of adsorption temperature on adsorption
从图9可以看出,随着吸附温度的升高,吸附率和吸附量均迅速下降。这是因为,温度升高,分子热运动加剧,D-LH内部吸附位点与甲基橙的静电作用减弱,导致甲基橙分子不易被吸附,且被吸附的甲基橙在分子热运动的撞击作用下会发生脱附现象;同时D-LH内部大分子之间的交联作用增强,甲基橙进入D-LH内部孔洞受阻,使得D-LH内部甲基橙分子数目减少,吸附率与吸附量均降低,故吸附温度以30 ℃为宜。这与文献[24-26]报道的结论一致。
2.4.2 正交实验结果
在单因素实验的基础上,选取pH值(A)、吸附温度(B)、甲基橙初始浓度(C)、吸附时间(D)为考察因素,以吸附量为评价指标,进行L9(34)正交实验优化吸附条件。正交实验的设计与结果见表1。
由表1可知,各因素对吸附量的影响大小依次为:甲基橙初始浓度>吸附时间>吸附温度>pH值。最佳吸附条件为A2B1C3D2,即pH值7、吸附温度30 ℃、甲基橙初始浓度200 mg·L-1、吸附时间90 min,在此条件下进行验证实验,平均吸附量为86.05 mg·g-1,高于表1中正交实验结果。

表1 正交实验的设计与结果
2.5 吸附机理探究
2.5.1 吸附动力学
准一级动力学模型主要描述吸附过程中受扩散机制主导的物理吸附行为;准二级动力学模型主要描述化学吸附为主的吸附过程,包括吸附质之间的电子分离和共价相互作用[27-29]。不同温度下分别采用Lagergren准一级动力学方程(式5)、准二级动力学方程(式6)、内扩散方程(式7)对D-LH吸附甲基橙的数据进行拟合,拟合曲线如图10所示,各方程拟合参数见表2。
ln(Qe-Qt)=lnQe-k1t
(5)
(6)
Qt=kit0.5+P
(7)
式中:t为吸附时间,min;Qt和Qe分别为吸附t时刻和吸附平衡时的吸附量,mg·g-1;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g·mg-1·min-1;ki为内扩散速率常数,mg·g-1·min-0.5;P为与边界层厚度相关的常数。

图10 准一级动力学拟合曲线(a)、准二级动力学拟合曲线(b)和内扩散拟合曲线(c)Fig.10 Quasi-first order dynamic fitting curves(a),quasi-second order dynamic fitting curves(b),and internal diffusion fitting curves(c)

表2 准一级动力学方程、准二级动力学方程、内扩散方程的拟合参数
由表2可知,在不同温度下准二级动力学方程的相关系数R2均大于准一级动力学方程的,且理论平衡吸附量Qe与实际平衡吸附量Qe.exp较为接近,说明D-LH吸附甲基橙的过程有化学吸附,与文献[8]结论类似,这可能与D-LH中含有季铵基团或其它阳离子基团有关。在不同温度下内扩散方程能较好地拟合吸附过程,且扩散阶段可分为快扩散阶段(边界层扩散)和慢扩散阶段(内部扩散)。两阶段的拟合曲线均没有通过坐标原点,说明该吸附过程不只是颗粒内扩散,还可能存在表层吸附等其它吸附类型。在快扩散阶段,吸附剂与吸附质之间存在较大浓度差,甲基橙分子向D-LH表面或溶液边界层快速扩散,吸附速率较快;在慢扩散阶段,由于D-LH表层吸附位点被大量甲基橙占据,趋于内扩散途径;同时D-LH中大分子之间的交联作用使孔洞堵塞,分子扩散受阻,吸附速率减慢。
2.5.2 等温吸附模型
不同温度下采用Langmuir等温吸附模型(均匀表面单层吸附)(式8)、Freundlich等温吸附模型(非均匀表面多层吸附)(式9)及Temkin等温吸附模型(分子间吸附)(式10)对D-LH吸附甲基橙的数据进行分析[30],等温吸附拟合曲线、无量纲因子RL如图11所示,各模型拟合参数见表3。
(8)
(9)
Qe=βlnα+βlnce
(10)
式中:Qm为饱和吸附量,mg·g-1;KL为Langmuir吸附常数,L· mg-1;KF为Freundlich吸附常数,mg·g-1;n为常数,n>1时,吸附较易进行;α和β均为常数。
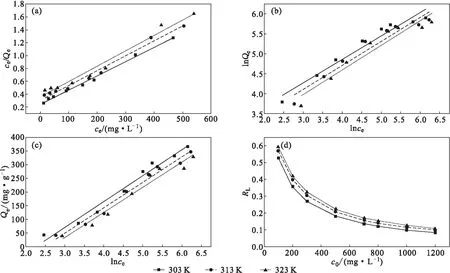
图11 Langmuir等温吸附拟合曲线(a)、Freundlich等温吸附拟合曲线(b)、Temkin等温吸附拟合曲线(c)及无量纲因子RL(d)Fig.11 Langmuir isothermal adsorption fitting curves(a),Freundlich isothermal adsorption fitting curves(b),Temkin isothermal adsorption fitting curves(c),and dimensionless factor RL(d)

表3 等温吸附模型的拟合参数
由表3可知,3种等温吸附模型的R2均大于0.9,与Freundlich、Temkin等温吸附模型的R2相比,Langmuir等温吸附模型的R2更接近1,说明D-LH对甲基橙的吸附是以均匀表面单层吸附为主、其它类型吸附为辅的过程,这与文献[31]报道一致。对于Langmuir等温吸附模型,Qm随着温度的升高而减小,说明低温条件更有利于吸附过程的进行,这与单因素实验得到的结论相一致;在303 K时,最大吸附量可达454.55 mg·g-1,优于文献[24,26,32]报道的其它材料对甲基橙的吸附效果,表明D-LH是一种优良的阴离子染料吸附剂。
RL是基于Langmuir等温吸附模型定义得到的无量纲因子,常用来判断吸附进行的难易程度,具体表达式[33]如下:
(11)
RL<1时为较易吸附,RL=1时为可逆吸附,RL>1时为较难吸附。从图11d可以看出,在不同温度下RL<1,说明该吸附过程较易进行;且甲基橙初始浓度越高,RL值越小。这说明在表面吸附位点数目一定时,甲基橙初始浓度升高,D-LH表层甲基橙分子数目增多,吸附量增大。Freundlich等温吸附模型拟合得到的n>1(表3) ,这也说明D-LH吸附甲基橙的过程较易进行。综上,D-LH对甲基橙具有优良的吸附性能。
2.5.3 吸附热力学
采用范特霍夫方程和Gibbs-Helmhotz方程对D-LH吸附甲基橙的过程进行分析,按式(12)、式(13)、式(14)计算不同温度下的吉布斯自由能变(ΔG,kJ·mol-1)、焓变(ΔH,kJ·mol-1)和熵变(ΔS,J·mol-1·K-1),结果见表4。
(12)
ΔG=-RTlnKL
(13)
(14)
式中:KL为吸附平衡常数,L·g-1;R为气体常数,8.314 J·mol-1·K-1;T为绝对温度,K。
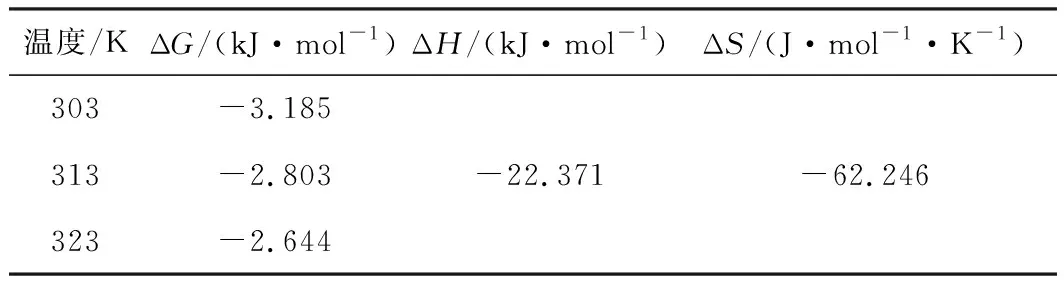
表4 吸附热力学参数
由表4可知,不同温度下,ΔG均为负值,且ΔG绝对值随温度升高而减小,说明该吸附过程是自发进行的,高温不利于吸附进行;ΔH<0,说明该吸附过程是放热的,温度升高不利于吸附,这与单因素实验结论相一致;ΔS<0,表明该吸附过程是熵减小的过程,溶液无序性降低。不同温度下,|ΔG|均小于20 kJ·mol-1、|ΔH|介于2~29 kJ·mol-1之间,这说明D-LH对甲基橙的吸附存在范德华力与氢键协同作用[4,34]。
综上分析,D-LH对甲基橙的吸附过程是物理吸附与化学吸附共同作用的结果。
3 结论
以DAC为阳离子单体,通过化学改性合成了D-LH,其呈蜂窝状孔洞结构,具有良好的溶胀与消溶性能。D-LH在180 min时溶胀比为48.68 g·g-1,在240 min时达到消溶平衡,消溶率为98.42%。在pH值为7、吸附时间为90 min、D-LH投加量为0.1 g、甲基橙初始浓度为200 mg·L-1、吸附温度为30 ℃的条件下,D-LH对甲基橙的吸附量可达86.05 mg·g-1。吸附动力学、等温吸附模型研究结果表明,该吸附过程更符合准二级动力学方程和Langmuir等温吸附模型,说明吸附过程存在化学吸附,以均匀表面单层吸附为主;吸附热力学研究结果表明,D-LH对甲基橙的吸附存在范德华力和氢键协同作用。因此,D-LH对甲基橙的吸附过程是物理吸附与化学吸附共同作用的结果。

