抗血管生成靶向治疗联合化疗治疗晚期肺癌疗效及对癌胚抗原、肝肾功能、血压的影响
王晓丽 曹永峰 周 艳
(南通市肿瘤医院肿瘤内科,江苏 南通,226000)
随着生活方式的改变,我国每年肺癌患者数量增加约65万例,严重威胁人们的生命健康。目前,晚期肺癌的临床治疗常采用化疗疗法[1]。近几年,临床对恶性肿瘤不断深入研究,发现靶向药物可促使晚期肺癌患者生存期延长。贝伐珠单抗是一种单克隆抗体,可对血管内皮细胞增殖产生有效的抑制作用,同时可减少肿瘤血管生成,发挥抗肿瘤作用[2]。据报道,抑制血管生成可提高化疗效果,是治疗肿瘤的重要手段,其与化疗药物联合使用效果显著[3]。本文探讨抗血管生成靶向治疗联合化疗治疗晚期肺癌疗效及对癌胚抗原、肝肾功能、血压的影响,旨在为临床提供参考依据,提高患者生活质量,延长生存期,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年11月~2021年11月南通市肿瘤医院收治的晚期肺癌患者共计78例,采用随机数表法将其分为对照组(n=39)和观察组(n=39)。对照组男21例,女18例;年龄47~78岁,平均年龄(65.27±3.43)岁;体质量指数18~26 kg/m2,平均体质量指数(23.61±1.26) kg/m2。观察组男22例,女17例;年龄47~78岁,平均年龄(65.29±3.72)岁;体质量指数18~26 kg/m2,平均体质量指数(23.76±1.48) kg/m2。两组患者基本资料对比,差异无统计学意义(P>0.05),均衡可比。本研究已被南通市肿瘤医院医学伦理委员会批准。所有患者均知情同意参与本研究,自愿签署知情同意书。
1.2 纳入与排除标准
纳入标准:①经病理活检,所有患者均确诊为非小细胞肺癌[4];②预计生存时间超过3个月者;③均为非高血压者;④临床资料完整者;⑤具备化疗适应证者。
排除标准:①无法正常交流者;②癌细胞远处转移者;③心肝肾严重功能障碍、严重贫血、骨髓造血功能差者;④治疗依从性低者。
1.3 方法
对照组接受紫杉醇(白蛋白结合型)联合顺铂化疗。第1天及第8天,紫杉醇(白蛋白结合型)(生产企业:石药集团欧意药业有限公司,国药准字H20183044,规格:100 mg/瓶)260 mg/m2,稀释于0.9%氯化钠溶液100 mL中,混合均匀后静脉滴注,静脉滴注时间控制在30 min左右。第2天及第9天,顺铂(生产企业:江苏豪森药业集团有限公司,国药准字H20040813,规格:6 mL∶30 mg)75 mg/m2,溶于0.9%氯化钠溶液500 mL中,混合均匀后静脉滴注,静脉滴注时间控制在3 h左右,3周为一个疗程,连续治疗3个疗程。
观察组在对照组基础上增加抗血管生成靶向治疗,将10 mg/kg贝伐珠单抗(齐鲁制药有限公司,国药准字S20190040,规格:100 mg:4 mL/支)稀释于0.9%氯化钠溶液250 mL中,混合均匀后于化疗前1天静脉滴注,3周为一个疗程,连续治疗3个疗程。
1.4 观察指标
①比较两组临床治疗效果。完全缓解(CR):肺癌病灶已经全部消失;部分缓解(PR):肺癌病灶最大直径总和缩小≥30%;病情稳定(SD):肺癌病灶最大直径总和缩小<30%,或者增加20%以下;疾病进展(PD):肺癌病灶最大直径总和增加≥20%,或者出现新病灶[5]。疾病控制率=(CR+PR+SD)例数/总例数×100%。②分别于治疗前、后连续3 d测定患者收缩压(SBP)、舒张压(DBP)水平,取平均值作为最终结果。③分别于治疗前、后采用放射免疫法测定细胞角质蛋白19片段抗原21-1(CYFRA21-1)水平、糖类抗原125(CA125)水平、血清癌胚抗原(CEA)水平。④分别于治疗前、后通过全自动生化分析仪检测患者血清丙氨酸氨基转移酶(ALT)水平、血清肌酐(Scr)水平、血清谷氨酰转肽酶(GGT)水平。⑤比较两组血液学毒性骨髓抑制、胃肠道反应、皮肤反应等不良反应发生情况。
1.5 统计学分析
采取SPSS 20.0统计学软件分析数据,临床治疗效果、不良反应发生情况等计数资料用[n(%)]表示,比较采用χ2检验;血压变化情况、肿瘤标志物水平、肝肾功能指标等计量资料用(±s)表示,比较采用t检验;P<0.05表示差异有统计学意义。
2 结果
2.1 两组临床治疗效果比较
观察组临床疾病控制率为89.74%,明显高于对照组的66.67%,差异有统计学意义(P<0.05)。见表1。
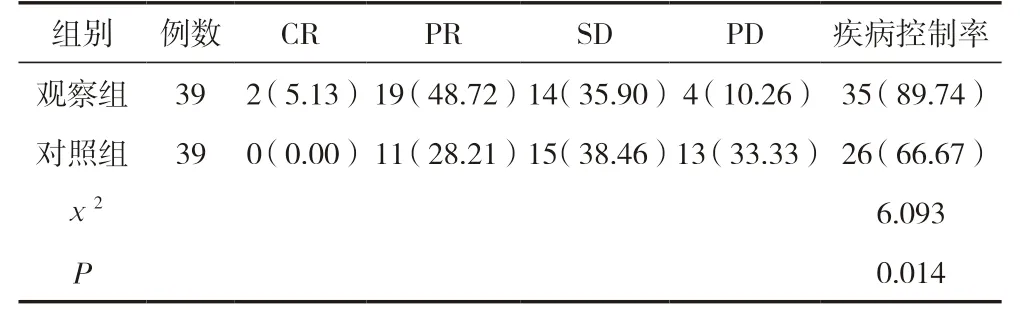
表1 两组临床治疗效果比较 [n(%)]
2.2 两组血压变化情况比较
两组治疗前收缩压、舒张压指标水平比较,差异无统计学意义(P>0.05),两组治疗后收缩压、舒张压指标水平均有所上升,且观察组明显高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组血压变化情况比较 (±s,mm Hg)

表2 两组血压变化情况比较 (±s,mm Hg)
注:1 mm Hg≈0.133 kPa。
组别 例数 收缩压 t P 舒张压 t P治疗前 治疗后 治疗前 治疗后观察组 39 122.58±9.76 151.23±12.65 11.198 <0.001 86.31±5.32 108.45±8.62 13.650 <0.001对照组 39 124.57±9.85 132.64±11.63 3.307 0.001 87.57±4.11 97.53±8.81 6.398 <0.001 t 0.898 6.756 1.170 5.533 P 0.372 <0.001 0.246 <0.001
2.3 两组血清肿瘤标志物水平比较
两组治疗前CYFRA21-1、CA125、CEA水平比较,差异无统计学意义(P>0.05),两组治疗后CYFRA21-1、CA125、CEA水平均明显下降,且观察组明显低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组血清肿瘤标志物水?平比较 (±s)

表3 两组血清肿瘤标志物水?平比较 (±s)
组别 例数 CYFRA21-1(μg/L) t P CA125(U/mL) t P CEA(ng/mL) t P治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 39 42.54±4.61 19.64±2.56 27.121<0.001 84.63±6.72 42.64±3.36 34.902<0.001 56.75±4.72 28.47±2.72 32.419<0.001对照组 39 42.78±4.43 25.72±2.35 21.245<0.001 84.58±6.51 57.59±4.01 22.045<0.001 57.34±4.53 34.45±2.57 27.446<0.001 t 0.234 10.926 0.033 17.846 0.563 9.980 P 0.816 <0.001 0.974 <0.001 0.575 <0.001
2.4 两组肝肾功能指标比较
两组治疗前ALT、Scr、GGT指标水平比较,差异无统计学意义(P>0.05),两组治疗后ALT、Scr、GGT指标水平均高于治疗前,差异有统计学意义(P<0.05),但两组治疗后ALT、Scr、GGT指标水平比较,差异无统计学意义(P>0.05),见表4。
表4 两组肝肾功能指标比较 (±s)

表4 两组肝肾功能指标比较 (±s)
组别 例数 ALT(U/L) t P Scr(μmol/L) t P GGT(U/L) t P治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 39 43.73±2.47 49.28±2.86 9.172<0.001 62.95±5.35 65.63±5.36 2.210 0.030 37.95±3.45 45.43±5.16 7.526<0.001对照组 39 43.84±2.64 50.27±2.55 10.940<0.001 62.81±6.52 67.58±4.53 3.752<0.001 38.83±3.72 47.28±4.33 9.244<0.001 t 0.190 1.614 0.104 1.735 1.083 1.715 P 0.850 0.111 0.917 0.087 0.282 0.090
2.5 两组不良反应发生情况比较
观察组血液学毒性骨髓抑制、胃肠道反应、皮肤反应等不良反应发生率与对照组比较,差异无统计学意义(P>0.05)。见表5。
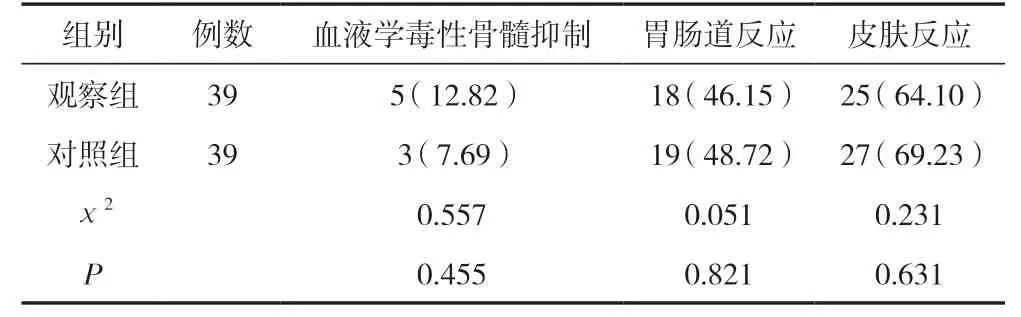
表5 两组不良反应发生情况比较 [n(%)]
3 讨论
通常情况下,肺癌早期无明显症状,大部分患者确诊时已是晚期,错过最佳治疗时间,直接威胁生命安全[6]。肺癌晚期的治疗以缩小肿瘤体积、抑制肿瘤进展、减轻患者痛苦、改善临床症状为主要原则,以此提升患者生存质量[7]。化疗是治疗肺癌的常用方法,但治疗有效率仅为20%~45%,且预后效果欠佳[8]。伴随生物学研究的不断发展,临床逐渐将靶向精准治疗用于晚期肺癌患者的治疗中,已取得较为理想的临床效果。
本研究结果显示,观察组临床疾病控制率为89.74%,明显高于对照组的66.67%(P<0.05)。肿瘤血管的形态紊乱,且管壁通透性强,而贝伐珠单抗不仅可促使肿瘤血管向正常形态发展,且贝伐珠单抗还可协助化疗药物于肿瘤组织内部有效发挥药效,有效提高肿瘤细胞对化疗药物的敏感性,进而实现病情的有效控制[9]。贝伐珠单抗是能够与VEGF受体(VEGFR)结合的抗血管内皮生长因子(VEGF)的单克隆抗体,可对VEGF的生物学活性产生抑制作用,进而阻止VEGFVEGFR结合,最终致使肿瘤新生血管生成受到抑制[10-11]。而这种抗血管生成靶向治疗易引发心律失常、血栓性微血管病、高血压、心肌缺血或梗死等心血管不良反应,其中高血压发生率最高[12]。本研究结果显示,两组治疗前收缩压、舒张压指标水平比较,差异无统计学意义(P>0.05),两组治疗后收缩压、舒张压指标水平均有所上升,且观察组明显高于对照组(P<0.05)。由此表明,通过贝伐珠单抗治疗晚期肺癌患者,应该积极采取血压控制措施,避免产生严重心血管并发症。CYFRA21-1是细胞角蛋白可溶性片段,CA125是多聚糖蛋白,CEA是一种酸性糖蛋白。据报道,患者体内血清肿瘤标志物CYFRA21-1、CA125、CEA指标水平出现异常升高的现象,与肿瘤的发生以及肿瘤的分期呈正相关[13]。本研究结果显示,比较两组患者治疗前CYFRA21-1、CA125、CEA水平,差异无统计学意义(P>0.05),两组患者治疗后CYFRA21-1、CA125、CEA水平均有所下降,且观察组比对照组低(P<0.05)。宋琳等[14]研究指出,贝伐珠单抗联合化疗药物治疗肺癌患者,可明显降低肿瘤标志物水平,促使临床症状得以改善,控制疾病发展进程。因贝伐珠单抗能够针对异常血管产生有效的修复作用,进一步降低CYFRA21-1、CA125、CEA水平,在贝伐珠单抗和化疗药物相互协同作用下,实现对肿瘤发展的抑制,提高临床治疗效果[15-16]。
本研究结果显示,两组治疗前ALT、Scr、GGT指标水平比较,差异无统计学意义(P>0.05),两组治疗后ALT、Scr、GGT指标水平均高于治疗前(P<0.05),但两组治疗后ALT、Scr、GGT指标水平比较,差异无统计学意义(P>0.05)。说明贝伐珠单抗联合化疗药物治疗晚期肺癌患者不会增加肝肾功能的损伤程度,安全性良好。该结果可能与本研究样本量、贝伐珠单抗使用剂量以及患者体质具有一定的关系,所以,为避免损伤肝肾功能,应提前制订预防措施,密切关注患者的不良反应。本研究结果显示,观察组血液学毒性骨髓抑制、胃肠道反应、皮肤反应等不良反应发生率与对照组比较,差异无统计学意义(P>0.05)。进一步表明贝伐珠单抗与化疗药物联合治疗晚期肺癌患者,在产生协同作用提升临床疗效的同时,不会增加不良反应。
综上所述,抗血管生成靶向治疗联合化疗治疗晚期肺癌患者,可进一步提高临床治疗效果,促使血清肿瘤标志物水平得以改善,且不会影响肝肾功能和增加不良反应,但是易提高患者血压水平,临床需继续深入研究。

