基于色谱法校正因子测定氢气中微量氩杂质方法研究
李志昂 王成然 王凯 刘仁红 王星 袁礼
中国测试技术研究院
氢气作为一种清洁新能源,在汽车、医药、精细化工、电子电气等行业具有广泛的用途,特别是作为燃料电池的首选燃料,在未来交通和发电领域将具有广阔的市场前景,在未来能源结构中的占比将越来越高。目前,氢能作为国家战略新兴产业已被写入2019年政府工作报告和《2020年国民经济和社会发展计划》,同时氢能是实现2060年“碳中和”目标的重要一环[1-3]。氢气来源广泛,在我国属于未被充分利用的绿色能源。氢燃料电池汽车的研发与应用是氢能利用的重点应用产业,而氢气质量是确保燃料电池正常运行的关键因素之一[4-5]。现阶段氢气质量检测技术还不成熟,一方面缺少相关检测用气体标准物质,另一方面氢气杂质参数较多,检测要求高,需要多台设备才能实现全参数测定。因此,现有氢气质量检测技术还无法满足氢气纯度的高质量检测需求。
燃料电池对于氢气质量要求较高,任何一种杂质都有可能影响燃料电池的寿命或造成仪器故障。氢气质量检测可以有效地避免仪器损坏或故障,同时可以指导燃料电池制备工艺的改进,降低能耗,有效提升氢燃料电池的寿命和安全性;氢气原料质量检测可以得到氢气有效纯度,有利于制氢企业优化制氢工艺,提高氢气产量和提升氢气质量;氢气运输途中或储氢罐中可能引入杂质,也会引起氢气纯度变化,氢气质量检测可实时监测氢气纯度,分析查找纯度变化原因,便于下游用氢企业合理利用氢气原料[6]。因此,氢气质量检测对于整个氢能产业的健康发展具有一定的推动作用。
目前,氢气质量检测标准依据的是GB/T 37244-2018《质子交换膜燃料电池汽车用燃料 氢气》。该标准采用了国际标准ISO 14687-2:2012《氢燃料质量 产品规范》和美国汽车工程协会标准SAE J2719:2015《燃料电池汽车氢燃料质量》所规定的全部技术指标。其中,氢气中氧摩尔分数要求小于5 μmol/mol,采用电化学标准方法进行测定;氢气中氮和氩的总摩尔分数应小于100 μmol/mol,采用氦离子化气相色谱法(GC-PDHID)或热导气相色谱法(GC-TCD)进行测定。随着技术的不断发展,ISO/TC 197成立了修订ISO 14687的WG27“氢燃料质量”工作组,于2019年发布了ISO 14687:2019产品标准。该产品标准将氩气的限值放宽到了300 μmol/mol。ISO 21087:2012(E)《气体分析 氢燃料的分析方法 质子交换膜(PEM)燃料电池在道路车辆上的应用》是针对ISO 14687中技术指标的分析方法标准,规定了氩气杂质的分析方法,可采用GC-PDHID、GC-TCD和气相质谱法(GC-MS)。无论是GC-PDHID还是GC-TCD,一般情况下,氧和氩几乎同时出峰,无法分别测定氢气中氧和氩的含量,故一些分析方法直接忽略氩的存在或只给出氧和氩的加和含量。
现有一些方法虽然可以分别测定氧和氩,如采用脱氧阱完全脱除氧后测定氩,进而测定氧[7-8];或通过改变载气类型如采用氩离子化气相色谱仪测定氧,进而测定氩,但该类方法因氧和氩的响应因子不一致,均不能得到准确的氧和氩的含量。同样,采用特殊材料的色谱柱可实现氧和氩的分离,进而测定氢中氧和氩的含量,但该方法存在一定的技术风险:①该类色谱柱仅适合分离含量相对较低的氧和氩,一旦其中氧或氩超过特定含量,或二者均为较高含量时,则不能实现氧和氩的有效分离;②该类色谱柱相比其他色谱柱价格较贵,且还会随着使用时间的增加而柱效下降,需定期更换,增加了设备运营成本[9-10]。气相质谱法可以通过选择离子的方式直接测定氢气中氩杂质,但由于质谱仪价格昂贵,在纯气检测中应用较少。
目前,基于色谱法校正因子的氦离子化气相色谱法联合微量氧分析法测定氢中氩杂质还未见报道,本研究介绍了氦离子化气相色谱仪的校正因子使用方法及影响因素,完善了校正因子在气相色谱中的理论及应用。利用本方法测定氢气中的氩杂质含量,在高纯气体及氢能利用等领域具有较好的应用前景。
1 实验部分
1.1 主要仪器及原理
采用的仪器设备为590氦离子化气相色谱仪(GOW-MAC,北京高麦克仪器科技有限公司),检测器为氦放电离子化检测器(Discharge Ionization Detector, DID),结构如图1所示[11]。在放电电极上施以525 V电压产生放电,获得高能紫外光,高能紫外光通过狭缝进入电离室,照射到超纯He载气和样品气上,将样品气中各组分电离。同时,激发He载气到亚稳态He,亚稳态He电离样品气后回到稳态,样品气离子被极化电极收集,经放大得到相应的谱峰。
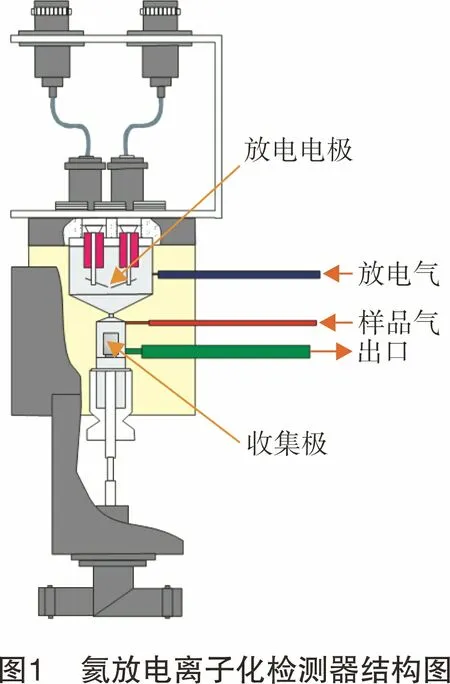
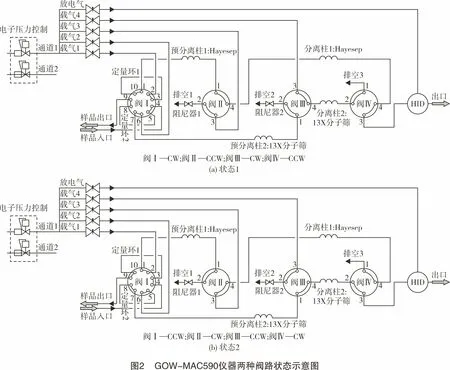
仪器为双通道单检测器,配置四阀四柱。四阀分别为样品选择进样阀Ⅰ(CW状态:LOOP1进样;CCW状态:LOOP2进样)、第一通道放空选择阀Ⅱ(CCW状态:样品通路;CW状态:样品放空)、第二通道放空选择阀Ⅲ(CW状态:样品放空;CCW状态:样品通路)和检测器选择阀Ⅳ(CCW状态:通道一样品进检测器;CW状态:通道二样品进检测器)。四柱分别为第一通道配置Hayesep预分离柱1(柱长3 m)和Hayesep分离柱1(柱长3.6 m),用来分离气体中的CH4和CO2等气体组分;第二通道配置13X分子筛预分离柱2(柱长3 m)和13X分子筛柱2(柱长:4.6 m),用来分离气体中H2、N2、O2、Ar、CO和CH4等气体组分。CH4既可在第一通道出峰,也可在第二通道出峰,为得到较好的峰形,本方法选择在第一通道出峰测定。图2所示为仪器两种阀路状态示意图。
1.2 测试样品及分析方法建立
1.2.1用于计算校正因子的标准物质的制备
气体标准物质制备采用称量法制备[12-14],高纯氢气(99.999%,5N)经过超纯气体纯化器纯化处理后使用,超纯氢气纯化器是由先普半导体技术(上海)有限公司生产的,型号为9NP100-HHP,经纯化后,CO2、CO、H2O、O2、NMHC等杂质的摩尔分数均小于1 nmol/mol。
当需要加入的气体原料质量≥5 g时,使用配气装置将气体原料直接转移到目标气瓶中,分别称量气体原料转移前后气瓶的质量,计算可得添加气体原料的质量。
制备标准物质操作过程具体如下:
(1) 称量并记录转移气体原料前样品气瓶的质量,称量过程使用参比气瓶,采用比较法进行。
(2) 将样品气瓶移至气体充装室,连接到配气装置上,使用配气装置将需加入的第一种气体原料转移到样品气瓶中。
(3) 将样品气瓶从配气装置上拆下,移至称量室,放到天平旁边,与称量室环境温度平衡。
(4) 重复(1)的称量过程,记录转移气体原料后样品气瓶的质量,计算可得第一种气体原料的加入质量。
(5) 重复步骤(2)至(3)添加第二种气体原料,依此类推完成气体标物的制备。
本研究制备了表1所列标准物质,每种标准物质用作试验用测试样品,在实验中具有不同的作用。
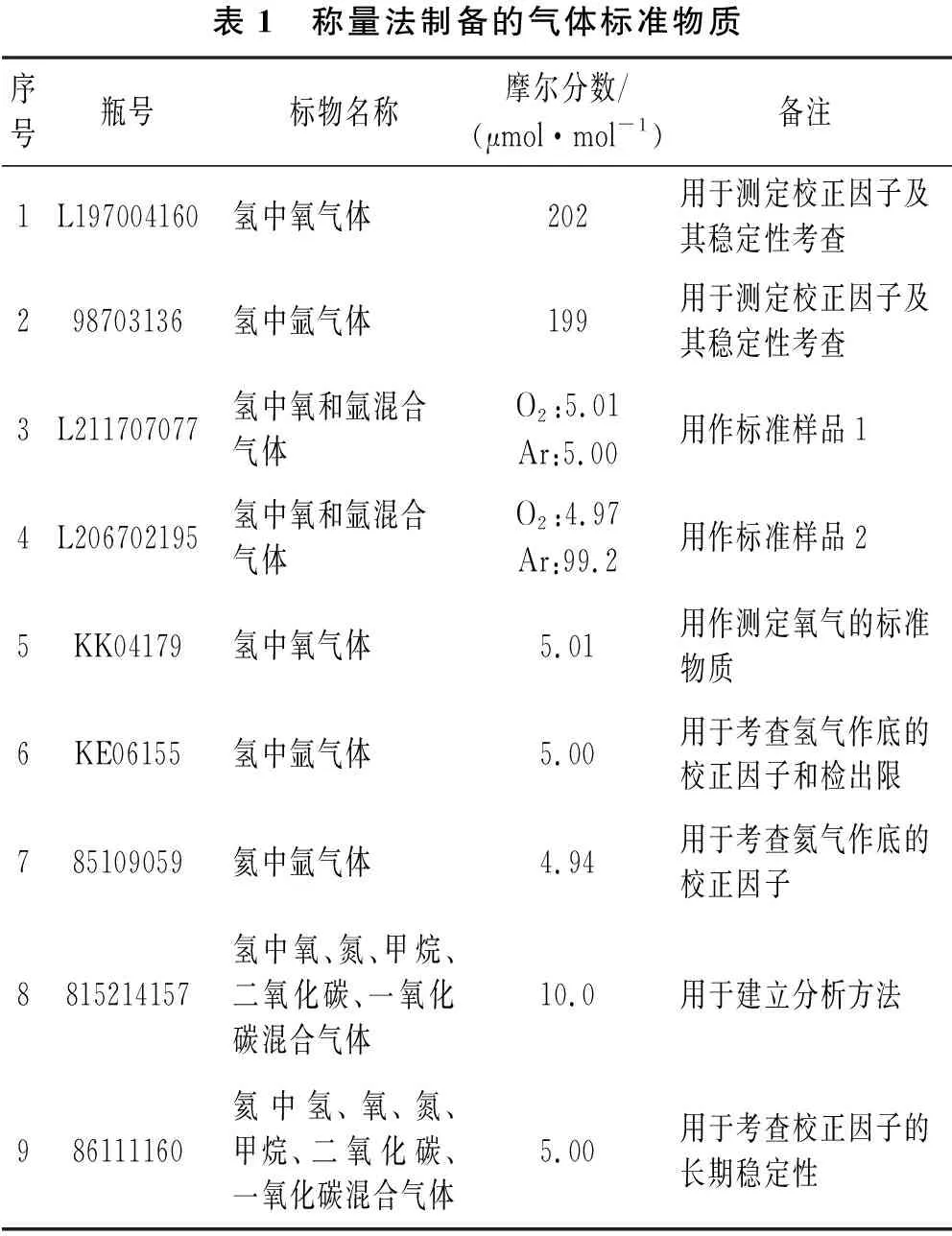
表1 称量法制备的气体标准物质序号瓶号标物名称摩尔分数/(μmol·mol-1)备注1L197004160氢中氧气体202用于测定校正因子及其稳定性考查298703136氢中氩气体199用于测定校正因子及其稳定性考查3L211707077氢中氧和氩混合气体O2:5.01Ar:5.00用作标准样品14L206702195氢中氧和氩混合气体O2:4.97Ar:99.2用作标准样品25KK04179氢中氧气体5.01用作测定氧气的标准物质6KE06155氢中氩气体5.00用于考查氢气作底的校正因子和检出限785109059氦中氩气体4.94用于考查氦气作底的校正因子8815214157氢中氧、氮、甲烷、二氧化碳、一氧化碳混合气体10.0用于建立分析方法986111160氦中氢、氧、氮、甲烷、二氧化碳、一氧化碳混合气体5.00用于考查校正因子的长期稳定性
1.2.2分析方法的建立
氦离子化气相色谱仪实验仪器参数:色谱柱温度60 ℃,检测器温度50 ℃,载气为经过氦气纯化器之后的超高纯氦气,载气流量30 mL/min,放电气流量14.1 mL/min,放电电流7.13 mA,仪器阀动作事件见表2。
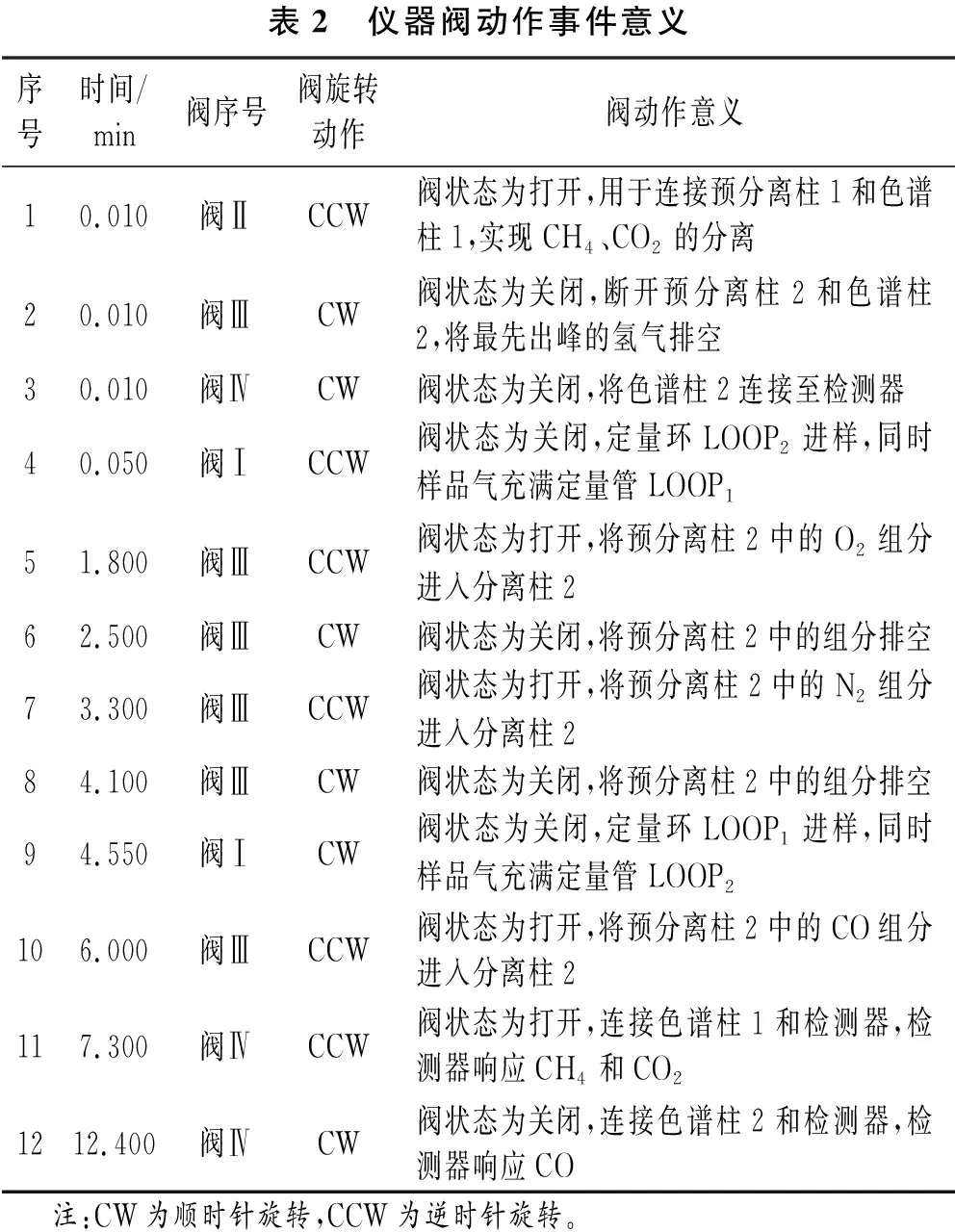
表2 仪器阀动作事件意义序号时间/min阀序号阀旋转动作阀动作意义10.010阀ⅡCCW阀状态为打开,用于连接预分离柱1和色谱柱1,实现CH4、CO2的分离20.010阀ⅢCW阀状态为关闭,断开预分离柱2和色谱柱2,将最先出峰的氢气排空30.010阀ⅣCW阀状态为关闭,将色谱柱2连接至检测器40.050阀ⅠCCW阀状态为关闭,定量环LOOP2进样,同时样品气充满定量管LOOP151.800阀ⅢCCW阀状态为打开,将预分离柱2中的O2组分进入分离柱262.500阀ⅢCW阀状态为关闭,将预分离柱2中的组分排空73.300阀ⅢCCW阀状态为打开,将预分离柱2中的N2组分进入分离柱284.100阀ⅢCW阀状态为关闭,将预分离柱2中的组分排空94.550阀ⅠCW阀状态为关闭,定量环LOOP1进样,同时样品气充满定量管LOOP2106.000阀ⅢCCW阀状态为打开,将预分离柱2中的CO组分进入分离柱2117.300阀ⅣCCW阀状态为打开,连接色谱柱1和检测器,检测器响应CH4和CO21212.400阀ⅣCW阀状态为关闭,连接色谱柱2和检测器,检测器响应CO 注:CW为顺时针旋转,CCW为逆时针旋转。
经过色谱柱温度和切阀时间的优化,建立分析方法。得到氢中氧、氮、甲烷、二氧化碳、一氧化碳混合气体标准物质(瓶号:815214157)在氦离子化气相色谱仪上标准色谱图,如图3所示。
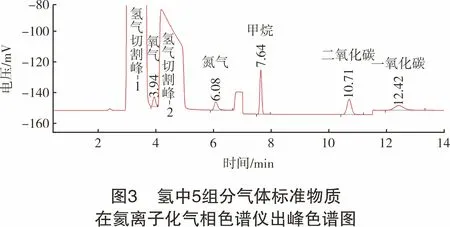
2 结果与讨论
2.1 方法原理
根据定量分析的基本原理,在限定条件下,采用气相色谱法检测响应值与被测组分的量成正比关系[15],即在色谱分析中,某些条件限定后,色谱峰的峰高或峰面积(检测器的响应值)与所测组分的含量成正比。
氦离子化气相色谱法定量分析同样地依据待测组分的含量与其峰面积成正比关系。峰面积大小不仅与组分含量有关,还与组分性质和检测器响应性能有关。同一检测器检测同一种组分时,组分含量越大,峰面积越大。但对于不同组分,检测器响应值不同,对应的峰面积也会不同。因此,需计算定量校正因子来对不同组分的峰面积进行校正。
校正因子是指单位峰面积或单位峰高所代表的组分的量,本研究以峰面积来表示,如式(1)所示:
fi=ci/Ai
(1)
式中:fi为组分i的校正因子;ci为组分i的含量;Ai为组分i的峰面积。
本方法基于以上基本原理,围绕氧、氩难以分别测定的问题,在微量氧分析仪测定氧杂质含量的基础上,引入校正因子计算获得氩杂质含量。具体步骤如下。
(1) 通过氦离子化气相色谱仪分别测定氢中氧气体标准物质和氢中氩气体标准物质,依据式(1)分别计算获得氧气校正因子f氧和氩气校正因子f氩。
(2) 采用微量氧分析仪测定氢气中氧气杂质的摩尔分数c氧,根据式(2)计算得到氧气的理论响应峰面积A氧。
A氧=c氧/f氧
(2)
(3) 通过氦离子化气相色谱仪测定氢气实际样品中氧气和氩气的峰面积响应值的总和为A总,根据式(3)计算得到氩气的峰面积响应值A氩。
A氩=A总-A氧
(3)
(4) 根据式(4)计算氢气中氩气的摩尔分数c氩。
c氩=A氩×f氩
(4)
2.2 校正因子测定
由于校正因子fi受仪器配置或参数设置条件的影响比较大,一般不直接引用文献值,可在实际操作条件下采用标准物质进行测定[16]。如第2.1节中步骤(1)所示,具体实验如下。
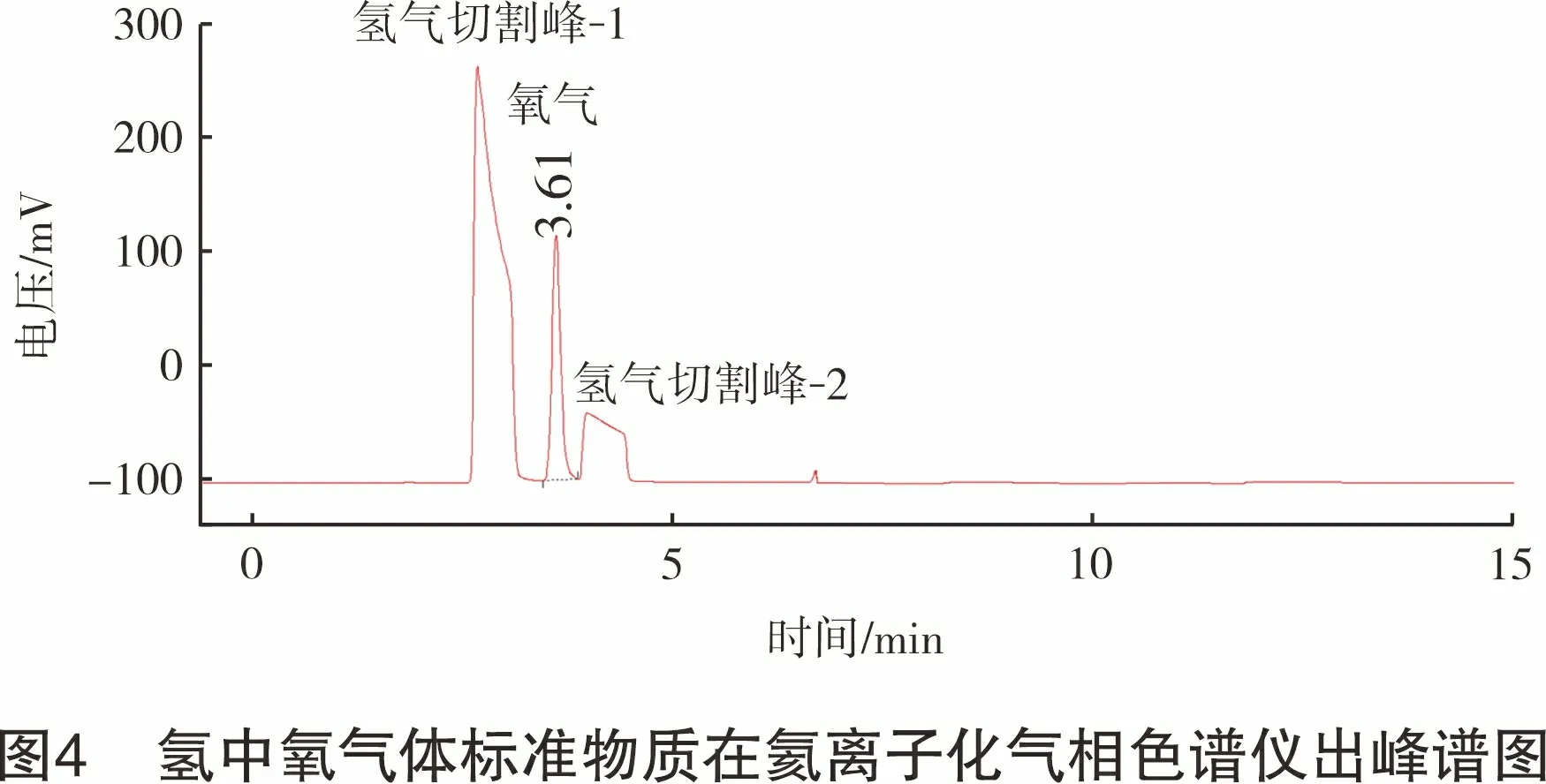
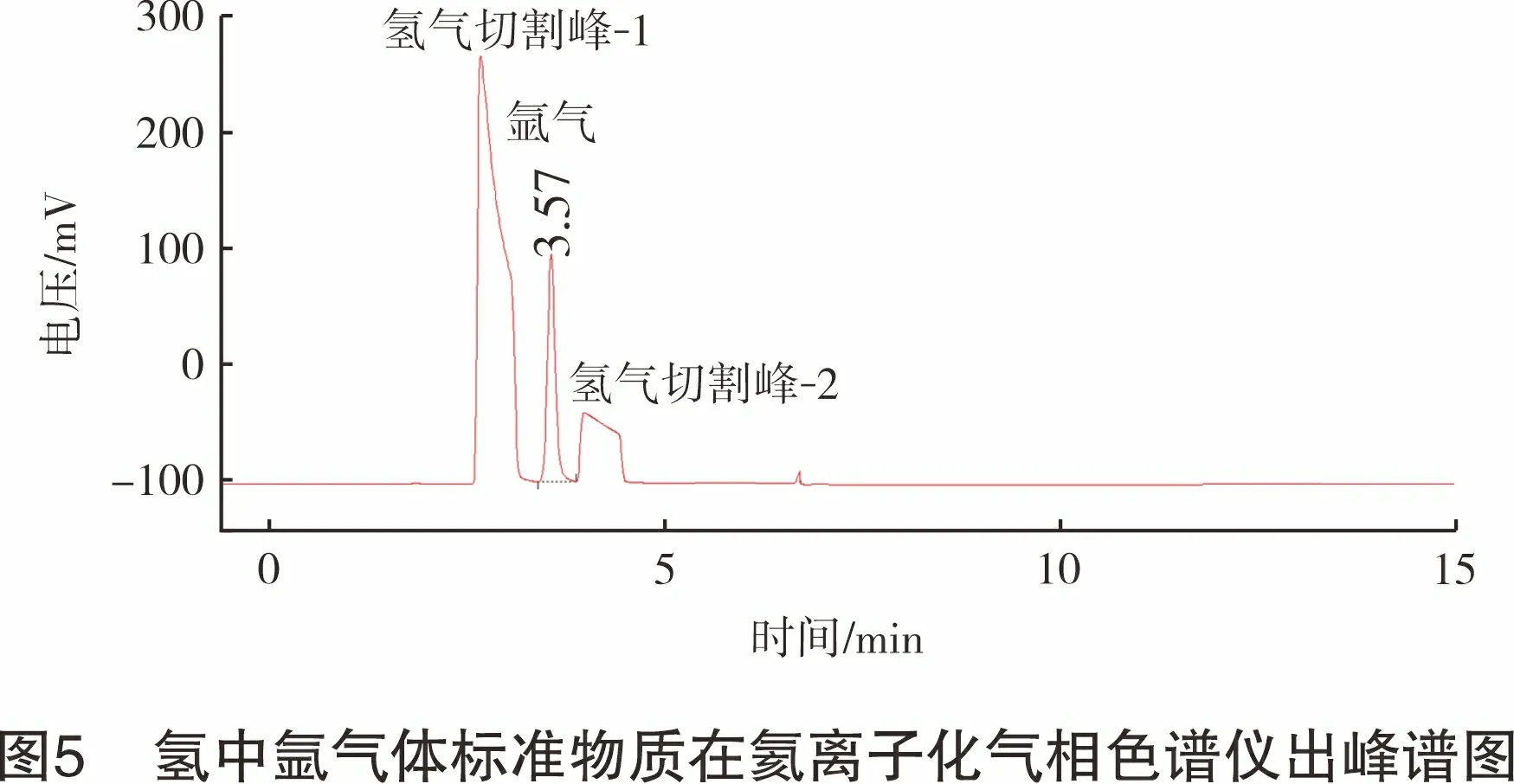
采用称量法分别制备c氧为200 μmol/mol(瓶号:L197004160,实际制备值为202 μmol/mol)的氢中氧气体标准物质和c氩为200 μmol/mol(瓶号:98703136,实际制备值为199 μmol/mol)的氢中氩气体标准物质。分别将氢中氧气体标准物质和氢中氩气体标准物质通入氦离子化气相色谱仪,各测定3次取平均值,按照式(1)分别计算校正因子,f氧和f氩测定实验数据如表3所列。氢气中氧气体标准物质在氦离子化气相色谱仪出峰如图4所示,氢中氩气体标准物质在氦离子化气相色谱仪出峰如图5所示。
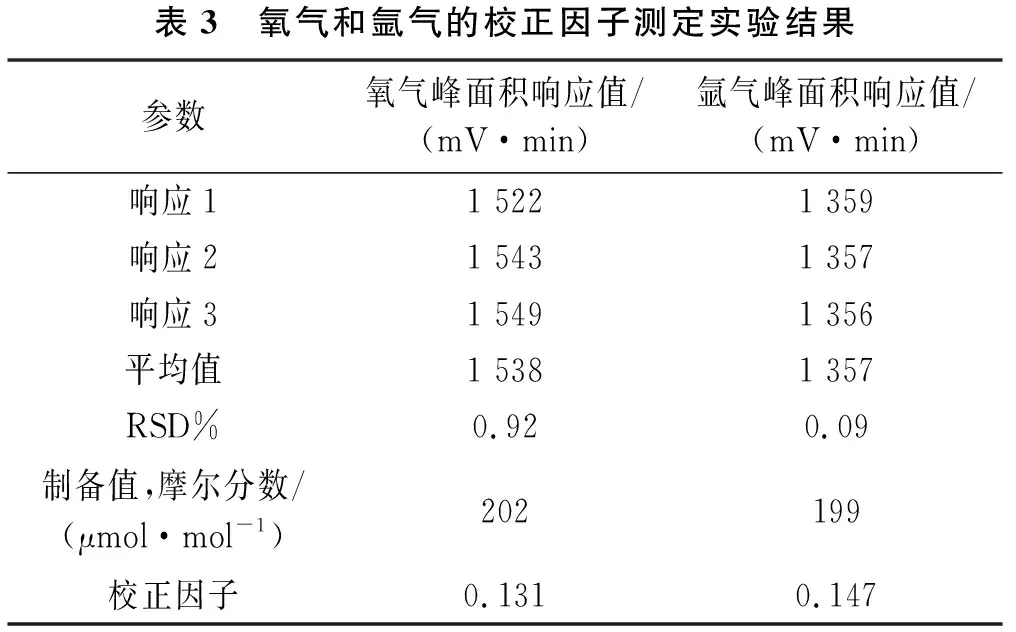
表3 氧气和氩气的校正因子测定实验结果参数氧气峰面积响应值/(mV·min)氩气峰面积响应值/(mV·min)响应11 5221 359响应21 5431 357响应31 5491 356平均值1 5381 357RSD%0.920.09制备值,摩尔分数/(μmol·mol-1)202199校正因子0.1310.147
2.3 样品测试
2.3.1微量氧分析仪法测定氧杂质含量
实验中采用氢气中氧和氩混合气体标准物质作为标准样品(瓶号:L211707077)来验证该方法的可行性。标准样品中氧气摩尔分数为5.01 μmol/mol,氩气摩尔分数为5.00 μmol/mol。采用微量氧分析仪测定c氧,并根据式(2)计算获得A氧。
将标准样品通入经校准过的微量氧分析仪,待设备读数稳定,每间隔2 min记录一次读数,求3次测量的平均值,然后经计算获得A氧(见表4)。
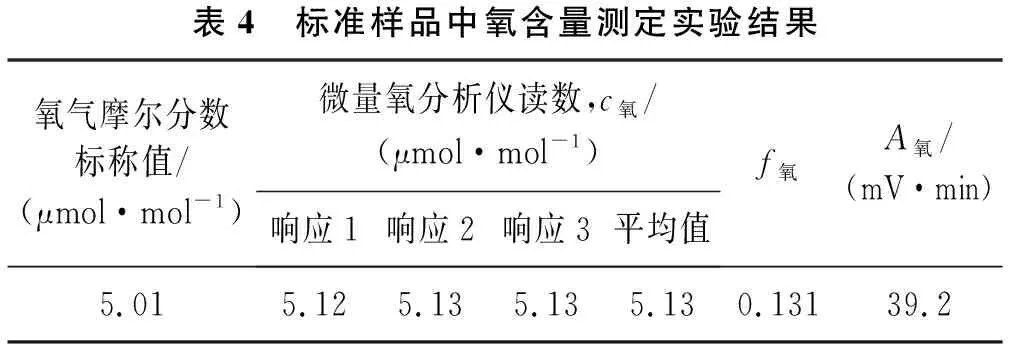
表4 标准样品中氧含量测定实验结果氧气摩尔分数标称值/(μmol·mol-1)微量氧分析仪读数,c氧/(μmol·mol-1)响应1响应2响应3平均值f氧A氧/(mV·min)5.015.125.135.135.130.13139.2
2.3.2校正因子法测定氩杂质含量
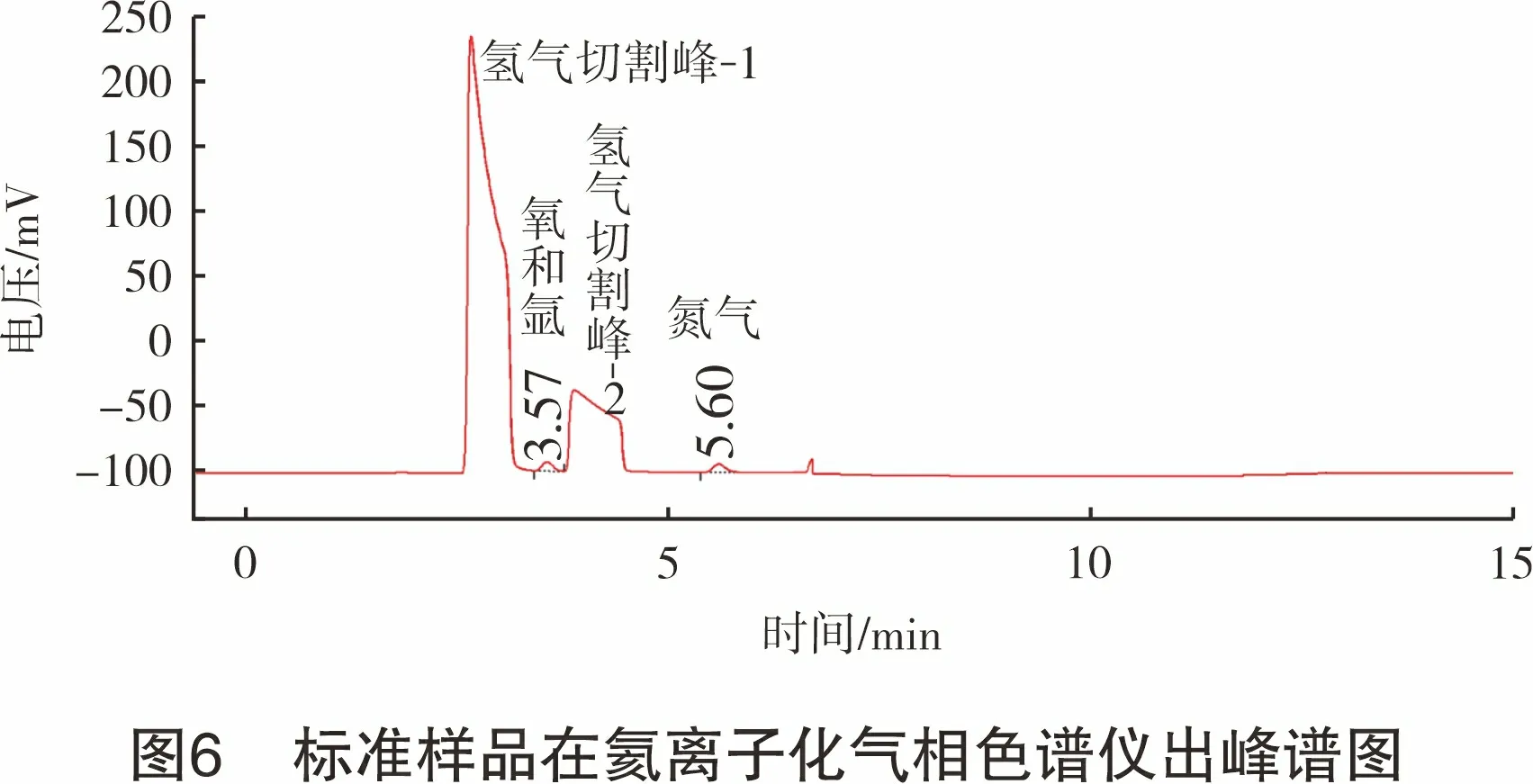
按照第2.1节中的步骤,将标准样品通入氦离子化气相色谱仪,根据式(3)、式(4)计算测定标准样品的峰面积响应值的总和A总,标准样品出峰见图6,实验结果测定如表5所列。

表5 标准样品中氩杂质测定实验结果名称A总/(mV·min)响应1响应2响应3平均值相对标准偏差/%A氧/(mV·min)A氩/(mV·min)c氩/(μmol·mol-1)标准样品71.471.872.171.80.539.232.64.79
2.4 结果分析与讨论
2.4.1校正因子长期稳定性考查
校正因子理论上与分析仪器本身配置及参数设置条件有关,是仪器的固有性质,在一定时间内不会发生变化,为建立长期可用的校正因子分析方法,针对该性质开展了氦离子化气相色谱仪响应值在不同时间段内和不同底气下的考查研究。在保证复现性良好的前提下,分别开展了以下3个试验。
2.4.1.1 试验1
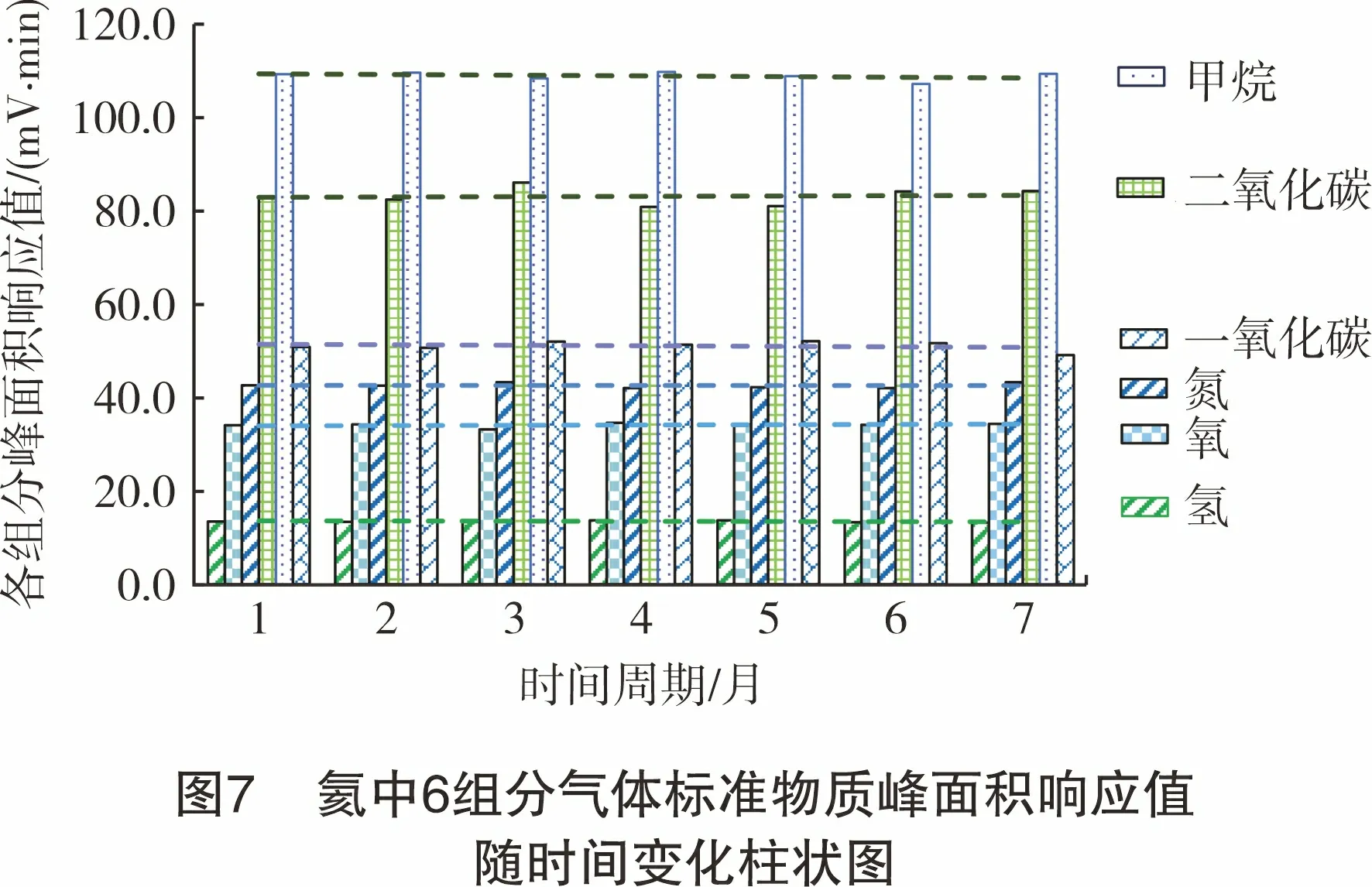
采用氦中氢、氧、氮、二氧化碳、甲烷和一氧化碳气体标准物质(瓶号:86111160)作为标准样品,在同一试验条件下,分别从2021年3月-2021年9月对氦气中各组分的校正因子进行长期稳定性的考查。
对数据使用柱状图进行分析(见图7),可以看出各参数在气相色谱上峰面积响应值随时间的变化。从图7可以看出,各参数随时间变化较小,相对标准偏差均小于3%,表明各参数校正因子在一定时间内相对稳定。
2.4.1.2 试验2
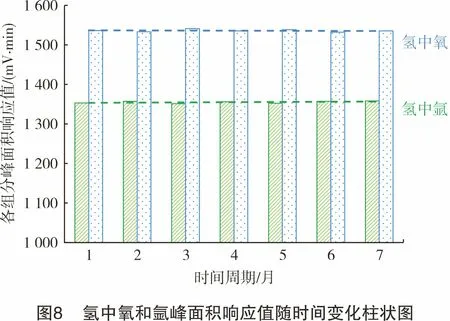
采用氢中氧气体标准物质(瓶号:L197004160)和氢中氩气体标准物质(瓶号:98703136)作为标准样品,在同一试验条件下,分别从2021年3月-2021年9月对氢气中各氧和氩的校正因子进行长期稳定性的考查。
对数据使用柱状图进行分析(见图8),可以看出氧和氩在气相色谱上响应值随时间的变化。从图8中可以看出,氧和氩响应值随时间变化较小,相对标准偏差均小于3%,二者校正因子在一定时间内相对稳定。
2.4.1.3 试验3
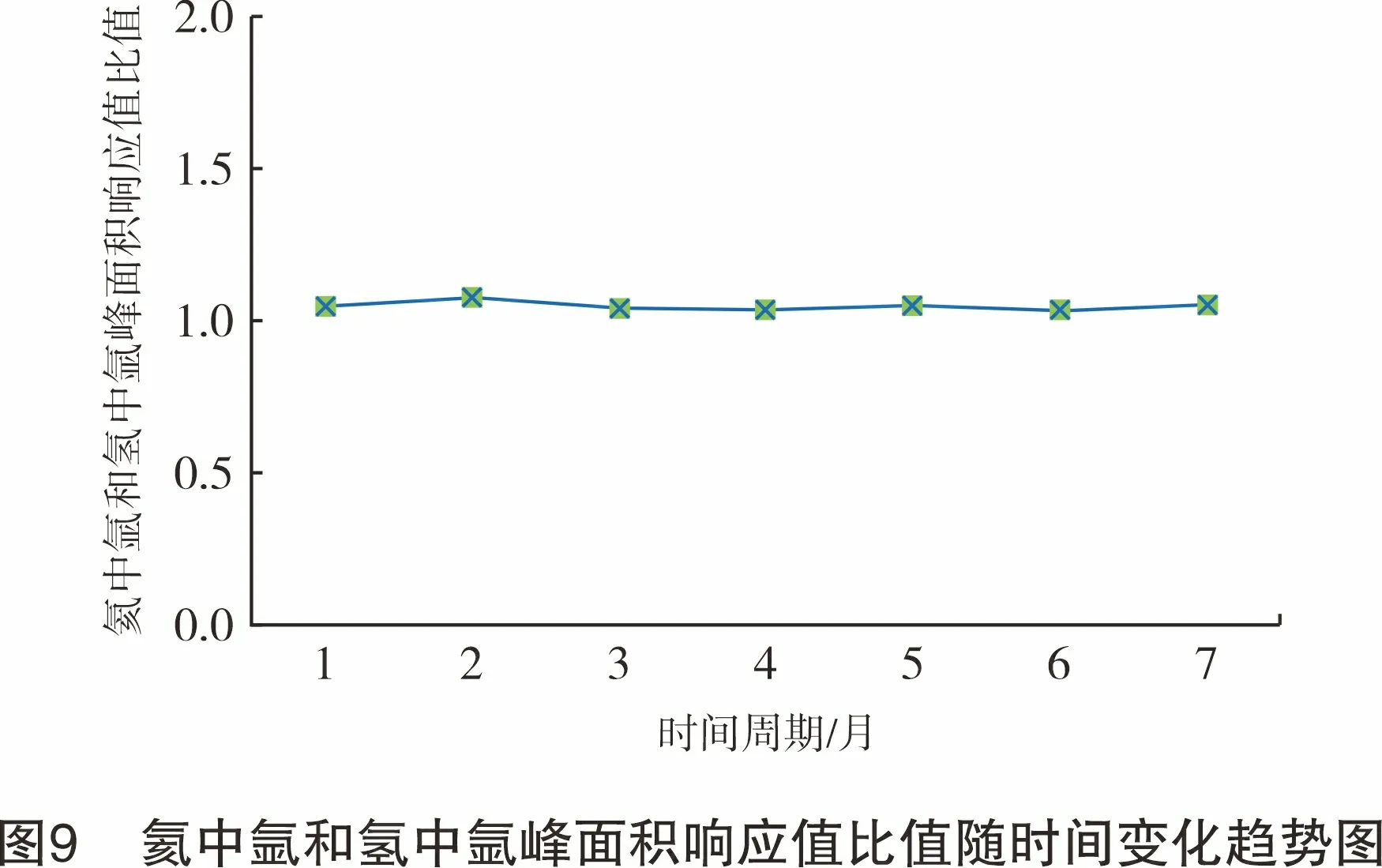
采用氦中氩气体标准物质(瓶号:85109059)和氢中氩气体标准物质(瓶号:KE06155)作为标准样品,在同一试验条件下,分别从2021年3月-2021年9月对氦中氩和氢中氩的校正因子进行长期稳定性的考查。结果显示无论底气是氦气还是氢气,氩在氦离子化气相色谱仪上的响应几乎一致,无显著性差别,其变化趋势见图9。
2.4.2方法检出限
以3倍基线噪声的响应值作为本分析方法测定氩的检测限,测量检出限时应选用摩尔分数尽可能低的标准物质作为测试样品[17],被选用的标准物质为5.00 μmol/mol氢中氩气体标准物质(瓶号:KE06155),计算公式如式(5)所示,计算结果见表6。
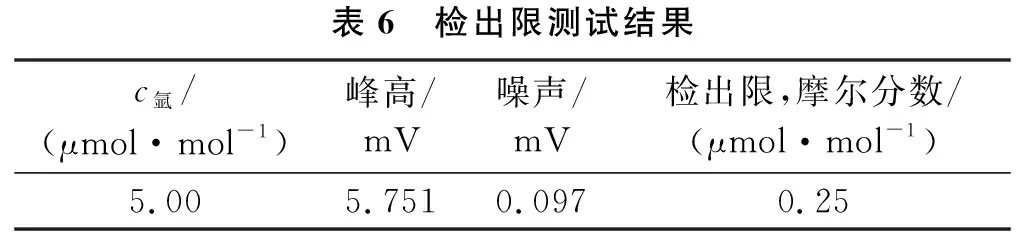
表6 检出限测试结果c氩/(μmol·mol-1)峰高/mV噪声/mV检出限,摩尔分数/(μmol·mol-1)5.005.7510.0970.25
D=3Nc/h
(5)
式中:D为方法的检出限,μmol/mol;N为基线噪声,mV;c为被测样品摩尔分数,μmol/mol;h为峰高,mV。
2.4.3方法验证及方法准确性
为验证本方法的准确性及可行性,分别对两个不同含量的标准样品(瓶号:L211707077和L206702195)进行测定,测定结果见表7,该方法测定结果与理论标称值相对误差均小于预期相对误差5%的测量要求,证明该分析方法具有可行性,且分析结果准确、可靠。
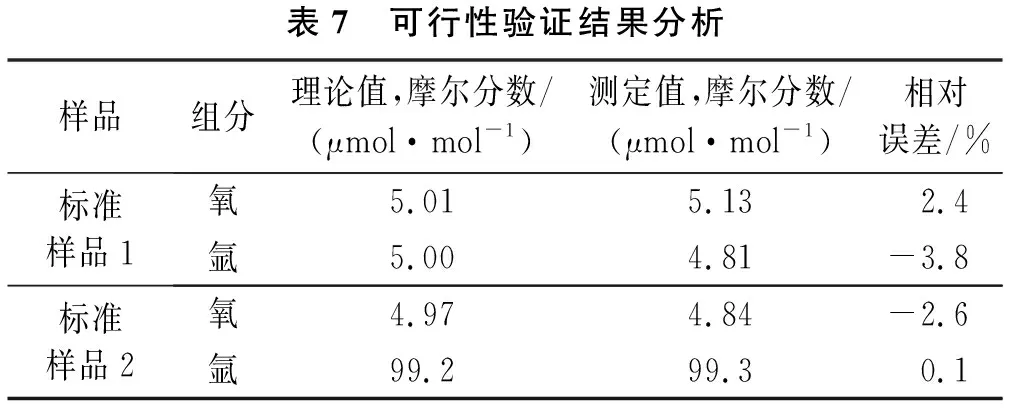
表7 可行性验证结果分析样品组分理论值,摩尔分数/(μmol·mol-1)测定值,摩尔分数/(μmol·mol-1)相对误差/%标准样品1氧5.015.132.4氩5.004.81-3.8标准样品2氧4.974.84-2.6氩99.299.30.1
为验证方法的准确性,将本方法与脱氧柱法测定氩气的分析方法进行比较。脱氧柱法是指采用一根可以脱除氧气的U型填充柱或脱氧设备,将样品中的氧气全部吸附脱除,仅对氢气中氩进行测定。试验中采用两种分析方法分别对同一实际氢气样品(样品为客户送样)进行测定,比较两种分析方法的测量结果(见表8)。结果表明,二者不存在显著性差异。

表8 实际氢气样品中氩气含量测量结果实际样品组分脱氧柱法,摩尔分数/(μmol·mol-1)本方法,摩尔分数/(μmol·mol-1)两种方法相对误差/%氢气样品氩2.212.15-2.71
3 结论
随着我国氢能产业的不断发展以及对氢气品质要求的不断提升,如何准确测定氢气中微量氩杂质变得尤为重要。本研究提出了一种依据色谱校正因子这一基本原理测定微量氩杂质的分析方法,弥补了GB/T 37244-2018《质子交换膜燃料电池汽车用燃料 氢气》中未给出准确测定氩杂质方法的不足。
方法通过引入校正因子,建立了氩杂质气体含量与峰面积响应值的函数关系,在氧气含量可测定的情况下,通过计算即可得到氩气含量。试验结果表明,氧、氩校正因子相对稳定,可长期使用,可极大地简化分析步骤,解决了在氧、氩不分离的情况下,准确测定氢气中氩杂质含量的技术难题,同时丰富了校正因子在气相色谱中的理论及应用。经过比较标准样品的测定结果与标称值,以及将本方法与现有脱氧柱分析方法相对比,结果表明本方法可操作性强、具有较高的准确性。本方法适用于氢气样品中氩杂质的定性和定量分析,在氢气质量检测中具有较好的应用前景。

