青光安Ⅱ号方有效组分对慢性高眼压DBA/2J 小鼠视网膜神经节细胞的保护作用及机制
曾志成,李银鑫,秦惠钰,蒋鹏飞,彭 俊*,彭清华*
(1.湖南中医药大学,湖南 长沙 410208;2.湖南桂阳县第一人民医院,湖南 郴州 424400;3.湖南中医药大学第一附属医院,湖南 长沙 410007)
青光眼是一组以视网膜神经节细胞(retinal ganglion cells, RGCs)进行性凋亡及视神经纤维的丢失为特征的神经退行性疾病[1]。 目前,对于青光眼的治疗以降低眼压为主,但即使控制眼压仍不能完全阻止青光眼患者视神经的持续性损伤和退行性改变[2]。 本团队前期研究发现,青光安Ⅱ号方对眼压已控制的青光眼患者的视神经能起到一定的保护作用[3],并通过高通量筛选体系多模式(水提醇提-溶剂分配分离-大孔树脂) 提取分离手段得到了青光安Ⅱ号方的有效组分[4]。 为明确青光安Ⅱ号方有效组分对青光眼视神经的保护作用及机制,本研究将青光安Ⅱ号方有效组分配制成低、中、高3 种梯度剂量作用于青光眼模型DBA/2J 小鼠,以验证其是否具有抑制RGCs 凋亡、保护视神经的作用,同时对其保护视神经的机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物 60 只10 周龄SPF 级DBA/2J 小鼠,雌性,体质量18~22 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号:SCXK(京)2016-0006,质量合格证号:No.1100111911055898;20 只10 周龄SPF 级野生型C57BL/6J 小鼠,雌性,体质量18~22 g,由湖南斯莱克景达实验动物有限公司提供,实验动物许可证号:SCXK(湘)2016-0002,质量合格证号:1107271911002463。动物饲养于湖南中医药大学科技创新中心实验动物中心屏障环境实验室,实验动物使用许可证号:SCXK(湘):2019-0009,饲养过程维持相同实验条件,光/暗周期为12 h/12 h(光照时间6:00~18:00),背景噪声为(40±10) db,温度(23±3) ℃,动物饲料为标准化颗粒饲料,动物自由进食、进水。 动物饲养和实验操作遵循美国视觉和眼科研究学会(Association for Reearch in Vision and Ophthalmology, ARVO)和湖南中医药大学制定的科研动物和实验室使用规范。实验经湖南中医药大学动物实验伦理委员会批准(LL2019100802)。
1.1.2 实验药物 青光安Ⅱ号汤剂由枸杞子、黄芪、女贞子等道地药材按规定比例用灭菌蒸馏水制成悬混液;基于团队前期中药高通量筛选体系[5-6]对青光安Ⅱ号方中药组分库的筛选,提取出青光安Ⅱ号方有效组分悬混液。 益脉康分散片:湖南湘雅制药有限公司,规格:400 mg/片,批号:1903119。
1.1.3 主要实验试剂 苏木素染液(批号:G1004)、伊红染液(批号:G1001)、Proteinase K(批号:G1234)、柠檬酸抗原修复液(批号:G1202)、丽春红染液(批号:G2011)、HRP 标记-山羊抗兔二抗(批号:GB23301)、BCA 蛋白定量检测试剂盒(批号:G2026),均购自武汉赛维尔生物科技有限公司;兔抗糖原合酶激酶-3β(Glycogen synthase kinase-3β, GSK-3β)多克隆抗体(批号:bs-0023M)、兔抗β-连环蛋白(β-Catenin)多克隆抗体(批号:bs-1165R)、兔抗同源盒基因-6(Paired box gene-6, Pax6)多克隆抗体(批号:bs-11204R)、兔抗β-Actin 多克隆抗体(批号:bs-0016R),均购自北京博奥森生物技术有限公司。
1.1.4 主要实验仪器 Tono-pen AVIA 型笔式眼压计(美国Reichert 公司);SL-2G 型裂隙灯显微镜(日本Topcon 公司);Micron Ⅳ型小动物视网膜影像系统(美国Phoenix Research Labs 公司);SK3300H 型超声波清洗器(上海科导超声仪器有限公司);RM2235 型石蜡轮转切片机(德国Leica 公司);RT-2100C 型酶标检测仪(深圳雷杜生命科学股份有限公司);Neofuge 13R 型台式高速冷冻离心机(香港力康生物医疗科技控股有限公司);MX-F 型涡旋混合器、TSY-B 型脱色摇床(武汉赛维尔生物科技有限公司);DYCZ-24DN 型双垂直电泳仪、DYCZ-40D 型转印电泳仪(北京六一生物科技有限公司);alphaEaseFC 灰度分析软件(美国Alpha Innotech 公司);Adobe PhotoShop 图像分析软件 (美国Adobe公司)。
1.2 方法
1.2.1 眼压测量 所有动物适应性饲养3 d 后开始测量眼压,在小鼠清醒状态下由两人配合使用Tonopen AVIA 接触式眼压笔每4 周测量1 次,测量时间为早上9:00 至12:00。 取连续10 次测量的平均值(且LCD 上显示置信指标≥95)作为该眼眼压值。
1.2.2 实验分组与给药 DBA/2J 小鼠从28 周龄开始眼压逐渐升高,28~44 周龄持续高眼压,56 周龄眼压开始降低[7],本实验将38 周龄的DBA/2J 小鼠初步纳入慢性高眼压青光眼模型组,由于DBA/2J小鼠高眼压在个体中存在一定差异,在同年龄段不同小鼠、同小鼠不同眼别眼压升高进程不平衡[8],根据DBA/2J 小鼠38 周龄时平均眼压和标准差,剔除眼压值平均值在±3 mmHg 范围以外的DBA/2J小鼠。
第38 周龄时,从C57BL/6J 小鼠中随机选取8只(30 眼)纳入组成正常对照组(A 组);在剔除后剩余的DBA/2J 小鼠中选取48 只(180 眼),按照随机数字表法平均分为青光眼模型组(B 组)、益脉康分散片组(C 组)、青光安Ⅱ号方汤剂组(D 组)、青光安Ⅱ号方有效组分低剂量组(E 组)、青光安Ⅱ号方有效组分中剂量组(F 组)、青光安Ⅱ号方有效组分高剂量组(G 组)。药物均用蒸馏水作为溶剂进行配制,各组小鼠给药药物配制浓度、给药剂量见表1。
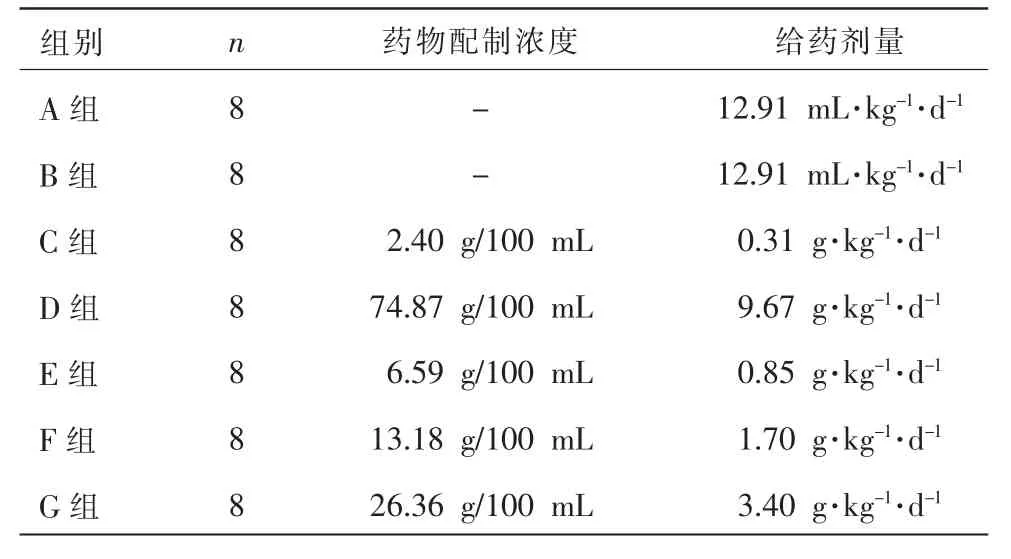
表1 各组小鼠给药药物配制浓度及给药剂量
1.2.3 取材方法 灌胃4 周后,各组小鼠行颈椎脱臼处死,仔细剥离小鼠眼球,一只置于装有2.5 mL FAS 眼球固定液的EP 管中,固定25 min 后,取出眼球,沿角巩膜缘剪开,除去角膜、虹膜、晶状体,制作成含视网膜的眼杯,放入FAS 眼球固定液中继续固定48 h,石蜡包埋切片,备行HE 染色、TUNEL 染色、免疫组化染色。 另一只眼球置于冰盘上,用眼科显微器械沿角巩膜缘剪开,除去角膜、虹膜、晶状体,迅速剥离出视网膜组织,置入EP 管中,再放入液氮罐中保存,备行Western blot 检测。
1.2.4 视网膜石蜡切片标本制作 采用80%乙醇、95%乙醇Ⅰ、95%乙醇Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ、无水乙醇Ⅲ分别脱水10~15 min;二甲苯Ⅰ、二甲苯Ⅱ透明10~15 min;56 ℃石蜡浸蜡1 h。浸蜡后的眼杯水平切面朝向包埋盒底,58~60 ℃硬蜡包埋,蜡块冷却后,室温保存待切;用轮转式切片机切片,靠近视乳头的位置开始切片,厚约4 μm,每个眼杯至少切取3 张切片包含有视网膜,40~46 ℃水浴,放在水上展平切片;把切片置于载物片的三分之一处,捞于载物片中央,晾干,放在切片盒内,置于4 ℃冰箱备用。
1.2.5 视网膜HE 染色 取出各组小鼠视网膜组织切片,每张视网膜选取一张切片,400 倍镜下拍照。
1.2.6 视网膜RGCs 凋亡检测 取出各组小鼠视网膜石蜡切片,每张视网膜选取一张切片,根据TUNEL细胞凋亡检测试剂盒说明书的操作步骤进行。 细胞核固缩、胞浆浓缩,细胞核呈棕褐色为阳性细胞,每张切片随机选取1 个视野(×400)拍照,计数视野中阳性着色RGCs 数目,计算出RGCs 细胞的凋亡指数(凋亡指数=阳性细胞数/RGCs 总细胞数×100%),取平均值。
1.2.7 视网膜GSK-3β、β-Catenin 及Pax6 蛋白表达半定量检测 取出各组小鼠视网膜石蜡切片,每张视网膜选取3 张切片,每张切片用于检测1 个蛋白,根据通用二步法试剂盒中说明书操作步骤进行。胞浆、细胞核及细胞膜之一出现棕黄色或棕褐色颗粒为阳性细胞,每张切片随机选取1 个视野(×400)拍照。 重点观察每张切片上神经节细胞层细胞染色情况。
1.2.8 视网膜GSK-3β、β-Catenin、Pax6 蛋白表达定量检测 取出各组小鼠视网膜组织,每组每2 张视网膜组织为1 个样本,共检测4 个样本。 步骤如下:(1)将每个视网膜组织匀浆、裂解,后转移至离心管中,移至台式高速冷冻离心机中,4 ℃、12 000 r/min离心5 min(半径95 mm),离心后取上清并转移至1.5 mL 新的离心管中,保存于-20 ℃备用。 (2)蛋白浓度测定:用BCA 蛋白浓度测定试剂盒测蛋白浓度。(3)制备Western blot 实验用蛋白样品。(4)SDSPAGE 电泳。(5)转膜。(6)染色、封闭。(7)孵育一抗:先用封闭液稀释各指标一抗(兔抗-GSK3β、兔抗-β/Catenin、兔抗-Pax6 及兔抗β-Actin 多克隆抗体,均按照1∶1000 稀释),然后弃去封闭袋中的封闭液,加入稀释的一抗,置于4 ℃冰箱中孵育过夜。 (8)孵育二抗。 (9)将条带放在保鲜膜上,设定曝光时间进行曝光、拍照。采用AlphaEaseFC 软件分析系统进行灰度值分析各目标蛋白的灰度值,以β-Actin 蛋白灰度值作为内参,二者比值即为灰度值,表示蛋白表达量。
1.3 统计学方法
2 结果
2.1 C57BL/6J 小鼠与DBA/2J 小鼠眼压
20 只(40 眼)C57BL/6J 小鼠在10~38 周龄眼压一直波动在10~16 mmHg。 100 只(200 眼)DBA/2J小鼠在10 周龄和34 周龄测量眼压时,分别有1 只小鼠死亡,死亡小鼠当周双眼眼压数据即开始不纳入统计范围内。DBA/2J 小鼠眼压在10~22 周龄之间逐渐上升。 详见图1。
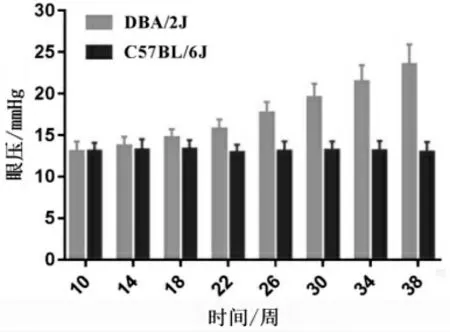
图1 C57BL/6J 小鼠和DBA/2J 小鼠10~38 周龄不同时相点眼压
2.2 各组小鼠视网膜形态结构
A 组小鼠视网膜各层结构清晰、完整、染色均匀,清晰可见3 个核层,由内向外依次为GCL、内核层(inner nuclear layer, INL)以及外核层(outer nuclear layer, ONL);神经节细胞呈单层排列,比较连续无间断,细胞大小不一,呈圆形或椭圆形,INL 及ONL细胞呈多层分布,内丛状层(inner plexiform layer, IPL)位于GCL 与INL 之间,外丛状层(outer plexiform layer,OPL)位于INL 与ONL 之间。 B 组以GCL 损伤最为明显,神经节细胞明显减少,连续性中断,胞内空泡样变性,核固缩。 C 组、D 组、E 组、F 组、G 组神经节细胞数目增多,胞内空泡样变性改变均有所改善,以C 组、D 组、F 组、G 组较为明显。 详见图2。

图2 各组小鼠视网膜组织结构(HE,×400)
2.3 各组小鼠视网膜RGCs 凋亡情况
A 组小鼠视网膜呈现核固缩的细胞较少;B 组在GCL、INL 及ONL 层均可见大量核固缩细胞,TUNEL 染色呈现棕褐色且为深染,视网膜厚度明显变薄;C 组、D 组、F 组、G 组核固缩和TUNEL 阳性细胞数目减少,且为浅染。 详见图3。
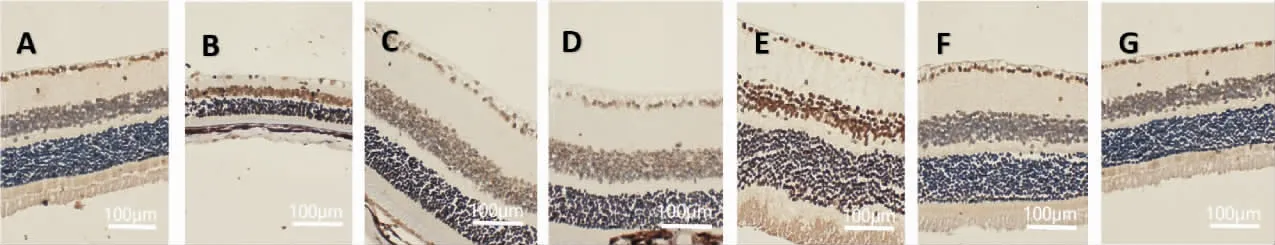
图3 各组小鼠视网膜神经节细胞层RGCs 凋亡情况(Tunel,×400)
与A 组比较,B 组凋亡指数明显升高(P<0.01);与B 组比较,C 组、D 组、E 组、F 组、G 组凋亡指数均明显降低(P<0.01);与C 组或D 组比较,E 组凋亡指数升高(P<0.05 或P<0.01),G 组凋亡指数明显降低(P<0.01)。 详见图4。
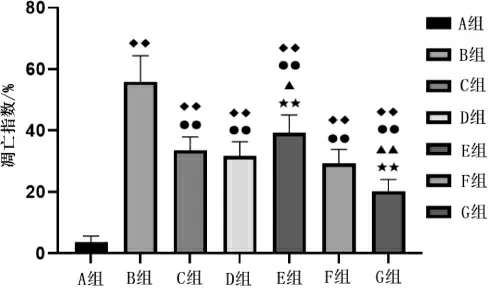
图4 各组视网膜神经节细胞层凋亡指数比较
2.4 各组小鼠视网膜GSK-3β、β-Catenin 及Pax6免疫组化染色情况
GSK-3β、β-Catenin 和Pax6 蛋白在小鼠视网膜的表达主要位于神经节细胞层,在内核层也可以见到其少许表达,在神经节细胞层,其表达主要位于细胞质和细胞膜。 与A 组比较,B 组视网膜GSK-3β表达量明显升高(P<0.01),β-Catenin 和Pax6 表达量明显降低(P<0.01);与B 组比较,C 组、D 组、E组、F组、G 组GSK-3β 表达量均明显降低(P<0.01),C 组、D 组、F 组、G 组β-Catenin 表达量均有升高(P<0.05或P<0.01),C 组、D 组、F 组、G 组Pax6 表达量均有升高(P<0.05 或P<0.01);与C 组和D 组比较,G 组GSK-3β 表达量降低(P<0.05),β-Catenin 和Pax6 表达量升高(P<0.01)。 详见图5 至图7、表2。
表2 各组小鼠视网膜GSK-3β、β-Catenin、Pax6 蛋白表达量比较(±s,n=4)
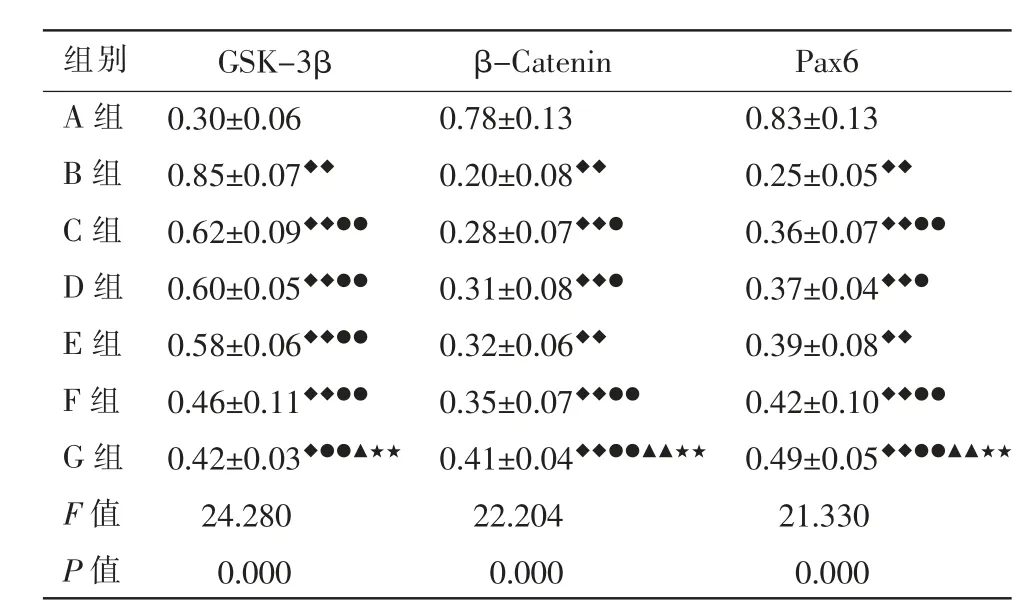
表2 各组小鼠视网膜GSK-3β、β-Catenin、Pax6 蛋白表达量比较(±s,n=4)
注:与A 组比较,◆P<0.05,◆◆P<0.01;与B 组比较,●P<0.05,●●P<0.01;与C 组比较,▲P<0.05,▲▲P<0.01;与D 组比较,★P<0.05,★★P<0.01。
组别A 组B 组C 组D 组E 组F 组G 组F 值P 值GSK-3β 0.30±0.06 0.85±0.07◆◆0.62±0.09◆◆●●0.60±0.05◆◆●●0.58±0.06◆◆●●0.46±0.11◆◆●●0.42±0.03◆●●▲★★24.280 0.000 β-Catenin 0.78±0.13 0.20±0.08◆◆0.28±0.07◆◆●0.31±0.08◆◆●0.32±0.06◆◆0.35±0.07◆◆●●0.41±0.04◆◆●●▲▲★★22.204 0.000 Pax6 0.83±0.13 0.25±0.05◆◆0.36±0.07◆◆●●0.37±0.04◆◆●0.39±0.08◆◆0.42±0.10◆◆●●0.49±0.05◆◆●●▲▲★★21.330 0.000
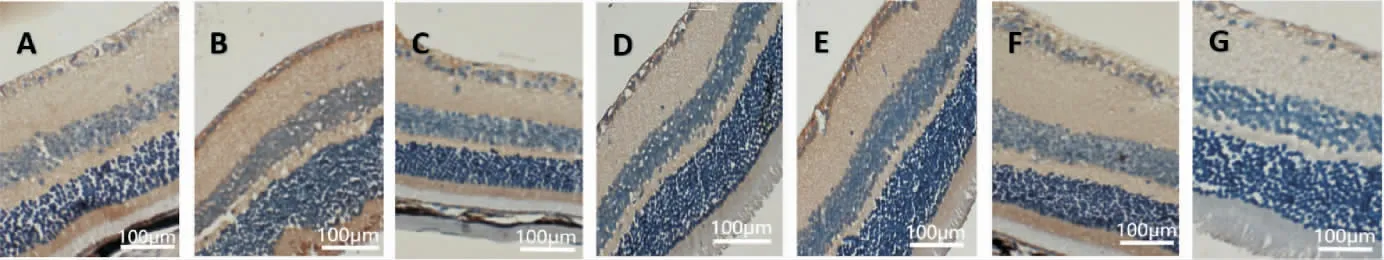
图5 各组视网膜GSK-3β 蛋白表达(免疫组化,×400)
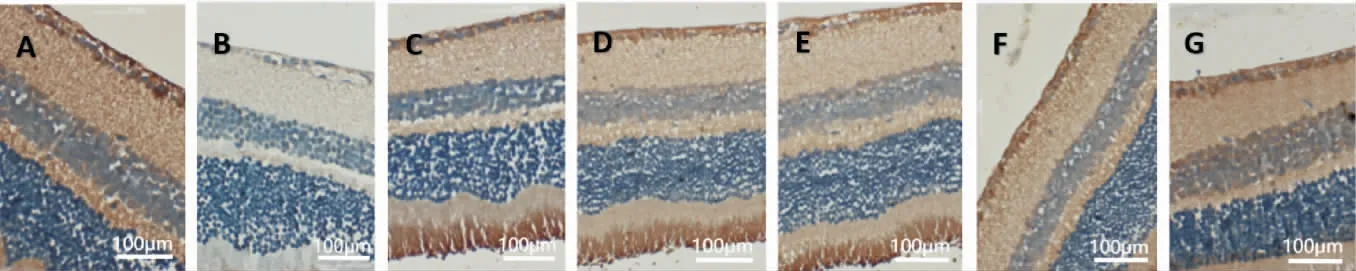
图7 各组视网膜pax6 蛋白表达(免疫组化,×400)
2.5 各组视网膜GSK-3β、β-Catenin、Pax6 蛋白表达量
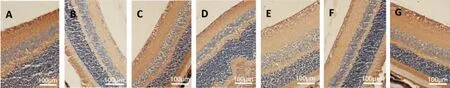
图6 各组视网膜β-Catenin 蛋白表达(免疫组化,×400)
与A 组比较,B 组视网膜GSK-3β 表达量明显升高(P<0.01),β-Catenin 和Pax6 表达量明显降低(P<0.01);与B 组比较,C 组、D 组、E 组、F 组、G 组GSK-3β 表达量均明显降低(P<0.01),C 组、D 组、G 组β-Catenin 表达量均有升高(P<0.05 或P<0.01),C组、D 组、F 组、G 组Pax6 表达量均有升高(P<0.05或P<0.01);与C 组和D 组比较,G 组GSK-3β 表达量降低(P<0.05),β-Catenin 和Pax6 表达量升高(P<0.01)。 详见图8、表3。
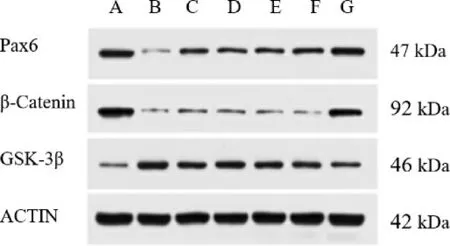
图8 各组视网膜GSK-3β、β-catenin 及Pax6 蛋白电泳图
表3 各组小鼠视网膜GSK-3β、β-Catenin、Pax6 蛋白表达量比较(±s,n=4)
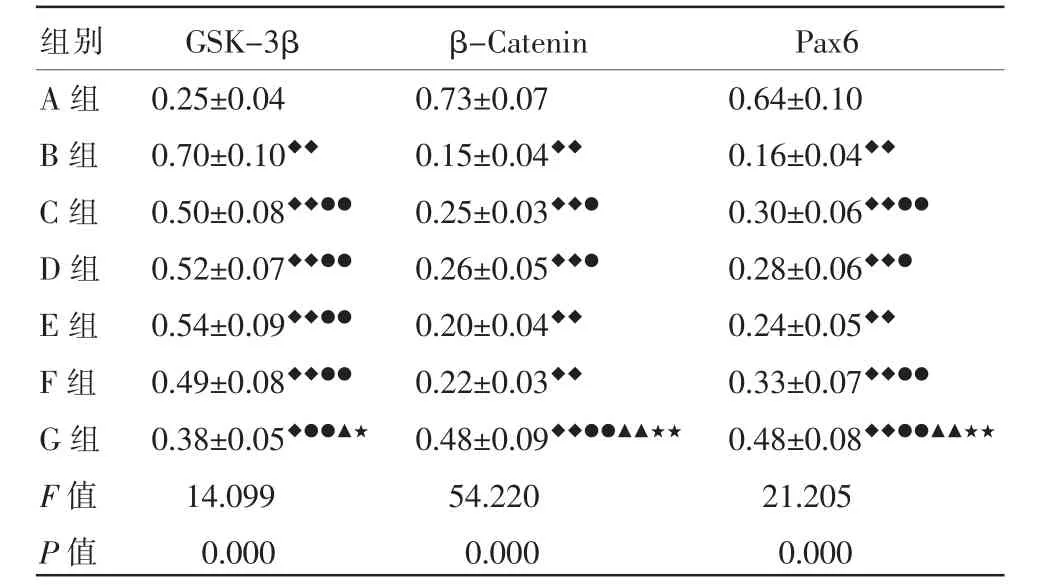
表3 各组小鼠视网膜GSK-3β、β-Catenin、Pax6 蛋白表达量比较(±s,n=4)
注:与A 组比较,◆P<0.05,◆◆P<0.01;与B 组比较,●P<0.05,●●P<0.01;与C 组比较,▲P<0.05,▲▲P<0.01;与D 组比较,★P<0.05,★★P<0.01。
组别A 组B 组C 组D 组E 组F 组G 组F 值P 值GSK-3β 0.25±0.04 0.70±0.10◆◆0.50±0.08◆◆●●0.52±0.07◆◆●●0.54±0.09◆◆●●0.49±0.08◆◆●●0.38±0.05◆●●▲★14.099 0.000 β-Catenin 0.73±0.07 0.15±0.04◆◆0.25±0.03◆◆●0.26±0.05◆◆●0.20±0.04◆◆0.22±0.03◆◆0.48±0.09◆◆●●▲▲★★54.220 0.000 Pax6 0.64±0.10 0.16±0.04◆◆0.30±0.06◆◆●●0.28±0.06◆◆●0.24±0.05◆◆0.33±0.07◆◆●●0.48±0.08◆◆●●▲▲★★21.205 0.000
3 讨论
DBA/2J 小鼠是一种年龄相关性高眼压青光眼视神经损伤模型,在一定时期内随着年龄的增长眼压逐渐升高,升高的眼压导致视网膜神经节细胞凋亡和轴突变性。 它是由于GPNMB 和TYRP1 基因突变[9]导致虹膜脱色素、虹膜萎缩,脱落的色素和细胞碎片聚集在房水外流通道中,导致房水外流受阻,引起高眼压,继而产生视网膜神经节细胞凋亡、视盘神经纤维层变薄以及视盘变大等视神经损害。 SHELDON 等[10]于1995 年首次对其进行了描述,该青光眼模型具有自然性、年龄相关性及进展性,类似人类青光眼发病方式,所以在青光眼实验研究中得以广泛使用,特别是在探讨压力相关性视神经节细胞凋亡、视神经变性机制[11-12]和评估视神经保护药物疗效[13]等方面。 DBA/2J 小鼠的眼压增高程度具有一定的个体化差异,本研究发现,DBA/2J 小鼠38 周龄时,98 只(196 眼)眼压波动范围在16~37(23.47±2.44) mmHg,进行离群值取舍后判定眼压波动范围在16.15~30.79 mmHg 之间,故将眼压<16.15 mmHg和>30.79 mmHg 的DBA/2J 小鼠予以剔除。
Wnt/β-Catenin 信号通路主要由Wnt 家族分子等组成的配体[14],包括卷曲蛋白(frizzlled, FZ)、低密度脂蛋白受体相关蛋白5/6(low density lipoprotein receptor related protein 5/6, LRP-5/6)等跨膜受体,GSK-3β、结肠腺瘤样息肉病基因产物(adenomatous polyposis coli, APC)、蓬乱蛋白(dishevelled, Dsh)、β-Catenin、轴蛋白(Axin)等调节蛋白及转录因子TCF/LEF 家族等组成。 当存在分泌的Wnt 蛋白时,细胞外Wnt 蛋白与细胞膜上的FZ/LRP 受体结合启动Wnt/β-Catenin 信号,然后通过磷酸化并激活细胞浆内的Dsh 蛋白,抑制GSK-3β/APC/Axin 复合物对β-Catenin 的磷酸化,胞浆内β-Catenin 累积并稳定后会转移至细胞核与TCF/LEF 家族的转录因子结合,促进下游Pax6、Ngn2、c-myc、cylinD1 等靶基因的表达,这些基因多是参与细胞增殖、凋亡调控的基因[5]。 在没有Wnt 蛋白存在或者GSK-3β 活化过度时,GSK-3β/APC/Axin 复合物在GSK-3β 的作用下将降解β-Catenin,而不能引起下游相关靶基因的表达,使Wnt/β-Catenin 信号通路处于抑制或关闭状态,因此,GSK-3β 是许多神经退行性疾病的关键调节因子[15]。
青光眼作为一种眼部神经退行性疾病,病理机制与其他神经退行性疾病相似,存在神经元Tau 蛋白磷酸化异常、轴浆转运障碍、凋亡及变性等病理改变[16-18]。 在慢性高眼压病程中伴随有GSK-3β 活化的危险因素,比如视网膜的缺血缺氧、DNA 损伤、神经营养因子缺乏、β 淀粉样蛋白异常沉积等[19-21]。 研究也证实,慢性高眼压可引起视网膜视神经GSK-3β活化与过度表达[22],使视网膜视神经Wnt/β-Catenin信号通路处于抑制状态,包括Pax6 在内的下游靶基因表达将可能受到抑制,而Pax6 靶基因可以通过上调Math5 和Brn3b 蛋白水平,可以促使胚胎干细胞分化形成视网膜神经节样细胞[23],参与细胞增殖、凋亡调控。 通过抑制GSK-3β 过度活化,促使β-Catenin表达与向核内转移,可以促进Wnt/β-Catenin 信号通路激活,从而达到保护神经系统,延缓神经退行性疾病病程进展的目的[24-26]。
青光眼的疾病特征就是进行性RGCs 死亡和神经纤维丧失,凋亡是RGCs 死亡的主要途径[1]。SCHUETTAUF 等[27]用TUNEL 法标记凋亡的RGCs,发现DBA/2J 小鼠RGCs 凋亡峰时出现在6 月龄。 而杨帆等[28]用Nissl 染色标记法追踪DBA/2J 小鼠RGCs丢失情况,发现RGCs 丢失从7 月龄开始,高峰时在9~11 月龄,14 月龄RGCs 仅零星可见。 观察到的DBA/2J 小鼠RGCs 凋亡高峰时间不同可能是由于他们采取了不同的研究方法所致。 本研究选取38 周龄的DBA/2J 小鼠作为青光眼视神经损伤模型,通过TUNEL 法标记凋亡的RGCs,发现38 周龄DBA/2J小鼠凋亡指数达到55.86%±8.53%,明显高于正常对照组(P<0.01)。 进一步说明了DBA/2J 小鼠自38周龄后具有显著的RGCs 凋亡特征,是理想的青光眼视神经损伤模型,对于评估视神经保护药物的疗效是可行的。 采用益脉康分散片、青光安Ⅱ号方、青光安Ⅱ号方有效组分低、中、高剂量干预青光眼模型DBA/2J 小鼠4 周,发现益脉康分散片、青光安Ⅱ号方汤剂、青光安Ⅱ号方有效组分低中、高剂量均能够明显延缓或阻止DBA/2J 小鼠RGCs 的凋亡;其中青光安Ⅱ号方有效组分高剂量对DBA/2J 小鼠RGCs的凋亡抑制作用明显优于益脉康分散片和青光安Ⅱ号方汤剂。
GSK-3β 和β-Catenin 是Wnt/β-Catenin 信号通路中的两个关键信号蛋白分子[29],GSK-3β 活化过度时,GSK-3β/APC/Axin 复合物在GSK-3β 的作用下将降解β-Catenin,不能引起下游Pax6 等靶基因的表达。 通过Western blot 检测各组小鼠视网膜GSK-3β、β-Catenin 及Pax6 蛋白表达量发现,与正常对照组C57BL/6J 小鼠比较,青光眼模型组GSK-3β 在视网膜表达水平明显升高,β-Catenin 和Pax6在视网膜表达水平明显降低(P<0.01),说明38 周龄后DBA/2J 小鼠视网膜Wnt/β-Catenin 信号通路处于抑制状态,下游Pax6 基因同样难以表达。 益脉康分散片、青光安Ⅱ号方、青光安Ⅱ号方有效组分个剂量组干预青光眼模型组DBA/2J 小鼠4 周后,发现益脉康分散片、青光安Ⅱ号方汤剂、青光安Ⅱ号方有效组分高剂量均能激活DBA/2J 小鼠视网膜Wnt/β-Catenin 信号通路相关蛋白及下游Pax6 基因表达,且青光安Ⅱ号方有效组分高剂量组的作用更为明显。
本实验验证了青光安Ⅱ号方有效组分高剂量具有明显抑制青光眼动物模型RGCs 细胞凋亡、保护视神经的作用,其作用与激活Wnt/β-Catenin 信号通路和下游Pax6 基因表达关系密切。 在后期研究中,本团队将采用UPLC-Q-TOF 法,结合相关文献和化合物质谱信息,分析鉴定出该有效组分的相关化学成分,为治疗青光眼的中药新药的研发提供基础。

