麝香保心丸口服联合替奈普酶溶栓对AMI患者心功能及血清细胞因子水平的影响
张文秀 ,李金梁,张莎莎
1 河南省周口市太康县第二人民医院 河南周口 461400
2 河南省周口市中心医院 河南周口 466099
3 河南省周口市太康县第一人民医院 河南周口 466299
急性心肌梗死(Acute myocardial infarction,AMI)属临床常见危急重症,多是因机体冠状动脉闭塞或狭窄,致使心肌缺血、部分心肌细胞坏死所致,患者临床多表现为突发胸痛、胸闷等症状,具有发病急、进展快、病情重等特点,常可危及生命[1-3]。替奈普酶(Teneplase,Metalyse,TNK-tPA)为临床针对AMI患者常用治疗药物,虽能于一定程度缓解患者病情,但易导致梗死病灶处血药浓度不足,难以获得最佳治疗效果。中医认为,AMI属“心痛”范畴,多是因正气虚损、体虚、寒邪、瘀毒等病机所致,故主张以活血益气、利水化痰之法治疗[4-5]。麝香保心丸(Shexiang Baoxin Pill,SBP)属中成药制剂,其主要成分(人工牛黄、肉桂、麝香等)具有活血益气、利水化痰之功效[6]。但应用SBP辅助治疗AMI患者效果如何,临床鲜有报道。基于此,本研究回顾性收集我院102例AMI患者,旨在探究SBP辅助治疗应用价值。分析如下。
资料与方法
1 一般资料
收集我院102例AMI患者(2020年1月—2021年1月),按 治 疗 方 案 不 同 分 成A组(n=51)、B组(n=51)。其中A组男30例,女21例,年龄38~63岁,平均年龄(51.26±5.40)岁;Killip心功能分级;24例Ⅰ级,27例Ⅱ级;B组男28例,女23例,年龄35~65岁,平均年龄(50.38±5.01)岁;Killip心功能分级;26例Ⅰ级,25例Ⅱ级。2组基线资料均衡可比(P>0.05)。
2 入组标准
2.1 纳入标准 ①纳入符合西医AMI诊断标准[7];②起病时长<24h;③均伴突发胸痛、胸闷等症状;行心电图检查,可见病理性ST段、Q波、T波改变;④硝酸酯类药物治疗无效者;⑤临床资料完整。
2.2 排除标准 ①心脏手术史、AMI发病史;严重恶性肿瘤;②依从性差;严重器质性病症;③凝血功能异常;④自身免疫性病症;⑤合并心脏瓣膜病、心源性休克等;过敏体质。
3 方法
2组入院后持续监测基本生命体征,保持静脉通道,嘱卧床休息,针对存在低氧症者,予以营养支持、补液;另予以抗血小板、硝酸酯类等基础治疗。
3.1 B组 接受TNK-tPA(西安杨森制药有限公司,国药准字H20020555)溶栓治疗,①10s静注,剂量0.53mg/kg;②静推,剂量15mg;③静注30min,剂量0.75mg/kg,总剂量<50mg;④静注60min,剂量0.5mg/kg,总剂量<35mg。
3.2 A组 接受SBP口服联合TNK-tPA溶栓治疗,TNK-tPA溶栓剂量、方法同B组;SBP(上海和黄药业有限公司,国药准字Z31020068)口服,67.5mg/次,3次/d。2组持续治疗1个月。
4 疗效评估标准
治疗1个月后评估,显效:临床症状消失,心电图复常,心功能提高≥2级;有效:临床症状消失,心功能提高1级,但心电图不稳;无效:未及上述标准。总有效率为有效、显效率之和。
5 观察指标
①2组总有效率。②2组治疗前、治疗1个月心功能[左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左室射血分数(LVEF)]水平,彩色多普勒超声诊断仪(美国惠普公司,8500型)测定,重复测量3次,取平均值。③2组治疗前、治疗1个月炎性因子[白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)]水平,取静脉血6ml,室温凝固,3000r/min转速离心10min(r=10cm),分离血清,酶联免疫吸附法测定。④2组治疗前、治疗1个月血管内皮功能[一氧化氮(NO)、内皮素-1(ET-1)]水平,硝酸还原酶法测定血清NO水平,以放射免疫法测定血清ET-1水平。⑤2组治疗前、治疗1个月心肌酶谱指标[肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、羟丁酸脱氢酶(HBDH)]水平,酶联免疫吸附法测定。
6 统计学分析
结 果
1 总有效率
A组总有效率94.42%较B组78.43%高(P<0.05),见表1。

表1 2组总有效率对比
2 心功能指标
治 疗1个 月A组LVEDD、LVESD较B组 低,LVEF较B组高(P<0.05),见表2。

表2 2组治疗前、治疗1个月心功能指标对比(±s±s)
3 炎性因子指标
治疗1个月A组血清IL-6、TNF-α水平较B组低(P<0.05),见表3。
表3 2组治疗前、治疗1个月炎性因子水平对比(±s) pg/mL

表3 2组治疗前、治疗1个月炎性因子水平对比(±s) pg/mL
?
4 血管内皮功能指标
治疗1个月A组血清ET-1水平较B组低,血清NO水平较B组高(P<0.05),见表4。

表4 2组治疗前、治疗1个月血管内皮功能指标对比(±s±s)
5 心肌酶谱指标
治疗1个月A组血清CK-MB、LDH、CK、HBDH水平较B组低(P<0.05),见表5。
表5 2组治疗前、治疗1个月心肌酶谱指标对比(±s) U/L
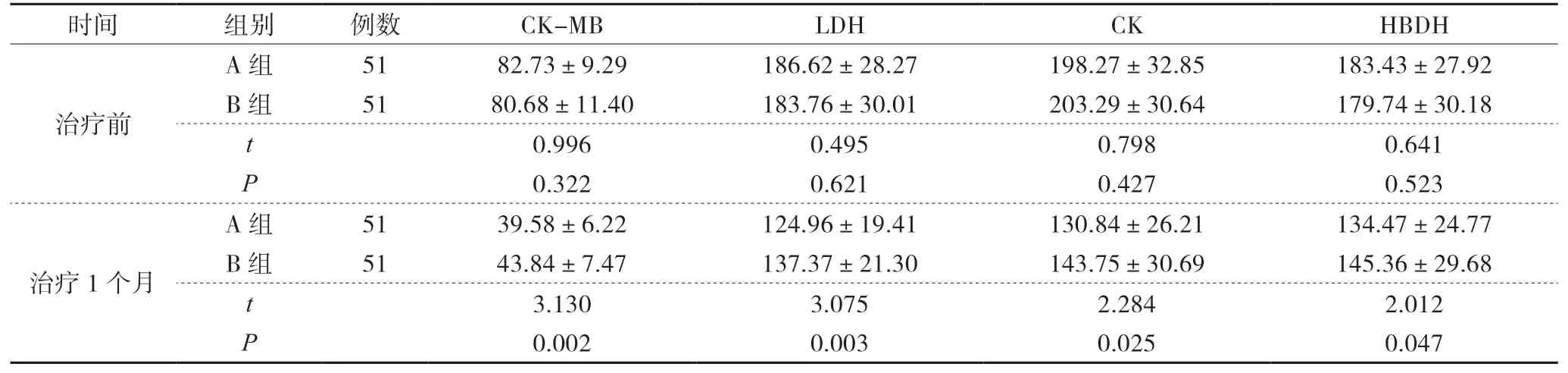
表5 2组治疗前、治疗1个月心肌酶谱指标对比(±s) U/L
?
讨 论
中医认为,AMI属“胸痹”“心痛”等范畴,其与血瘀、寒凝、气滞等有关,《素问·举痛论》中早有记载“经脉流行不止,环周不休”,“心痹者,脉不通,烦则心下鼓,暴上气而喘”[8]。“本虚标实”为其发病机制,本虚者,年迈体衰、劳逸失调、情志、先天禀赋不足,以致阴阳气血不足;标实者,寒邪、膏粱厚味,以致气滞痰阻,寒凝阻塞于心脉络,故主张以养阴通阳、益气活血、行气通腑之法治疗[9-10]。SBP是由人工牛黄、苏合香、肉桂、人参提取物、蟾酥、人工麝香、冰片等中药材组成,其中苏合香可通络止痛、醒神开窍;肉桂性大热,味辛、甘,可镇静镇痛、益气行滞;蟾酥性温,味辛,可行气止痛、开窍辟秽;牛黄性凉,味甘,可解毒息风、清心开窍;人参皂苷是人参提取物的主要成分,可扶正固本、强心补气;麝香性温,味辛,可活血化瘀;诸药配伍,共奏益气活血、温通止痛、强心固本之功效。本研究数据显示,A组总有效率94.42%较B组78.43%高,治疗1个月LVEDD、LVESD较B组低,LVEF较B组高(P<0.05),可见,联合SBP辅助治疗AMI患者可进一步提升疗效,改善心功能。现代药理研究显示,SBP具有稳定粥样硬化斑块、促进治疗性血管新生、改善侧支循环、抑制血管炎症反应、阻止血管平滑肌细胞异常增生、抗心肌纤维化等作用[11]。此外,本研究数据还显示,治疗1个月A组血清IL-6、TNF-α水平较B组低(P<0.05),其中血清TNF-α可参与调节机体免疫应答及细胞生长,可对新生血管形成及分化产生促进作用,并诱导心肌梗死相关蛋白合成;血清IL-6可对心脏乳头肌收缩功能产生抑制效果,从而致使心肌功能减退[12-13]。由此证实,应用SBP辅助治疗可有效减轻机体炎性反应。笔者认为,这可能与SBP中人参提取物、冰片等中药材具有显著抗炎效果有关。研究指出,血清ET-1、NO可参与AMI发生、发展,其中,血清ET-1是维持心血管稳态、基础血管张力的重要因子,其可致使冠状动脉收缩;而血清NO可直接作用于血小板细胞,避免动脉粥样硬化、血栓形成[14-15]。本研究数据显示,治疗1个月A组血清ET-1水平较B组低,血清NO水平较B组高(P<0.05),提示,SBP辅助治疗AMI能明显改善血管内皮功能,其可能是该治疗方案增效的另一重要途径。
另有研究表明,心肌细胞长时间缺血,可致使机体缺血性损伤、心肌细胞膜通透性改变,造成血清LDH、CK-MB、CK、HBDH等物质进至血液,并呈高表达状态,其表达与心肌损伤程度呈正比[16]。本研究结果中,治疗1个月A组血清CK-MB、LDH、CK、HBDH水平较B组低(P<0.05),这一结果说明,联合应用SBP治疗AMI患者可有效减轻心肌损伤。分析原因可能在于,SBP可有效强化抗血小板效果,促使斑块稳定、血栓消退,使心肌血流量增加,减轻心肌细胞损伤,且能有效减轻机体缺氧-复氧所致心肌损伤,使心肌酶谱指标降低。
综上,SBP辅助治疗AMI患者可高心功能,减轻机体炎性反应,提升疗效,同时还可改善血管内皮功能,减轻心肌损伤。

