微生物多糖调控克罗恩病肠道炎症免疫反应的机制研究
刘威,黄文峰,周云,孟凡,何良梅
赣南医学院第一附属医院,江西 赣州 341000
克罗恩病是一种炎症性肠病,尚不清楚该疾病的发病机制,主要是遗传、免疫、环境与肠道微生物生态等多重因素相互作用的结果[1]。克罗恩病变具有进展性发展或反复急性发作,具有较高的发病率,可发生严重的并发症,并且给家庭和个人带来严重的经济负担[2]。近几年发现机体的免疫系统与肠道菌群有着紧密的联系,肠道微生物通过新陈代谢调节机体免疫系统,而肠道系统能够主动调节肠道菌群的多样性从而来影响机体健康[3]。最新研究发现细菌脂多糖(LPS)和1,3-β-D 葡聚糖可激活肠道免疫细胞产生炎性介质,可能参与克罗恩病的发生过程[4]。本研究通过研究微生物多糖调控克罗恩病肠道炎症免疫反应的机制,为全面解析克罗恩病的致病机制提供理论依据。
1 实验材料与方法
1.1 实验材料
1.1.1 实验动物60 只6-8 周龄健康雄性BABL/c 小鼠,体重18~22 g,购自南昌医学院实验动物中心[许可证SCXK(鄂)2019-0001,武汉华联科生物技术有限公司],将小鼠在湿度为50%、温度为24 ℃左右条件下适应性喂养1 周。
1.1.2 主要试剂微生物多糖(北京博奥泽科技有限公司);2,4,6 三硝基苯磺酸(TNBS)50 g/L 水溶液(合肥吉之畅公司);无水乙醇(合肥吉之畅公司);PCR 试剂盒(北京灵宝科技公司);ELISA试剂盒(北京博奥泽科技有限公司);兔抗大鼠甘油醛-3-磷酸脱氢酶(GADPH)多克隆抗体(上海金穗生物科技公司);兔源Toll 样受体4(TLR4)抗体(广州创融生物科技公司);兔源MyD88 抗体(广州创融生物科技公司);兔源NF-κBp65 抗体(广州创融生物科技公司)。
1.1.3 主要仪器PCR 仪(美国ABI 公司);电泳仪槽(北京六一仪器厂);全自动数码凝胶成像分析系统 [亚速旺(上海)商贸公司];离心机(德国Eppendorf 公司)。
1.2 方法
1.2.1 分组和建模方法将小鼠随机分为三组,分别为对照组、模型组、实验组,每组20 只。实验前,各组小鼠正常饮食,实验前适应性喂养1 周。首先构建克罗恩病,实验组和模型组小鼠参照Kim等[5]的方法建立克罗恩病模型,按TNBS 水溶液:50% 乙醇(1∶1)混合,100 μL 肛门灌注一次,造模前禁食24 h、不禁水。对照组小鼠肛门灌注100 μL 生理盐水。液体缓慢灌注完毕,拔出导管,保持小鼠倒立姿势60 s,灌肠后正常饲养。每日观察并记录小鼠疾病活动性状,若连续3 d 小鼠体重持续下降,出现血便则造模成功。造模完成后,实验组小鼠给予灌胃已制备好的微生物多糖溶液0.25 mL/次,模型组和对照组小鼠灌胃等量的无菌水,2 次/d,连续21 d。21 d 后将小鼠颈椎脱臼法处死,取肛门至回盲肠管。
1.2.2 疾病活动度评分每天记录每组小鼠的体重、大便性状及便血情况,计算各组小鼠疾病活动指数(DAI)评分[6]。小鼠皮毛光滑程度、粪便隐血、直肠脱垂、粪便形态及腹泻的情况都是该指数的组成部分。由体重减失率分数和大便隐血程度分数相加而得,DAI 评分为(体重减轻+大便稠度+大便隐血)/3。分值在0~8,体重减失率(%)=(实验前体重-造模后体重)/实验前体重×100%。体重减轻率:正常为0 分,1%~5%为1 分,5%~10%为2 分,11%~15%为3 分,>15%为4 分;粪便性状:正常为0 分,介于正常和糊状便之间为1 分,糊状便为2 分,介于糊状便和腹泻之间为3 分,腹泻为4 分;隐血情况:正常为0 分,隐血阳性为2 分,肉眼可见出血为4 分。其DAI 评分越高,疾病的症状越严重。
1.2.3 组织病理学评分PBS 洗涤结肠组织,乙醇脱水,二甲苯清洗,包埋,切片,HE 染色,光学显微镜下观察。参照组织学评分标准[6],仅为结构改变(0 分);可见慢性炎症(1 分);固有层见中性粒细胞浸润(2 分);上皮层见中性粒细胞浸润(3分);隐窝结构破坏(4 分);见糜烂或溃疡(5 分)。
1.2.4 ELISA 检测血清促炎因子TNF-α、IL-1β、IL-6、IL-10 表达水平 抽取大鼠腹主动脉血,4 ℃ 3 500 r/min 离心5 min,按照ELISA 试剂盒说明,稀释标准品,绘制标准曲线,检测大鼠血清TNF-α、IL-1β、IL-6、IL-10 的含量。
1.2.5 Western blotting 分析将-80 ℃各组大鼠结肠组织匀浆后,提取总蛋白,用3 000 r/min 的离心机离心10 min,取上清液。电泳分离蛋白,转膜,封闭,TBST 清洗后,加入一抗TLR4、MyD88 和NFκB p65(1∶1 000),孵育,添加二抗(1∶5 000)、孵育2 h,分析条带灰度值。
1.3 统计学方法
2 结果
2.1 各组大鼠DAI 评分、结肠长度、结肠病理学评分比较
与对照组相比,模型组和实验组小鼠DAI 评分明显升高;与模型组相比,实验组小鼠DAI 评分明显降低(P<0.05)。与对照组相比,模型组和实验组小鼠结肠长度明显缩短,且具有明显充血肿胀;与模型组相比,实验组小鼠结肠长度伸长,充血肿胀情况改善(P<0.05)。与对照组相比,模型组及实验组小鼠结肠组织病理学评分明显升高;与模型组相比,实验组小鼠结肠组织病理学评分明显降低(P<0.05)。见表1 及图1。
表1 各组大鼠DAI评分、结肠长度、结肠病理学评分比较()

表1 各组大鼠DAI评分、结肠长度、结肠病理学评分比较()
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05。
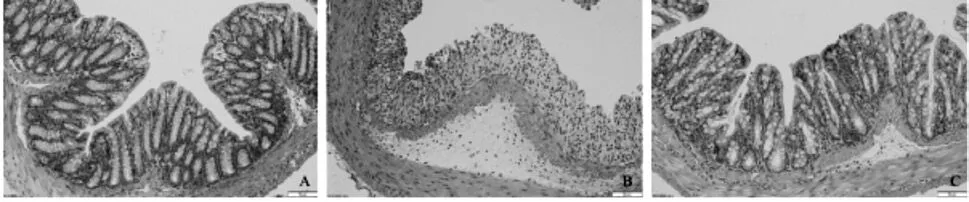
图1 结肠组织病理切片(HE染色×200):A.对照组;B.模型组;C.实验组
2.2 各组大鼠血清促炎因子TNF-α、IL-1β、IL-6、IL-10 表达水平比较
与对照组相比,模型组和实验组血清促炎因子TNF-α、IL-1β、IL-6 表达水平升高,IL-10 表达水平降低;与模型组相比,实验组血清促炎因子TNF-α、IL-1β、IL-6 表达水平降低,IL-10 表达水平升高(P<0.05)。见表2。
表2 血清促炎因子TNF-α、IL-1β、IL-6、IL-10表达水平比较() pg/mL

表2 血清促炎因子TNF-α、IL-1β、IL-6、IL-10表达水平比较() pg/mL
2.3 各组小鼠炎性因子TLR4、MyD88、NF-κBp65蛋白表达水平比较
与对照组相比,模型组和实验组小鼠结肠组织炎性因子TLR4、MyD88、NF-κBp65 蛋白表达水平均明显升高;与模型组相比,实验组小鼠结肠炎性因子TLR4、MyD88、NF-κBp65 蛋白表达均明显下降(P<0.05),见表3。
表3 各组小鼠炎性因子TLR4、MyD88、NF-κB p65蛋白表达水平比较()
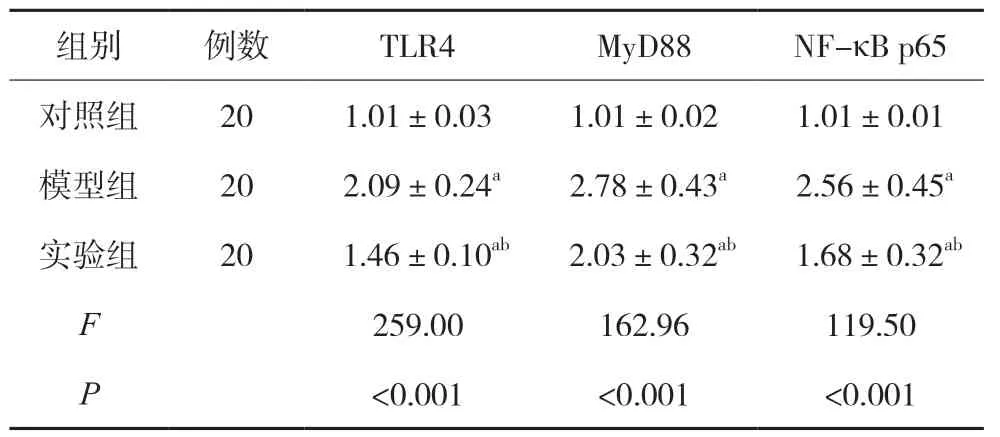
表3 各组小鼠炎性因子TLR4、MyD88、NF-κB p65蛋白表达水平比较()
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05。
3 讨论
克罗恩病是炎症性肠病的一种,针对该疾病的确切发病机制没有明确的定论,多数研究认为和遗传、环境、感染、免疫系统异常及肠道炎症相关[7]。其中免疫因素是重要的发病因素,主要原因是免疫细胞会调控炎症反应,免疫因素紊乱,导致发生炎症反应,进一步发生炎症性肠病[8]。目前已研究证实,肠道黏膜免疫系统所致的炎症反应在克罗恩病的发生和发展中有着重要的作用,是导致肠道损伤、功能障碍的重要原因[9]。实验组小鼠结肠长度长于模型组,表明微生物多糖可以增加克罗恩病小鼠的体重及结肠长度。与模型组相比,实验组血清促炎因子TNF-α、IL-1β、IL-6 表达水平降低,IL-10表达水平升高,提示微生物多糖通过调控炎症因子的表达改善小鼠的炎症反应。
TLR 主要作用是识别病原微生物,而TLR4 主要是通过非特异性的方式结合并启动病原相关分子的信号转导,释放肠道的炎症介质,参与克罗恩病的发病。以往的研究已经发现在正常人的肠道中TLR4 水平降低,但在克罗恩病中有着较高的表达水平,这证明了TLR4 在克罗恩病中的作用[10]。克罗恩病小鼠模型的MyD88 蛋白水平明显高于对照组。MyD88 含有TLR 结构域的接头蛋白,与Toll 的结构域相互作用,TLR4 可以激活MyD88 通路,最终激活NF-κB,NF-κB 是激活炎症反应的关键转录因子。但微生物多糖调控后,MyD88 的表达降低,所以微生物多糖抑制这一通路。NF-κB广泛存在于各种组织中,主要作用是调节炎症,同时也是多种信号转导途径的汇聚点,在肿瘤及炎症反应相关基因的表达中起着至关重要的作用。研究表明NF-κBP65 蛋白在克罗恩病高表达,本研究也发现了在模型组小鼠中NF-κBP65 的蛋白水平明显高于对照组,证明TLR4/MyD88/NF-κB 在克罗恩病炎症反应中有着重要的作用。
综上所述,克罗恩病结肠组织中有着高表达的TLR4、MyD88 和NFκB,并且微生物多糖是通过TLR4/MyD88/NF-κB 通路调控克罗恩病肠道炎症免疫反应。

