硫化氢合成酶在糖尿病模型小鼠结肠动力障碍中的作用机制
全晓静 常丹燕 许晓毓 戴菲 王进海
慢性便秘是糖尿病常见并发症之一[1],但发生机制尚未完全明确。目前研究认为,糖尿病相关便秘的病理生理机制包括肠道间质Cajal细胞减少、肠神经系统功能障碍等[2]。硫化氢(H2S)是一种气体信号分子,在哺乳动物体内可通过胱硫醚-γ-裂解酶(CSE)和胱硫醚-β-合成酶(CBS)催化底物L-半胱氨酸生成[3]。H2S在消化道动力调控中发挥双向调节作用,低浓度时具有促进作用,而高浓度时具有抑制作用[4-6]。研究发现,H2S在链脲佐菌素(STZ)诱导的糖尿病模型大鼠胰腺、肝脏等组织器官中水平明显增加,说明H2S可能参与糖尿病不同组织器官功能障碍的发生发展[7]。本研究采用STZ诱导建立雄性C57BL/6糖尿病模型小鼠,观察其结肠动力变化及CES和CBS的表达水平以明确其在糖尿病模型小鼠结肠动力障碍中的作用及机制。
材料与方法
1.材料:SPF级雄性C57BL/6小鼠(8周龄)购自西安交通大学实验动物中心(实验动物许可证号:63241547)。小鼠饲养温度(24±1) ℃,湿度65%~66%,自由饮食。本动物实验方案通过西安交通大学第二附属医院医学伦理委员会批准(2021866)。实验溶液包括台式液、无钙生理盐水溶液(PSS)、L型钙离子通道电极内液和细胞消化液,其配方与前期研究一致[8]。实验试剂:STZ、H2S供体硫氢化钠(NaHS)、河豚毒素(TTX)、枸橼酸缓冲液、4’,6-二脒基-2-苯基吲哚(DAPI)染色液均购自Sigma公司,CSE抗体购自Abcam公司,CBS抗体购自Santa Cruz Biotechnology公司。STZ冰浴避光使用枸橼酸缓冲液配置,在溶解后5min内使用。
2.方法
(1)动物分组和干预措施:将16只SPF级小鼠随机分为STZ组和对照组,每组各8只。再将10只SPF级小鼠随机分为正常组和TTX组,每组各5只。STZ组一次性腹腔注射STZ(200 mg/kg)诱导1型糖尿病模型,对照组腹腔注射等体积枸橼酸缓冲液。正常组和TTX组不做任何处理。
(2)模型建立:STZ组和对照组小鼠造模前禁食20 h后分别一次性腹腔注射STZ及枸橼酸缓冲液。在STZ注射前当天、后2周、后4周通过尾静脉采血对两组小鼠进行空腹血糖检测,2周后空腹血糖水平稳定且高于16.7 mmol/L的小鼠被认为造模成功且最终纳入本研究。在STZ注射后第2周和第4周分别记录两组小鼠24 h排便粒数。在STZ注射后第4周,采用10%水合氯醛麻醉处死所有小鼠。
(3)免疫荧光和蛋白免疫印迹法(Western blot):一抗、二抗孵育后,用DAPI进行细胞核染色,在光子显微镜下观察STZ组和对照组小鼠CBS和CSE在结肠全层的分布。提取结肠组织总蛋白后经电泳、转膜后孵育一抗、二抗,后进行显影、曝光。以灰度分析软件处理数据,记录CBS和CSE的表达水平。
(4)恒温肌槽实验:麻醉处死所有小鼠后迅速取出结肠组织置于氧饱和的4 ℃台式液中,分别沿肠管纵轴及横轴方向制备纵行肌条(LMS)和环形肌条(CMS),宽约3 mm,长约10 mm。将肌条连接至张力换能器(型号RM6240BD,购自成都仪器厂)并传导信号至多通道生理信号采集处理系统(型号RM6240BD,购自成都仪器厂),记录STZ组和对照组小鼠结肠平滑肌条收缩振幅。正常组小鼠肌条不做任何预处理,TTX组在浴槽中加入TTX(1μmol/L)孵育10min,之后每隔3min以浓度累计方式向两组肌条中依次加入0.02 mmol/L、0.10 mmol/L、0.50 mmol/L和1.50 mmol/L NaHS。记录各时段正常组和TTX组小鼠结肠平滑肌条收缩振幅,将加入0.02 mmol/L NaHS前测得的值定义为基线值。
(5)膜片钳实验:剥离正常小鼠结肠黏膜及黏膜下层,将剩余组织剪成小方块,置于37 ℃氧饱和的细胞消化液中消化15~20 min。分次取适量组织块置于含有氧饱和无钙PSS的EP管中冲洗4次,然后置于4 ℃冰箱备用。实验前用抛光的玻璃巴氏吸管制备细胞悬液,然后将其滴入浴槽中,待细胞贴壁后,用氧饱和台式液灌流(1 ml/min)10 min以清除细胞残渣。拉制尖端入液电阻为5~7 MΩ的微电极(型号P-97,购自Sutter公司),在倒置显微镜下选择折光性好、细胞膜光滑的平滑肌细胞进行高阻封接后负压吸引破膜,形成全细胞记录模式。采用Axon700B放大器及pClamp10.2软件,钳制电位-50 mV,阶跃刺激从-50 mV开始,以每10 mV阶跃去极化至+40 mV,持续300 ms引出L型钙通道电流,记录曲线图和细胞膜电容,并记录依次加入0.10 mmol/L和0.50 mmol/L NaHS后电流曲线图,通过计算峰电流(pA)与膜电容(pF)的比值即获得电流密度(pA/pF)。将加入0.10 mmol/L NaHS前测得的电流密度定义为基线值。
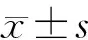
结 果
1.两组小鼠空腹血糖与排便粒数比较:STZ组小鼠STZ注射后第2周与第4周空腹血糖水平均显著高于同期对照组,排便粒数均显著低于同组注射前及同期对照组(P<0.001),见表1。
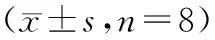
表1 两组小鼠空腹血糖与排便粒数比较
2.两组小鼠结肠平滑肌条收缩振幅比较:STZ组小鼠LMS和CMS收缩振幅均低于对照组[(0.47±0.12)g比(0.68±0.19)g,(0.25±0.07)g比(0.38±0.04)g,P<0.05]。
3.两组小鼠CBS和CSE在中段结肠的表达情况:光镜下可见,CBS主要分布在小鼠结肠的黏膜层和肌间神经丛(图1A、1B),CSE主要分布在黏膜层、平滑肌细胞和肌间神经丛(图1C、1D)。STZ组小鼠结肠组织CBS和CSE表达水平均高于对照组[(0.61±0.16)g比(0.36±0.10)g,(0.84±0.16)g比(0.57±0.09)g,P<0.05]。

图1 两组小鼠CBS和CSE在中段结肠的表达情况(A、C:对照组;B、D:STZ组;A、B:CBS;C、D:CSE;DAPI染色,×200)
4.不同浓度NaHS对正常小鼠结肠平滑肌细胞L型钙通道电流的作用比较:正常组和TTX组小鼠NaHS(0.1 mmol/L)LMS及CMS收缩振幅均高于同组基线值,两组小鼠NaHS(1.5 mmol/L) LMS及CMS收缩振幅均低于同组基线值(P<0.05)。见表2。

表2 不同浓度NaHS组小鼠结肠平滑肌条收缩振幅比较
5.不同浓度NaHS组正常小鼠结肠平滑肌细胞电流密度比较:正常小鼠NaHS(0.10 mmol/L)组电流密度(-4.50±0.63)pA/pF高于NaHS(0.50 mmol/L)组(-3.03±1.12)pA/pF及基线值(-3.34±0.67)pA/pF(P<0.05);NaHS(0.50 mmol/L)组电流密度与基线值比较差异无统计学意义(P>0.05)。
讨 论
糖尿病患者结肠传输时间延长,常伴发便秘[1,10]。近来研究发现,肠神经系统、肠间质Cajal细胞和平滑肌细胞功能异常,兴奋性和抑制性神经递质失衡等参与糖尿病胃肠动力障碍的发生[2]。H2S作为继NO和CO后第3个气体信号分子,具有多种生物学功能,包括参与消化道动力的调控[4-6]。内源性H2S可通过CBS和CSE催化底物L-半胱氨酸而生成[6,13]。因此H2S合成酶表达改变会导致肠道H2S水平异常。STZ诱导的糖尿病动物实验研究发现不同组织、器官H2S水平均增加[7],说明STZ诱导的糖尿病模型存在H2S水平异常。本研究发现,STZ诱导的糖尿病模型小鼠排便减少、结肠动力减慢,可能与肠道组织H2S合成增加,抑制平滑肌细胞L型钙通道开放有关。
STZ诱导糖尿病是经典且有效的造模方法,在前期很多研究中均采用[7-9]。本研究首先观察了模型组小鼠的排便情况,结果显示STZ组小鼠排便粒数在STZ诱导后第2周和第4周均显著下降,并明显低于同期对照组,间接说明糖尿病模型小鼠结肠蠕动减慢。我们还观察了小鼠结肠LMS和CMS自发性收缩振幅改变,结果显示STZ组小鼠LMS和CMS收缩振幅均较对照组明显减弱。上述结果说明STZ诱导的糖尿病模型小鼠存在结肠动力减弱,与前期研究结果一致[12]。研究已证实STZ诱导的糖尿病模型小鼠结肠传输时间延长[9],而排便粒数作为反映结肠传输功能的间接指标,在本研究中已证实STZ组显著低于对照组。因此,本研究未进一步检测结肠传输时间以评估糖尿病模型小鼠结肠动力。
本研究结果显示,CBS主要分布在小鼠中段结肠的黏膜层和肌间神经丛,而CSE主要分布在黏膜层、平滑肌细胞和肌间神经丛。一方面说明黏膜及神经源性的H2S来自CBS和CSE,而平滑肌源性的H2S主要来自CSE催化底物生成。另一方面,说明H2S对肠道动力的调控可能为多靶点。但我们前期另一项研究结果显示CBS在大鼠近端结肠平滑肌层表达[8]。该差异可能与种属和检测方法不同有关。本研究还发现,与正常小鼠相比,糖尿病模型小鼠结肠CBS和CSE表达水平明显增加,说明糖尿病模型小鼠肠道内源性H2S合成增加。
为明确H2S对小鼠结肠动力的作用,本研究观察不同浓度NaHS对小鼠结肠组织LMS和CMS自发性收缩振幅的影响。与NaHS对小鼠胃窦平滑肌的收缩作用一致[6],本研究也发现NaHS对小鼠结肠动力可能具有双向调节作用,低浓度NaHS(0.1 mmol/L)促进LMS和CMS收缩,而高浓度NaHS(0.5~1.5 mmol/L)可明显抑制LMS和CMS收缩。为进一步明确NaHS对结肠平滑肌收缩的双向作用是神经源性还是肌源性,本研究采用TTX孵育LMS和CMS以阻断肠神经纤维电压依赖钠离子通道,结果发现TTX孵育不能阻断NaHS对小鼠结肠平滑肌收缩的双向调节作用,说明H2S对结肠平滑肌收缩的双向作用是肌源性的。为进一步明确H2S对结肠动力双向调节作用的潜在机制,本研究观察了不同浓度NaHS对正常小鼠结肠平滑肌细胞L型钙通道电流的影响。L型钙通道是调节平滑肌细胞收缩和舒张的重要离子通道[12]。钙通道开放使钙离子内流,细胞膜去极化,导致平滑肌细胞收缩。本研究结果发现,NaHS(0.1 mmol/L)使峰电流增加,但不会影响钙通道的电压依赖特性;而NaHS(0.5 mmol/L)使峰电流密度减低,峰电位右移,说明低浓度NaHS促进L型钙通道开放从而促进平滑肌细胞收缩,而高浓度NaHS抑制钙通道开放进而抑制平滑肌细胞收缩。结合NaHS对小鼠结肠平滑肌条自发性收缩活动的双向调节作用,本研究认为L型通道参与NaHS对小鼠结肠收缩的双重调节作用。
相关研究报道,NaHS生成H2S浓度约为NaHS浓度的1/3,故本研究中NaHS产生的H2S浓度为33~165 μmol/L,接近哺乳动物组织中H2S的生理浓度(1~160μmmol/L)[13-14]。因此,本研究推测正常小鼠肠道H2S对平滑肌细胞具有促进作用,从而促进结肠蠕动;而糖尿病模型小鼠由于肠道H2S合成酶表达增加,导致内源性H2S生成增加,而高浓度的H2S反向抑制L型钙通道开放,从而抑制结肠收缩,导致糖尿病模型小鼠结肠慢传输。但是本研究并未对糖尿病模型小鼠肠道产H2S的相关菌群进行检测,因此肠道菌群失衡是否导致内源性H2S生成增加需进一步研究证实。
综上所述,STZ诱导的糖尿病模型小鼠结肠传输减慢,可能与结肠内源性H2S生成增加,进而抑制结肠平滑肌细胞L型钙通道开放有关。因此,抑制内源性H2S生成可能有助于改善糖尿病患者慢性便秘。

