鳖甲-莪术药对对TGF-β1诱导的MDA-MB-231细胞侵袭转移能力及其上皮间质转化的作用及机制
朱久龙, 谢青, 黄雅珍, 朱曼荆, 骆小珊, 冯豆豆, 凌湘力, 谢甦***
(1.贵州医科大学 临床医学院,贵州 贵阳 550004;2.贵州医科大学附属医院 中医科,贵州 贵阳 550004;3.宁波市北仑区人民医院 中医科,浙江 宁波 315000)
乳腺癌是严重危害我国女性健康的恶性肿瘤,在全国女性恶性肿瘤中发病率排名第一,死亡率排名第五[1]。三阴性乳腺癌(triple negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体-2(human epidermal growth factor receptor 2,Her-2)表达均为阴性的乳腺癌,约占乳腺癌的20%,由于其高侵袭性、高复发率以及极易发生远处转移等特点,成为乳腺癌防治的重点和难点[2]。目前TNBC的重要研究方向是针对手术及放化疗术后空窗期的有效药物。药对是中医临床遣药组方的常用配伍形式,经过配伍的药对可达到增强药效、减轻毒副作用的目的。早在《神农本草经》中就有“药有阴阳配合,子母兄弟”及“七情和合”等配伍理论记载。中药药对理论研究是现代中药有效组分研究中的重要一步,在药效物质和作用机理基本清楚的前提下,建立从有效方剂出发,在明确主靶点、强化主效应、降低副效应的基础上,寻求高效可控的现代中药,并建立以组分配伍研制现代中药的新模式,是中药现代化的重要研究方向[3]。基于此,有专家提出提出“养阴散结”理论[4-5],临床选用鳖甲-莪术君药对组成中药复方,扶正与祛邪共用,滋阴与散结并举[6-7],防治乳腺癌术后和(或)放化疗后复发转移[8],使乳腺癌患者获得较好的生存质量及较长的生存周期[5]。课题前期研究发现,以鳖甲-莪术为君药对的甲术方能显著抑制乳腺癌模型小鼠的肿瘤生长,且和环磷酰胺联用能增强抗瘤作用,其可能机制与下调Wnt/β-Catenin信号通路中β-连环蛋白(β-catenin)、c-Myc以及G1/S-特异性周期蛋白-D1(cyclin D1)蛋白表达有关[9]。为探讨鳖甲-莪术药对能否通过Wnt/β-catenin信号通路影响乳腺癌上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT),从而影响乳腺癌细胞侵袭转移能力,本研究通过转化生长因子-β1(transforming growth factor-β1,TGF-β1)诱导TNBC细胞MDA-MB-231,模仿增强其侵袭转移能力、促进其发生EMT进程的肿瘤生长环境,探究鳖甲-莪术药对对含药血清在抑制TGF-β1诱导的MDA-MB-231细胞侵袭转移能力及其抗EMT进程中是否优于单药使用,以及药对配伍规律及深层机制。
1 材料与方法
1.1 材料
1.1.1实验细胞株 人源性三阴性乳腺癌MDA-MB-231细胞株,购自上海中乔新舟生物科技有限公司。
1.1.2实验动物 SPF级、6周龄、SD雌性、体质量(250±20)g的大鼠40只,购于长沙天勤生物科技有限公司,许可证号SCXK(湘)2019-0014。
1.1.3实验药品和试剂 鳖甲颗粒、莪术颗粒购自广东一方制药有限公司,紫杉醇购自美国MedChemExpress (MCE)公司(货号HY-B0015/CS-1145)。DMEM高糖培养基(美国Gibco公司,C11995500BT)、胎牛血清(以色列BI公司,04-001-ACS)、二甲基亚砜(DMSO,北京索莱宝科技有限公司,D8370)、0.25%胰蛋白酶(含EDTA,美国Gibco公司,25200-056)、青、链霉素双抗(美国Hyclone公司,SV30010)、CCK8试剂盒(上海东仁化学科技有限公司,CK04)、高效RIPA裂解液组织/细胞(北京索莱宝科技有限公司,R0010)、甘油醛-3-磷酸脱氢酶(GAPDH)兔多克隆抗体(武汉三鹰生物技术有限公司,10494-1-AP)、抗波形蛋白(vimentin)抗体 (EPR3776,英国Abcam公司,ab92547)、E钙黏蛋白(E-cadherin)兔多克隆抗体(武汉三鹰生物技术有限公司,20874-1-AP)、兔抗Wnt 3a多克隆抗体(武汉三鹰生物技术有限公司,bs-22503R)、N钙黏蛋白(N-cadherin)兔多克隆抗体(武汉三鹰生物技术有限公司,bs-22503R)、HRP标记山羊抗兔IgG二抗(武汉普美克生物公司,PMK-014-090)。
1.1.4实验仪器 SW-CJ-2FD 超净工作台(苏州净化设备有限公司)、Model 310恒温CO2培养箱(美国Thermo公司)、CKX41倒置显微镜(日本Olympus公司)、Allegra 64R Centrifuge 台式高速冷冻离心机(美国Beckman Coulter公司)、多功能酶标仪(美国BioTek公司)、MinPROTEAN®Tetra电泳槽(美国BIO-RAD公司 )、MiniVE电泳仪(美国GE公司)、NanoDrop 2000C超微量分光光度计(美国Thermo公司)、ProFlexTM3 x 32孔逆转录PCR仪(美国Thermo公司)、ViiA7Dx荧光定量PCR仪(美国ABI公司 )、ChemiScope3000Mini化学发光成像系统(上海勤翔科学仪器有限公司)。
1.2 实验方法
1.2.1血清制备 40只SPF级雌性SD大鼠随机分成空白组、鳖甲组、莪术组、鳖甲-莪术组,共4组,每组10只。根据“人和动物间按体表面积折算的等效剂量比值表”换算大鼠药量:大鼠每日给药剂量(g/kg)=成人每日用量(g/kg)×70(kg)×0.018(大鼠等效系数)/0.2(kg)×10。空白组予以蒸馏水灌胃10 mL/kg,每天2次,连续7 d;鳖甲组、莪术组、鳖甲-莪术组分别予以鳖甲(含生药量6 g/kg)、莪术(含生药量3 g/kg)、鳖甲-莪术药对(含生药量9 g/kg)灌胃10 mL/kg,每天2次,连续7 d。末次给药前,禁食不禁水12 h;末次给药后1.5 h,腹腔注射2%戊巴比妥钠麻醉大鼠,用一次性真空采血管采取心脏全血,静置、分离、过滤除菌,-20 ℃保存备用。
1.2.2细胞培养 将MDA-MB-231细胞用含10%胎牛血清、1%双抗的DMEM混合培养基置于饱和湿度、5%CO2、37 ℃恒温细胞培养箱中培养,隔日换液,当细胞生长到80%时进行消化传代,进行后续实验。
1.2.3含药血清分组 空白组,30%空白血清+DMEM高糖培养基;单诱导组,0.25%TGF-β1+30%空白血清+DMEM高糖培养基;鳖甲组,0.25%TGF-β1+30%鳖甲含药血清+DMEM高糖培养基;莪术组,0.25%TGF-β1+30%莪术含药血清+DMEM高糖培养基;鳖甲-莪术组,0.25%TGF-β1+30%鳖甲-莪术含药血清+DMEM高糖培养基;紫杉醇组,0.25%TGF-β1+30%空白血清+DMEM高糖培养基+紫杉醇(IC50浓度为890 nmol/L)。
1.2.4CCK-8法检测细胞增殖能力 将细胞以5× 103个/孔的密度接种于96孔培养板中,每组4个复孔。待24 h细胞贴壁后弃培养基,分别用各组含药血清培养基培养96 h,在相应时间点向96孔板中每孔加入CCK-8溶液10 μL和DMEM培养基90 μL,培养箱中孵育1 h后,采用多功能酶标仪在37 ℃、波长450 nm处测定各组吸光度(OD)值,细胞抑制率=(对照组-实验组)/(对照组-空白组)×100%。
1.2.5划痕实验检测细胞迁移能力 将密度为1×106个/mL的细胞均匀铺板于6孔板内,待24 h细胞贴壁后弃培养基,用200 μL灭菌枪头划线,PBS缓冲液洗净划线上的残存细胞后加入各组含药血清培养基,使用电子显微镜分别于0、12及24 h拍照并观察细胞迁移能力的变化。
1.2.6Transwell小室实验检测细胞侵袭能力 -80 ℃冰箱取出保存的基质胶,液化后与DMEM培养基按照1 ∶6比例稀释,于每个Transwell板上室加入50 μL,放入培养箱孵育4 h,待胶成为固态。按“1.2.4”方案干预细胞96 h后消化细胞并计数,用DMEM培养基配置成密度为1×104个/mL的细胞悬液,每个上室均匀加入200 μL,下室加入含10%胎牛血清的培养基800 μL/孔,于37 ℃、5%CO2培养箱内培养24 h。取出Transwell板,PBS缓冲液涮洗、晾干,4%多聚甲醛固定30 min,结晶紫染色30 min,PBS缓冲液再次涮洗、晾干,棉球擦去小室表面细胞和结晶紫,100倍倒置显微镜下观察各组细胞穿过小室情况,每孔随机取5个视野,统计细胞数目,计算平均值。
1.2.7Western blot法检测E-cadherin、Vimentin、N-cadherin、Wnt3a、β-catenin蛋白表达 按上述“1.2.4”方案干预细胞96 h后收集细胞,冰上裂解30 min,超声破碎仪破碎,4 ℃、12 000 r/min离心15 min,取上清,提取总蛋白,BCA试剂盒检测蛋白浓度,将各组蛋白浓度调整为30 g/L,加入Loading Buffer ,100 ℃、10 min煮沸变性。10% SDS-PAGE凝胶电泳,PVDF膜转膜,5 %脱脂牛奶室温封闭1 h,加入相应一抗(稀释比1 ∶10 000至1 ∶800) 4 ℃孵育过夜,加入二抗(稀释1 ∶5 000)室温孵育1 h,TBST缓冲液洗膜3次,ECL化学发光法曝光,条带保存,Image J软件分析条带灰度值,计算目标蛋白表达量。
1.2.8RT-qPCR检测E-cadherin、Vimentin、N-cadherin、Wnt3a及β-catenin mRNA表达 按上述“1.2.4”方案干预细胞96 h后收集细胞,Trizol法提取细胞总RNA,Nano-drop 2000c测定各组总RNA纯度和浓度,逆转录试剂盒将总RNA反转录成cDNA,逆转录反应条件为:25 ℃、5 min,55 ℃、15 min,85 ℃、5 min。以cDNA为模板,使用Hieff UNICON® Universal Blue qPCR SYBR Green Master Mix试剂盒进行加样,样品在Applied Biosystems7500中进行RT-qPCR反应,引物由生工生物工程 (上海) 有限公司合成,引物序列见表1。反应程序:95 ℃、2 min,95 ℃、10 s,60 ℃、32 s,循环40次;95 ℃、15 s,60 ℃、1 min,95 ℃、15 s。记录各组Ct值,mRNA以GAPDH为内参,采用2-ΔΔCt法计算目的基因的相对表达量。
1.3 统计学分析


表1 引物序列Tab.1 Primer sequence
2 结果
2.1 TGF-β1诱导MDA-MB-231细胞EMT水平上调
细胞增殖抑制率结果表明,干预细胞24、48 h后,与空白组相比,单诱导组细胞增殖抑制率降低(P<0.05)。见图1A。24 h细胞迁移率结果表明,与空白组相比,单诱导组细胞迁移率增加(P<0.05),见图1B。Transwell小室实验表明,干预细胞48 h后,与空白组相比,单诱导组细胞迁徙数目增多(P<0.05),提示细胞侵袭能力增强。见图1C。Western blot实验表明,与空白组相比,单诱导组细胞E-cadherin蛋白表达下降,Vimentin、 N-cadherin蛋白表达上升(P<0.05)。见图1D-1E。综上结果,提示TGF-β1可增强MDA-MB-231细胞增殖、迁移和侵袭能力,促进其EMT进程。
2.2 含药血清对MDA-MB-231细胞增殖能力的影响
干预细胞96 h后,与单诱导组比较,各含药血清组MDA-MB-231细胞的增殖抑制率均有不同程度的升高,表明各含药血清组均能抑制细胞增殖(P<0.05)。组间比较,紫杉醇组对MDA-MB-231细胞的增殖抑制率最高,鳖甲-莪术组对MDA-MB-231细胞的增殖抑制率高于鳖甲组和莪术组(P<0.05),见图2。实验表明,鳖甲-莪术药对抑制 MDA-MB-231细胞增殖能力优于鳖甲、莪术单药使用。
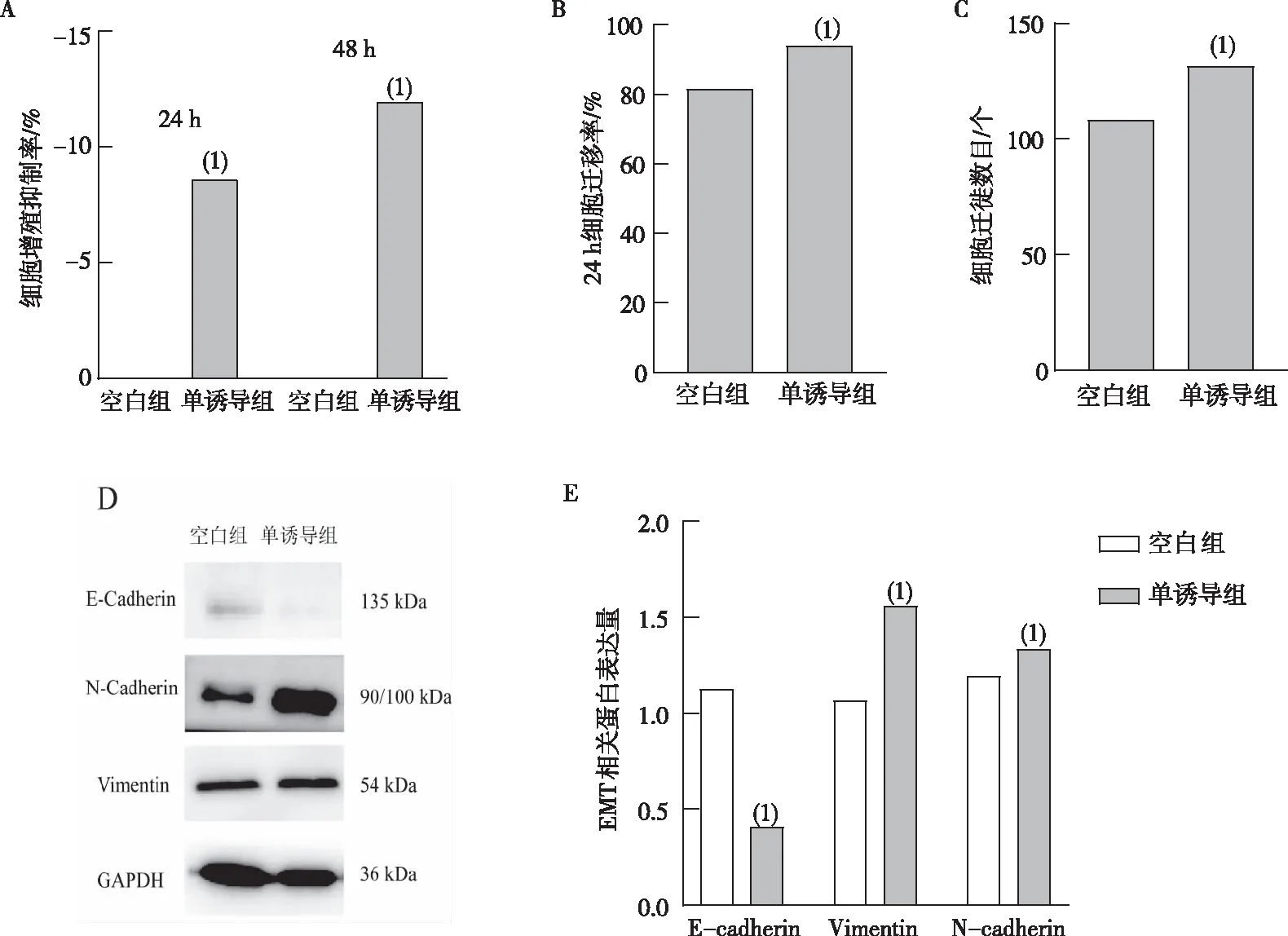
注:A为MDA-MB-231细胞增殖抑制率结果,B为MDA-MB-231细胞迁移率结果,C为MDA-MB-231细胞侵袭数目,D为E-cadherin、Vimentin、N-cadherin蛋白表达,E为E-cadherin、Vimentin、N-cadherinm 蛋白表达统计结果;(1)与空白组比较,P<0.05。图1 空白组与单诱导组MDA-MB-231细胞侵袭转移能力Fig.1 Invasion and metastasis ability of MDA-MB-231 between blank group and single induction group
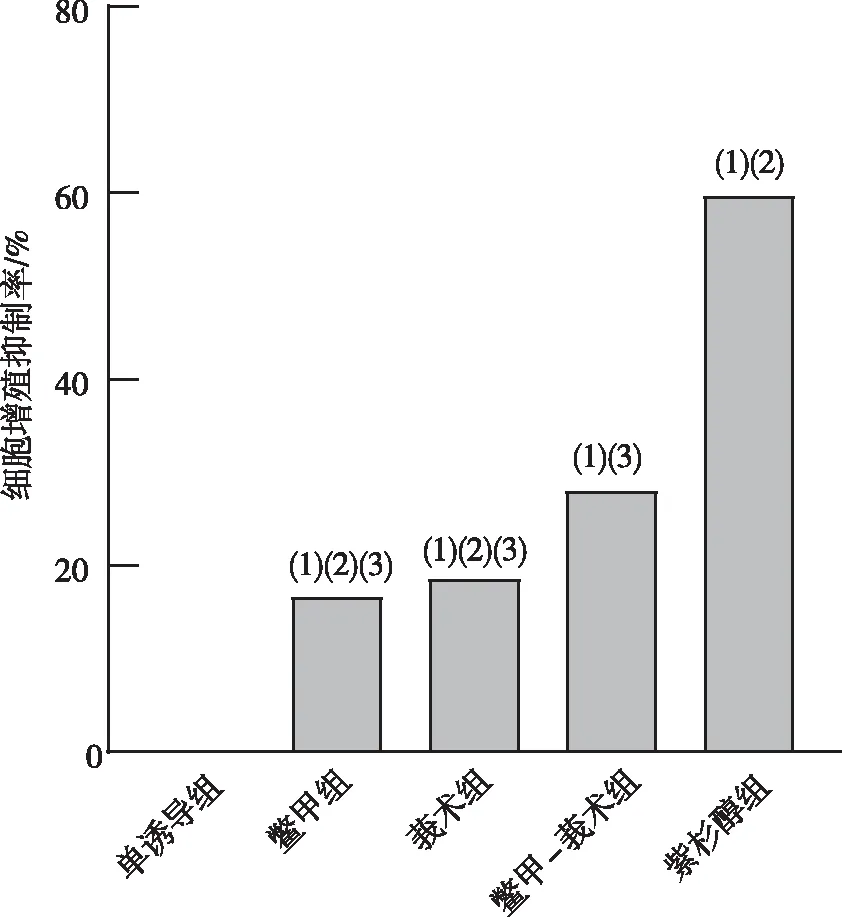
注:(1)与单诱导组比较,P<0.05;(2)与鳖甲-莪术组比较,P<0.05;(3)与紫杉醇组比较,P<0.05。图2 含药血清组对MDA-MB-231细胞的增殖抑制率Fig.2 Proliferation inhibition rate of MDA-MB-231 cells in each experimental group
2.3 含药血清对MDA-MB-231细胞迁移能力的影响
与单诱导组相比,干预细胞24 h后,各含药血清组MDA-MB-231细胞迁移率均有不同程度的降低(P<0.05),表明各含药血清组均能抑制MDA-MB-231细胞迁移能力。组间比较,紫杉醇组MDA-MB-231细胞迁移率最低(P<0.05),提示其抑制MDA-MB-231细胞迁移作用最佳;鳖甲-莪术组细胞迁移率低于鳖甲、莪术组(P<0.05),表明鳖甲-莪术药对对MDA-MB-231细胞迁移能力的抑制效果优于鳖甲、莪术单用。见图3。实验表明,鳖甲-莪术药对抑制MDA-MB-231细胞迁移作用优于鳖甲、莪术单药使用。
2.4 含药血清对MDA-MB-231细胞侵袭能力的影响
与单诱导组相比,各含药血清组的MDA-MB-231细胞迁徙数目均有不同程度的减少(P<0.05),表明各含药血清组均能抑制MDA-MB-231细胞侵袭能力。组间比较,紫杉醇组细胞迁徙数目最少(P<0.05),提示其抑制细胞侵袭作用最佳;鳖甲-莪术组细胞迁徙数目少于鳖甲组、莪术组(P<0.05),表明鳖甲-莪术药对对细胞侵袭能力的抑制效果优于鳖甲、莪术单用。见图4。实验表明,鳖甲-莪术药对抑制MDA-MB-231细胞侵袭作用优于鳖甲、莪术单药使用。
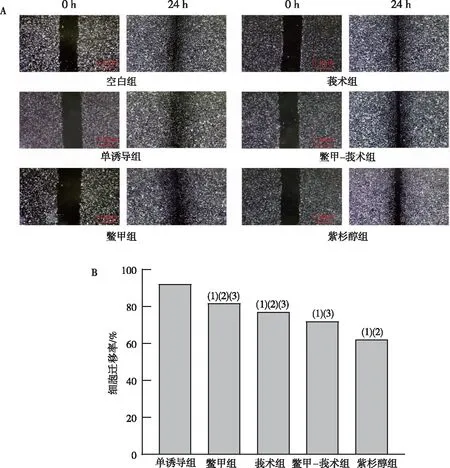
注:A为划痕实验结果,B为各组细胞迁移率;(1)与单诱导组比较,P<0.05;(2)与鳖甲-莪术组比较,P<0.05;(3)与紫杉醇组比较,P<0.05。图3 各含药血清组对 MDA-MB-231细胞迁移能力的影响Fig.3 Effect of each experimental group on the migration ability of MDA-MB-231 cells
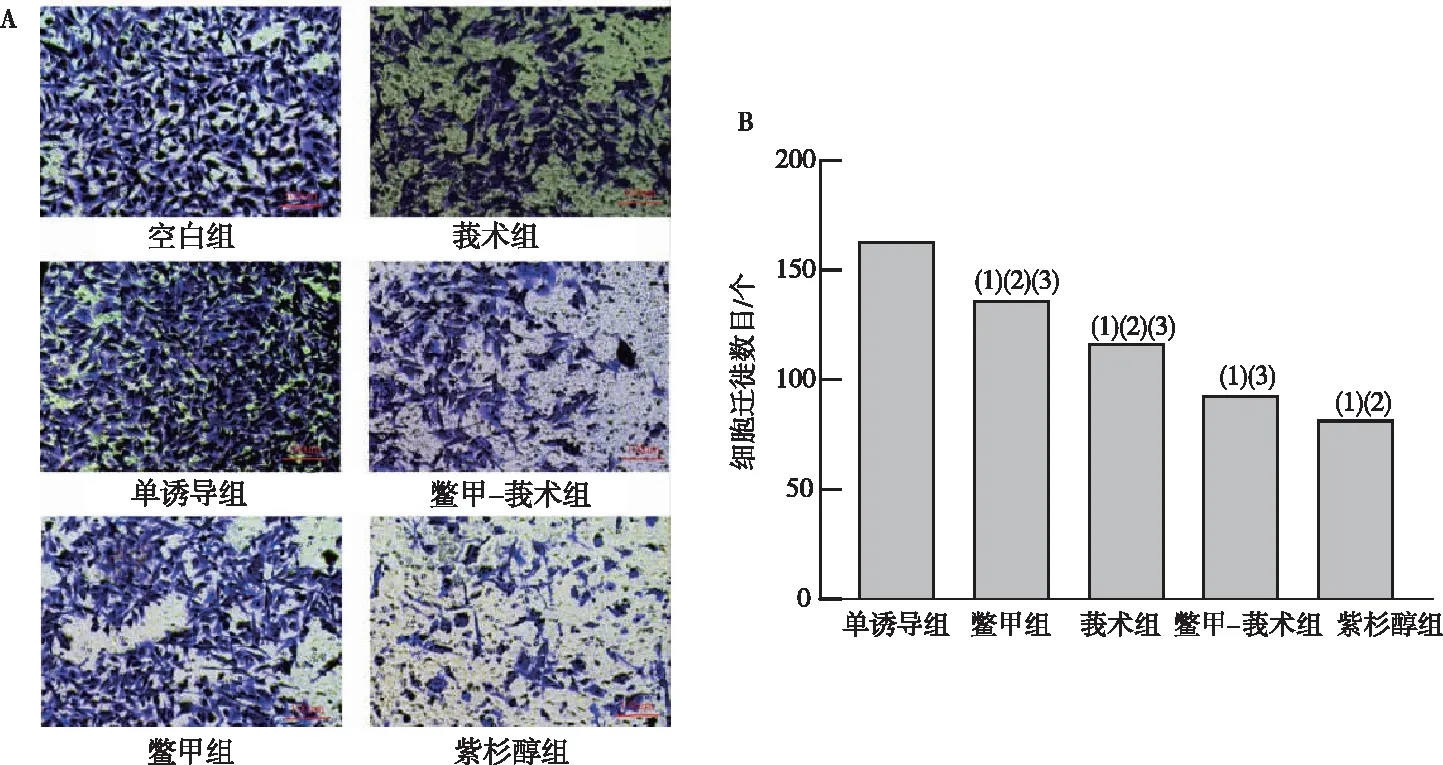
注:A为侵袭实验结果,B为侵袭细胞数目;(1)与单诱导组比较,P<0.05;(2)与鳖甲-莪术组比较,P<0.05;(3)与紫杉醇组比较,P<0.05。图4 各含药血清组对 MDA-MB-231细胞侵袭能力的影响Fig.4 Effect of each experimental group on the invasive ability of MDA-MB-231 cells
2.5 含药血清对EMT相关蛋白E-cadherin、Vimentin、N-cadherin蛋白表达的影响
Western blot实验表明,与单诱导组比较,各含药血清组均能上调E-cadherin蛋白表达,下调Vimentin、N-cadherin蛋白表达(P<0.05)。组间比较,鳖甲-莪术组E-cadherin蛋白表达最高;Vimentin、N-cadherin蛋白表达,紫杉醇组表达最低,鳖甲-莪术组表达低于鳖甲组、莪术组(P<0.05)。见图5A、图5C。
2.6 各含药血清组对Wnt/β-catenin信号通路中Wnt3a、β-catenin蛋白表达的影响
Western blot实验表明,与单诱导组比较,各含药血清组均能下调Wnt3a、β-catenin蛋白表达水平(P<0.05)。组间比较,紫杉醇组Wnt3a、β-catenin蛋白表达最低,鳖甲-莪术组Wnt3a、β-catenin蛋白表达低于鳖甲组、莪术组(P<0.05)。见图5B、图5D。
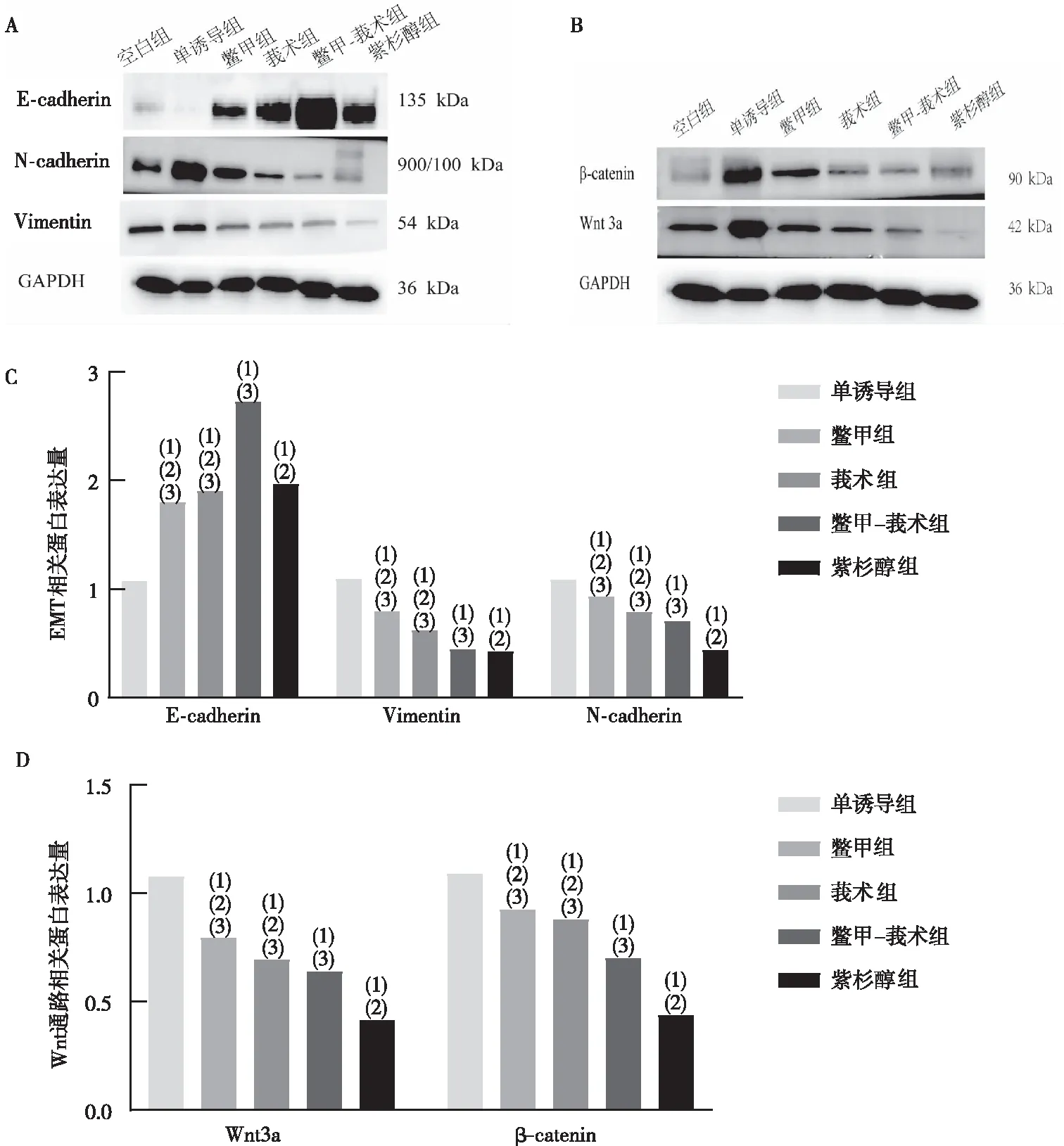
注:A为EMT相关蛋白图,B为Wnt通路相关蛋白图,C为EMT相关蛋白表达量,D为通路相关蛋白表达量;(1)与单诱导组比较,P<0.05;(2)与鳖甲-莪术组比较,P<0.05;(3)与紫杉醇组比较,P<0.05。图5 含药血清对MDA-MB-231细胞中EMT及Wnt通路中相关蛋白表达的影响Fig.5 Effect of drug containing serum on EMT and Wnt signaling pathway-related protein expression in MDA-MB-231 cells
2.7 含药血清对EMT相关E-cadherin、Vimentin、N-cadherin mRNA表达的影响
RT-qPCR实验表明,与单诱导组比较,各含药血清组均能上调MDA-MB-231细胞中E-cadherin、下调Vimentin、N-cadherinmRNA表达水平(P<0.05)。组间比较,鳖甲-莪术组E-cadherinmRNA表达最高;Vimentin、N-cadherinmRNA表达方面,紫杉醇组最低,鳖甲-莪术组表达低于鳖甲组、莪术组(P<0.05)。见图6A。
2.8 含药血清对Wnt/β-catenin信号通路中Wnt3a、β-catenin mRNA表达的影响
RT-qPCR实验表明,与单诱导组比较,各含药血清均能下调MDA-MB-231细胞中Wnt3a、β-cateninmRNA表达水平(P<0.05)。组间比较,紫杉醇组Wnt3amRNA表达最低,鳖甲-莪术组β-cateninmRNA表达最低,鳖甲-莪术组表达低于鳖甲组、莪术组(P<0.05)。见图6B。
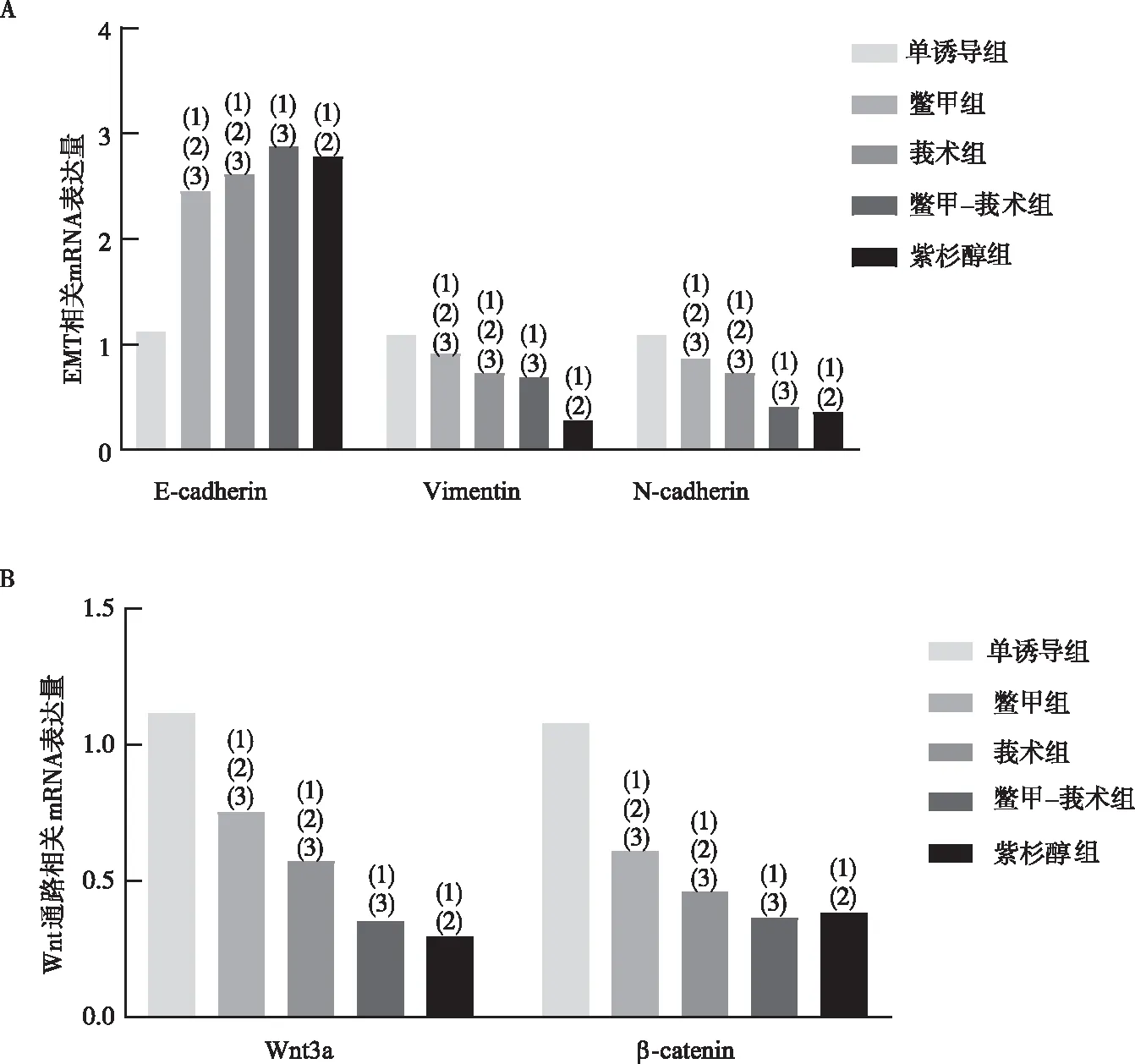
注:A为EMT相关mRNA表达量,B为Wnt通路相关mRNA表达量;(1)与单诱导组比较,P<0.05;(2)与鳖甲-莪术组比较,P<0.05;(3)与紫杉醇组比较,P<0.05。图6 含药血清对MDA-MB-231细胞中EMT和Wnt通路中相关mRNA表达的影响Fig.6 Effect of drug containing serum on EMT and Wnt signaling pathway-related mRNA expression in MDA-MB-231 cells
3 讨论
乳腺癌属于中医学“乳岩”“石岩”等范畴,古今医家在治疗上多有各自的心得和见解。有学者认为,在肿瘤发病上,正气不足是关键因素,痰、瘀、湿、郁、热毒是其病理基础,女性乳腺癌亦是如此;乳腺癌病机实质是“阴中之阳”,“阳胜则阴病”,其亢烈之性必灼伤真阴,且“女子以肝为先天,以阴血为本”,术后女性病人正气大伤,阴阳俱虚,加之放化疗的不良反应,导致阴阳失衡,严重耗伤真阴;此时患者余邪未清,正气亦无力鼓邪外出,痰、湿、瘀、热、郁夹杂结聚,以致生活质量不佳,预后不良;基于真阴不足、瘀毒结聚的乳腺癌病机,提出了“养阴散结”的理论[10]。临床中多选用以鳖甲-莪术为君药对组方治疗肿瘤[11],鳖甲味甘、咸、性寒,入肝肾经,大补真阴,软坚散结,滋阴潜阳,除骨蒸,退虚热;莪术味辛、苦、性温,入肝脾经,苦泄辛散温通, 即入血分, 又入气分, 能破血散瘀, 消癥化积, 行气止痛。二者配伍,“阴阳双消,滋阴起亟”[16],既能滋阴潜阳,辅助正气,又能增强软坚散结, 破血化瘀消癥之力,消补结合,攻补兼施,达到扶正不留邪、祛邪不伤正的目的。
EMT是三阴性乳腺癌扩散转移的重要途径[12]。EMT是指上皮细胞失去黏附特性,从而获得间质细胞特性,极性和细胞连接丧失,从而获得运动和迁移能力[13],使细胞从原发灶脱离并向基质浸润,通过血道或淋巴道向远处转移的过程[14]。临床通过对乳腺癌细胞和乳腺癌组织的分析,发现三阴性乳腺癌中普遍存在Vimentin、N-cadherin高表达,以及E-cadherin低表达[15]。研究表明,抑制EMT可有效降低TNBC复发转移的风险[16]。TGF-β1可促进乳腺癌EMT进程[17]。在体内,TGF-β1可刺激上皮细胞的EMT,促进EMT的进展[18]。在肿瘤细胞生长早期,TGF-β1的主要作用是通过抑制细胞周期G1的进展来控制肿瘤细胞增殖[19],而当肿瘤细胞进入不可控生长阶段时,会对这种抑制效应失去敏感性[20],此外,这些肿瘤细胞开始分泌TGF-β1,并促进血管生成、增加肿瘤细胞稳定性,并创造出一个有利于肿瘤生长和转移的微环境,提高肿瘤细胞的侵袭性[21]。研究表明,淋巴结转移的乳腺癌患者TGF-β1表达水平明显高于无淋巴结转移者,在TGF-β1诱导条件培养基中培养的肿瘤细胞表现出更高的增殖和运动能力[22]。Wnt/β-catenin信号通路可介导乳腺癌发生EMT[23]。当Wnt信号激活通路后,β-catenin进入细胞核与转录因子形成转录复合物,引起下游靶基因的转录[24]。β-catenin向细胞核内聚集引起E-cadherin失去cadherin-catenin锚定连接而破坏E-cadherin/β-catenin复合体的稳定性[25],E-cadherin失去黏附功能,导致细胞分散,移动力增加,获得侵袭性间质表型,促进EMT进程[26]。研究表明,β-catenin与乳腺癌的侵袭迁移密切相关,侵袭型乳腺癌较非侵袭型相比β-catenin表达明显增加,通过激活Wnt/β-catenin信号通路可降低E-cadherin表达[27]。因此,抑制Wnt/β-catenin信号通路的激活是影响EMT进程的重要途径。
紫杉醇具有明确的细胞抑制作用,能够阻滞细胞有丝分裂,并能通过抑制Wnt/β-catenin 信号通路抗乳腺癌细胞侵袭转移[28]。紫杉醇组作为阳性对照组,可增加实验的科学性和可信度。选择半数抑制浓度(IC50)作为干预浓度,是因为小剂量紫杉醇具有促进乳腺癌细胞增殖的作用[29],而半数抑制浓度的抑制率就是50%,可以排除紫杉醇浓度干扰所致的实验结果错误。本研究中,TGF-β1促进了MDA-MB-231细胞的增殖、侵袭转移能力及EMT进程。各含药血清组均能抑制MDA-MB-231细胞的增殖、迁移及侵袭能力,上调E-cadherin,下调Vimentin、N-cadherin、Wnt3a、β-catenin蛋白及mRNA表达,且鳖甲-莪术药对联用具有增强药效的作用,效果均优于鳖甲、莪术单药使用。鳖甲-莪术药对可能是通过下调Wnt3a、β-catenin,从而减少Wnt/β-catenin通路中关键的信号介质,进而影响乳腺癌细胞的EMT进程及其侵袭转移能力。
综上,根据中医“养阴散结”理论,鳖甲-莪术药对经过配伍后药效增强,其效果优于单药使用,其对TGF-β1诱导MDA-MB-231细胞侵袭转移能力的抑制作用,可能机制为下调Wnt/β-catenin信号通路、抑制其EMT。

