槲皮素通过PI3K/Akt/mTOR通路促进缺血性脑卒中小鼠康复的机制
李秋菊, 江毅, 赵仁超, 庄绪娟
(山东第一医科大学附属青岛医院 & 青岛市城阳区人民医院 神经内科, 山东 青岛 266109)
缺血性脑卒中是因多种因素作用而导致的局部脑组织缺血缺氧性坏死,进而造成神经功能缺失,具有较高的临床致残率和致死率[1]。目前临床对于缺血性脑卒中患者的治疗主要为溶栓、血管介入及抗血小板聚集等综合性治疗,虽然能够在一定程度上改善脑梗死患者梗死灶部位的血液供应,但即使再通血管后,脑组织因缺血-再灌注而导致的损伤也会对患者远期脑功能恢复产生明显的不良影响[2]。目前缺血性脑卒中的主要发病人群为18~50岁、且发病率逐年升高,导致社会主要劳动力损失,社会负担增大[3]。因此积极探究缺血性脑卒中发生的分子机制,并采集有效治疗措施,对促进患者脑功能恢复,降低临床致残率和致死率有十分重要的意义。槲皮素为具有抗氧化特性的天然膳食黄酮,既往研究中发现其能够缓解炎症反应和氧化应激反应,减轻组织水肿,缓解脏器损伤[4]。杨青丽等[5]发现槲皮素可保护缺氧缺血性脑损伤神经元细胞;黄超等[6]指出槲皮素具有拮抗炎症反应和降低氧化应激反应的效果,能够对神经细胞凋亡途径进行抑制,可改善创伤性脑损伤患者的临床疗效;磷脂酰肌醇-3(phosphatidylinositol3-kinase,PI3K)/蛋白激酶B(acid,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路为经典生物信号通路,曾有学者通过激活该信号通路,提高了脓毒症小鼠急性肺损伤的内源性保护机制[7],因此本文分析槲皮素通过PI3K/Akt/mTOR通路促进缺血性卒中小鼠康复的效果,以期能为缺血性脑卒中的临床治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物 50只SPF级C57BL/6小鼠,均为雄性,6~8周,体质量为20~25 g、平均(22.19±1.32) g,均由成都医学院实验动物中心购入,动物许可证号SCXK(川)2021-003。实验前7 d所有小鼠均进行适应性喂养,设置光照12 h/d,湿度为40%~55%,室内温度21~22 ℃,自由进食进水。
1.1.2主要仪器 电子显微镜(EM ACE900型,德国Leica公司)、蛋白电泳仪(1659001型,美国Bio-Rad公司)、手动轮转式切片机(RM2125RTS型,德国Leica公司)、酶标仪(Fax-20100型,美国INStat公司)凝胶成像仪(GIS-500型,杭州米欧仪器有限公司)。
1.1.3主要试剂 槲皮素(上海源叶生物科技有限公司)、NVP-BEZ235(美国BioVision)、酶联免疫吸附试剂盒(上海酶联生物科技有限公司)、苏木素-伊红(HE)染色试剂盒(上海碧云天生物科技有限公司)、β-actin鼠抗和十二烷基硫酸钠(美国Sigma公司)、蛋白提取试剂盒及BCA蛋白定量试剂盒(北京中山金桥生物科技有限公司)、RIPA裂解液(上海碧云天公司)、PI3K、Akt、mTOR、磷酸化(phosphoric,p-)-PI3K、p-AKT、p-mTOR鼠抗和辣根过氧化物酶标记羊抗鼠IgG二抗(美国Abcam公司)。
1.2 研究方法
1.2.1分组、给药及线栓法建模 50只小鼠随机分为对照组、模型组、槲皮素组、通路抑制组及联合组,每组10只;参考文献[8],槲皮素组每日灌胃200 mg/kg槲皮素,通路抑制组每日灌胃60 mg/kg NVP-BEZ235,联合组每日灌胃200 mg/kg槲皮素和60 mg/kg NVP-BEZ235,模型组和对照组每日灌胃等体积生理盐水,均给药7 d;50只小鼠均术前禁食6 h,按照0.3 g/kg体质量腹腔注射10%水合氯醛麻醉,将小鼠以仰卧位固定,消毒后切开颈前正中,模型组、槲皮素组、通路抑制组及联合组参考文献[9]复制大鼠脑缺血再灌注损伤模型。对照组小鼠术前禁食6 h,按照0.3 g/kg体质量腹腔注射10%水合氯醛进行麻醉,将小鼠以仰卧位固定,消毒后切开颈前正中,不对血管做任何操作。
1.2.2学习记忆能力Morris水迷宫实验测评 (1)定位航行实验:将大鼠面向池壁由不同象限放入小鼠,开展Morris水迷宫实验,使小鼠寻找第1象限水平面下1 cm的平台,其所消耗的时间为逃逸潜伏期,设置最大限时为120 s,超出者计为120 s,每只小鼠每日训练4次,共5 d,取平均值为学习成绩。(2)空间探索实验:Morris水迷宫实验最后1 d,拆除平台,将与平台正对的象限作为小鼠入水点,并自由游泳120 s,记录该时间内各小鼠穿过平台的次数和在目标象限内停留的时间,以此衡量记忆能力。
1.2.3脑功能缺陷评分 依据Vemuganti等[10]的方法对小鼠脑功能缺陷程度进行5分制评估,1分为提尾左前肢屈曲,2分为行走向左侧转圈,3分为向左侧倾斜,4分为无法自发行走、意识减退,5分为缺血相关死亡。
1.2.4脑梗死灶体积 给药7 d后,麻醉状态下采用断头法处死小鼠,快速取出脑组织,制作厚度为1.5 mm的冠状切片,将其置于2%氯化三苯基四氮唑内37 ℃孵育15 min,染色后使用扫描仪对脑片进行扫描,并使用Image pro plus软件分析脑片内梗死体积。
1.2.5炎性因子和氧化应激因子 取小鼠海马组织0.5 g,低温融化后加入9倍体积预冷的PBS匀浆,13 000 r/min离心15 min,取上清液,采用酶联免疫吸附法检测白细胞介素-6(interleukin- 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)水平。
1.2.6PI3K/ Akt/ mTOR蛋白及p-PI3K、p-AKT、p-mTOR水平 采用Western blot法检测,取海马组织0.5 g,制备细胞悬液,以12 000 r/min离心10 min,取沉淀加入RIPA裂解液,重悬细胞,置于冰上裂解30 min,以12 000 r/min离心10 min,加入Loading Buffer缓冲液200 μL,置于100 ℃水浴内煮沸10 min,采用BCA法测量蛋白浓度,采用SDS-PAGE电泳提取总蛋白,将蛋白移至PVDF膜后放入TBST溶液内洗膜5 min,加一抗(1 ∶1 000),4 ℃恒温箱内孵育过夜,TBST洗膜3次,加二抗(1 ∶2 000),封闭,曝光,以β-actin为内参,分析灰度值,获得蛋白表达水平,每组均重复3次。
1.3 统计学方法

2 结果
2.1 学习记忆能力
与对照组比较,其余各组小鼠的穿越原平台次数、目标象限停留时间百分比均减少,逃逸潜伏期均延长,差异有统计学意义(P<0.05);与模型组比较,通路抑制组小鼠穿越原平台次数及目标象限停留时间百分比减少、逃逸潜伏期延长,槲皮素组小鼠穿越原平台次数及目标象限停留时间百分比增加、逃逸潜伏期缩短,差异有统计学意义(P<0.05)。联合组与模型组比较差异无统计学意义(P>0.05)。见表1。
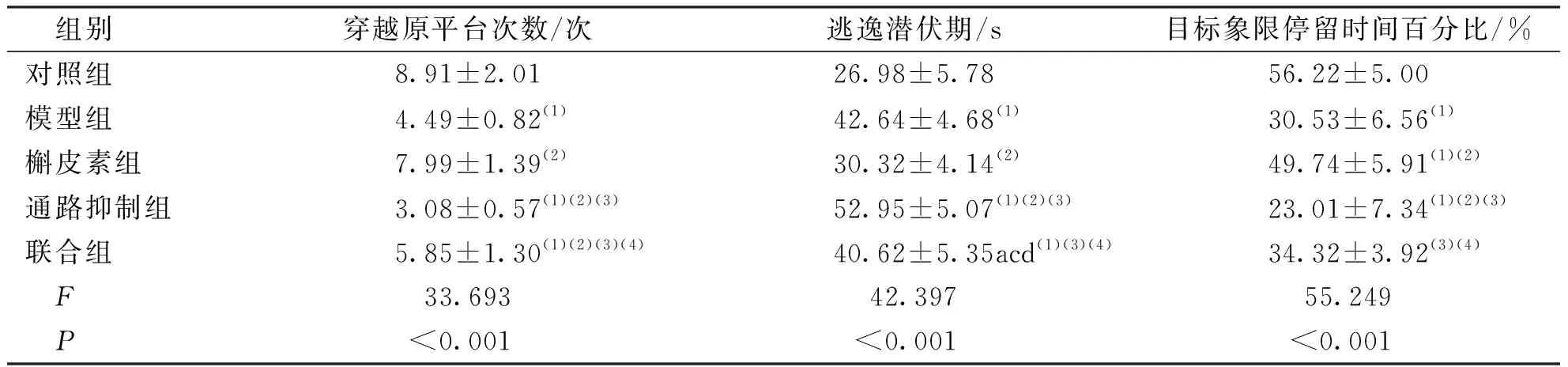
表1 各组小鼠学习记忆能力比较Tab.1 Comparison of learning and memory ability in each group
2.2 脑功能缺陷评分和脑梗死灶体积
与对照组比较,其余各组小鼠脑功能缺陷评分均升高,差异有统计学意义(P<0.05);与模型组比较,通路抑制组小鼠脑功能缺陷评分和脑梗死灶体积均升高、槲皮素组降低,差异有统计学意义(P<0.05)。联合组与模型组比较差异无统计学意义(P>0.05)。见表2。
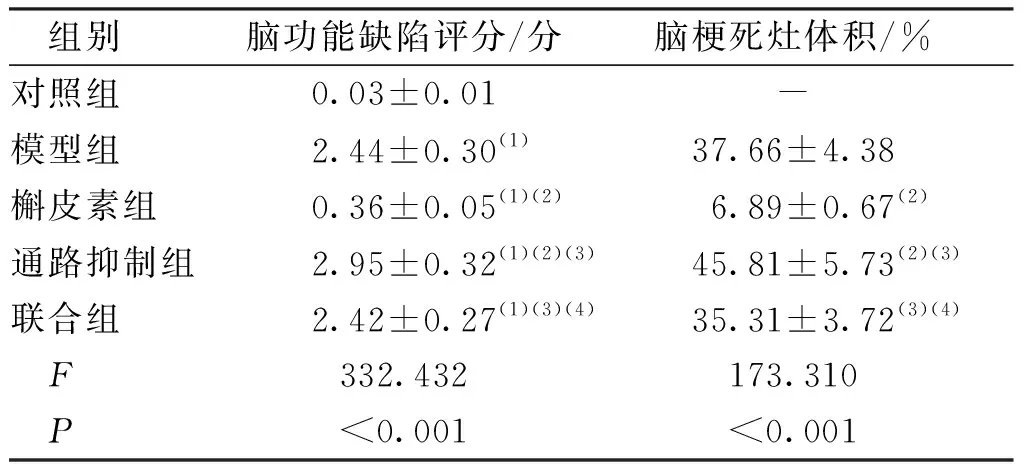
表2 各组小鼠脑功能缺陷评分和脑梗死灶体积比较Tab.2 Comparison of brain function deficit scores and cerebral infarction volumes in each group
2.3 海马组织炎性因子水平
与对照组相比,其余各组小鼠海马组织IL-6、TNF-α水平均升高,差异有统计学意义(P<0.05);与模型组比较,通路抑制组小鼠海马组织IL-6、TNF-α水平均升高,槲皮素组降低,差异有统计学意义(P<0.05)。联合组与模型组比较差异无统计学意义(P>0.05)。见表3。
2.4 海马组织氧化应激因子水平
与对照组比较,其余各组小鼠海马组织的MDA水平升高、SOD水平降低,差异有统计学意义(P<0.05);与模型组相比,通路抑制组小鼠海马组织的MDA水平升高,SOD水平降低,槲皮素组则相反,差异有统计学意义(P<0.05)。联合组与模型组比较差异无统计学意义(P>0.05)。见表4。
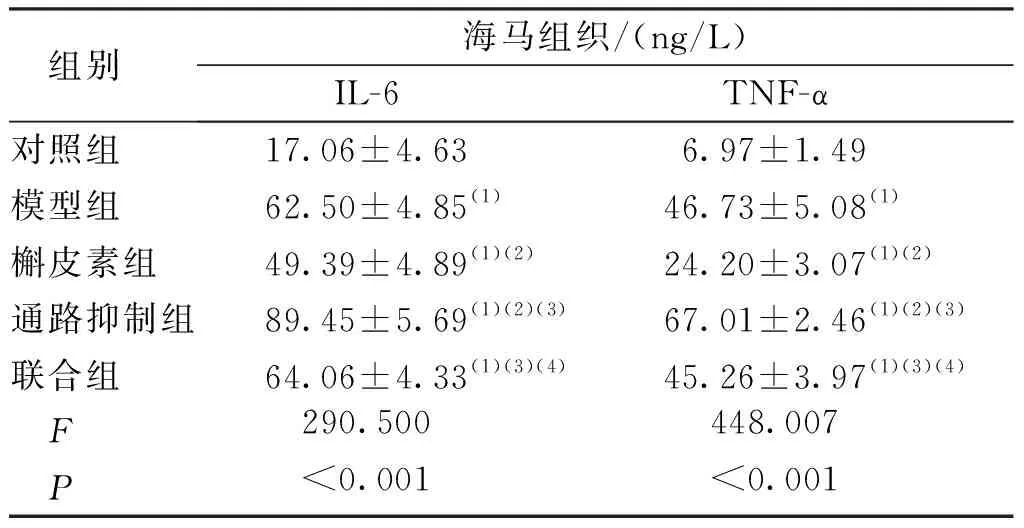
表3 各组小鼠海马组织炎性因子水平比较Tab.3 Comparison of the levels of inflammatory factors in the hippocampus in each group
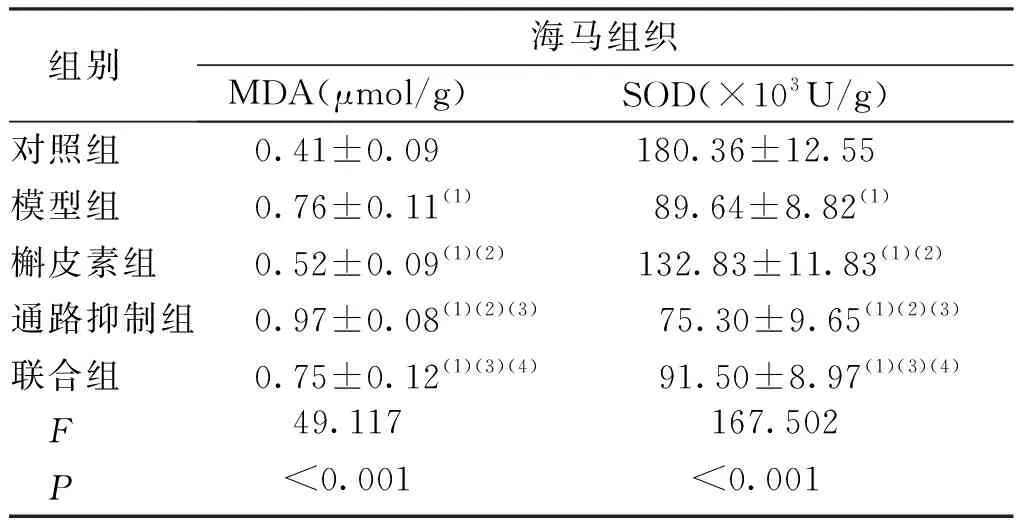
表4 各组小鼠海马组织氧化应激因子水平比较Tab.4 Comparison of oxidative stress factor levels in the hippocampus in each group
2.5 海马组织PI3K、AKT、mTOR蛋白表达水平
与对照组比较,其余各组小鼠海马组织的PI3K、AKT、mTOR蛋白表达水平降低,差异有统计学意义(P<0.05);与模型组比较,通路抑制组小鼠海马组织的PI3K、AKT、mTOR蛋白表达水平降低,槲皮素组升高,差异有统计学意义(P<0.05)。联合组与模型组比较差异无统计学意义(P>0.05)。见图1和表5。

图1 各组小鼠海马组织PI3K、AKT、mTOR蛋白表达灰度值Fig.1 The protein expression levels of PI3K, AKT, and mTOR in mouse hippocampus in each group
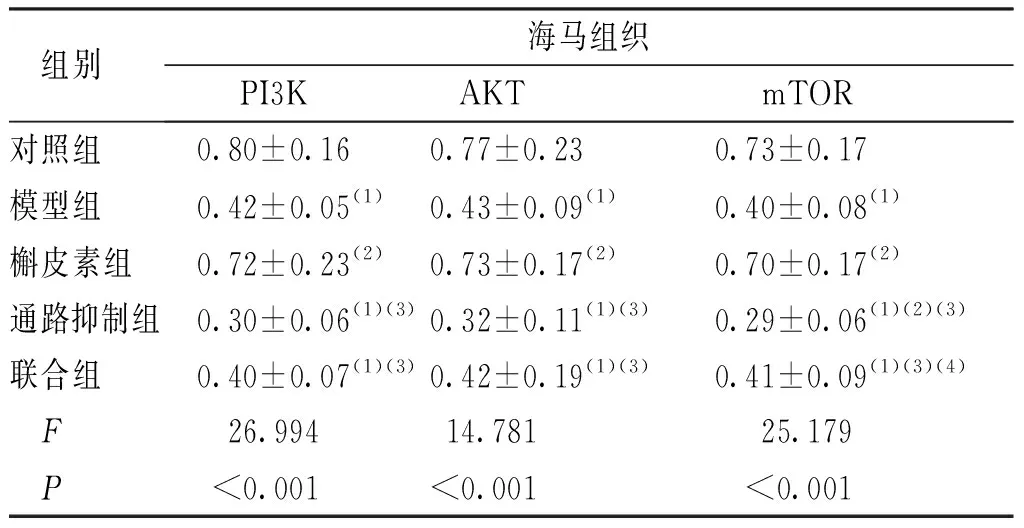
表5 各组小鼠海马组织PI3K、AKT、mTOR蛋白表达水平比较Tab.5 Comparison of the protein expression levels of PI3K, AKT and mTOR in mouse hippocampus among the following groups
2.6 海马组织PI3K、AKT、mTOR蛋白磷酸化水平
与对照组比较,其余各组小鼠海马组织的p-PI3K、p-AKT、p-mTOR表达水平均降低,差异有统计学意义(P<0.05);与模型组比较,通路抑制组小鼠海马组织的p-PI3K、p-AKT、p-mTOR表达水平降低,槲皮素组则相反,差异有统计学意义(P<0.05)。联合组与模型组比较差异无统计学意义(P>0.05)。见图2和表6。

图2 各组小鼠海马组织PI3K、AKT、mTOR蛋白磷酸化水平灰度值Fig.2 The protein phosphorylation levels of PI3K, AKT, and mTOR in mouse hippocampus in each group
3 讨论
缺血性脑卒中是仅次于缺血性心脏病的第2大人口死亡因素,患者发病后随病情进展表现出炎症反应、氧化应激反应,进而损伤脑组织,造成视听觉消失、瘫痪、痴呆等行为,因此临床中常将感觉、
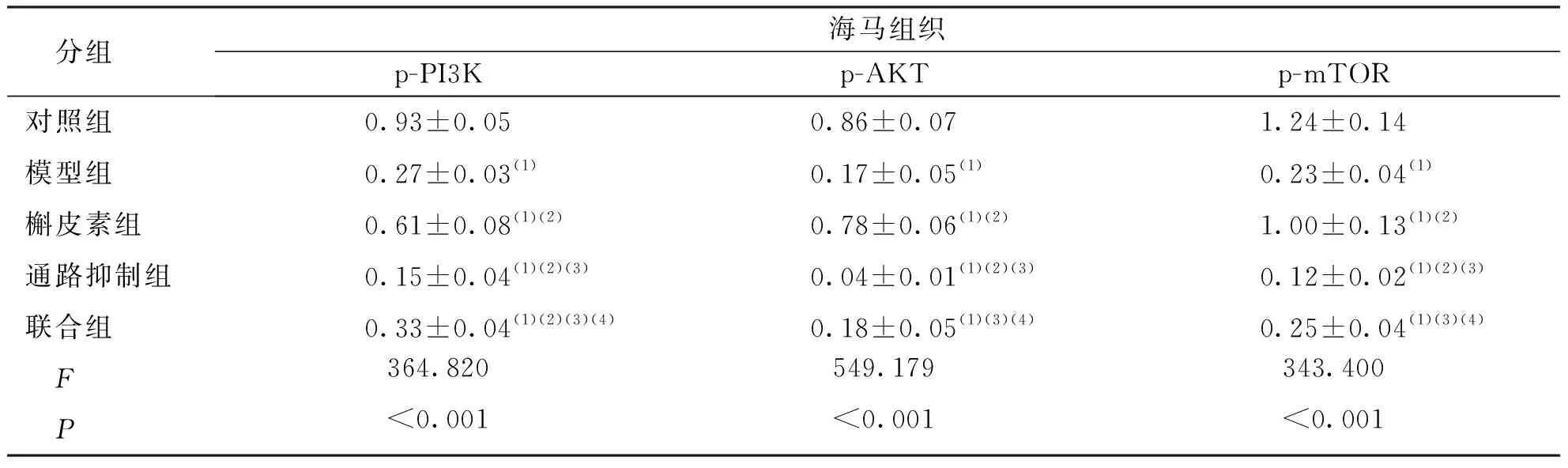
表6 各组小鼠海马组织PI3K、AKT、mTOR蛋白磷酸化水平比较Tab.6 Comparison of PI3K, AKT, and mTOR protein phosphorylation levels in mouse hippocampus in each group
运动、认知等神经功能异常行为作为了解缺血性脑卒中患者脑损伤程度的监测指标,通过给予血液恢复、溶栓等治疗措施改善预后[11-12]。槲皮素近年来因其可抵抗脑缺血再灌注损伤而得到关注,因此本文就此展开相关研究。
本文结果显示,各组小鼠的学习记忆能力和脑功能与对照组比较均降低,其中PI3K/Akt/mTOR通路抑制组小鼠的学习记忆能力和脑功能最差,提示抑制PI3K/Akt/mTOR通路会对小鼠学习记忆能力和脑功能产生明显不良影响,而槲皮素组小鼠学习记忆能力和脑功能则优于模型组、通路抑制组和联合组,且脑梗死灶体积较各组明显缩小,提示给予缺血性脑卒中小鼠槲皮素能够缩小脑梗死体积,保护小鼠学习记忆功能和脑功能。进一步探究中发现,PI3K/Akt/mTOR通路抑制组小鼠的IL-6和TNF-α水平最高,提示抑制该通路会造成缺血性脑卒中小鼠机体炎性反应加重,而槲皮素组小鼠海马组织的IL-6和TNF-α水平明显低于模型组、通路抑制组和联合组,提示槲皮素可在一定程度上缓解炎性反应。同样监测海马组织内MDA和SOD水平,可以发现槲皮素也能够缓解氧化应激反应,是由于槲皮素能够清除多余的活性氧,可通过激活线粒体自噬而发挥保护脑神经和脑功能的作用,同时槲皮素还能够抗血栓、抑制炎症反应和细胞凋亡,缓解脑卒中后的继发性损伤,降低神经元受损程度[13-15]。既往在部分学者对缺血性损伤动物模型的研究中也发现[16-20],槲皮素能够提高内源性抗氧化酶CU/Zn/锰超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶在海马CA1椎体神经元中的表达,具有较强的神经保护功能,可有效缓解脑缺血。同时本文结果显示,槲皮素组小鼠海马组织的PI3K、AKT、mTOR蛋白表达水平和p-PI3K、p-AKT、p-mTOR表达水平升高,而通路抑制组小鼠的各蛋白表达及磷酸化表达水平均降低,提示槲皮素可能通过上调PI3K/Akt/mTOR通路而发挥脑功能保护作用,该通路通过逐级磷酸化下游蛋白,能够对机体多种细胞生物学过程进行调控,如可通过调控细胞自噬而缓解缺血性卒中造成的炎性反应和脑损伤[21-25]。
综上所述,槲皮素可通过上调PI3K/Akt/mTOR通路改善缺血性卒中小鼠的学习记忆能力,提升脑功能,缓解脑部炎性反应和氧化应激反应,从而促进缺血性卒中小鼠康复。

