地塞米松灌洗支气管肺泡联合静脉推注乌司他丁对老年急性肺损伤患者TGF-β1/Smads信号通路的影响
张艺, 胡松华, 朱建新
(河北北方学院附属第一医院 药学部, 河北 张家口 075000)
急性肺损伤(acute lung injury,ALI)是由各种肺内或(和)肺外致病因素所导致的弥漫性肺间质及肺泡水肿,可由肺部感染、严重创伤、脓毒症等引起,属急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)病理学发展的早期阶段,具有起病急、发病严重等特点,ALI多并发急性炎症、微血管损伤,可造成肺血管和上皮细胞通透性增加,如不及时治疗可发展为多器官功能衰竭[1-2]。现阶段,临床主要通过治疗原发基础病及继发性脏器损伤,并采用机械通气等对ALI进行治疗,但这些治疗仅能维持患者的肺功能,并不能从根本治疗患者呼吸困难的病因[3]。地塞米松是临床最常用的糖皮质激素,被认为是治疗急危重症患者的良药,地塞米松可起到抗炎、抗过敏及免疫抑制等作用,常被用于急性胰腺炎、急性循环衰竭的辅助用药[4]。乌司他丁作为广谱的蛋白酶抑制剂,有拮抗炎性介质、稳定溶酶体膜和清除氧自由基的作用,适用于多种炎症性疾病,但其作用机制亦尚未完全明晰[5-6]。有学者发现,机体炎症、氧化损伤、纤维组织增生及修复在ALI发病进程中扮演着关键角色,目前关于地塞米松灌洗支气管肺泡联合乌司他丁治疗老年ALI的研究仍鲜有报道,为了探明这一组合方案对老年ALI患者整体疗效的影响,本研究选取2019年2月—2021年6月诊治的58例老年ALI患者作为研究对象,采用地塞米松灌洗支气管肺泡联合乌司他丁治疗,观察治疗期间患者的全身炎症反应、氧化应激反应及转化生长因子β1(TGF-β1)/Smads信号通路的活化情况,报道如下。
1 对象与方法
1.1 研究对象
选取2019年2月—2021年6月诊治的116例老年ALI患者作为研究对象,所有受试者均符合参考文献[7]中ALI的诊断标准。纳入标准:(1)未伴有其他相关脏器的器质性病变;(2)入住ICU时急性肺损伤评分(lung injury score,LIS)≥4分;(3)机械通气治疗时间>3 d;(4)入组前3个月未曾应用过糖皮质激素、免疫抑制药物者,(5)患者家属签属知情同意书。排除标准:(1)地塞米松或乌司他丁药物过敏者;(2)孕妇及哺乳期妇女;(3)有近期手术史者;(4)患有严重心肝肾功能障碍者;(5)存在自身免疫性疾病、神经系统疾病者;(6)血流动力学不稳定者。根据患者入院顺序,并按随机数字表法将患者分为观察组及对照组,每组58例。
1.2 治疗方法
1.2.1对症治疗 入院后2组患者均根据参考文献[7]给予对症、营养支持、糖皮质激素、限制性液体管理及抗生素抗感染等治疗,实时监测生命体征;给予肺保护性通气策略,通气参数设置为小潮气量通气水平控制在5~8 mL/kg、呼吸频率设定为20次/min、吸入氧浓度(fraction of inspiration O,FiO2)为0.35~0.80、平台压<35 cmH2O、呼气末正压通气(positive end expiratory pressure,PEEP)水平依静态P-V曲线+2 cmH2O确定,尽量保持患者自主呼吸,防止呼吸肌萎缩。
1.2.2对照组 给予纤维地塞米松灌洗支气管肺泡(规格5 mg/1 mL,国药准字H44025148,三才石岐制药股份有限公司生产)治疗,步骤为:(1)术前30 min给予15 mg地西泮(规格10 mg/2 mL,国药准字H14022662,山西振东安特生物制药有限公司)静脉注射,将2%盐酸利多卡因注射液喷洒咽喉(规格0.1 mg/5 mL,国药准字H61023138,陕西健民制药有限公司)行局部麻醉;(2)患者仰卧体位,将ABF-3型纤维支气管镜(上海澳华光电内窥镜有限公司产品)经气管导管进入气道,逐级观察总气管、左右支气管及肺叶段支气管;(3)待气管内痰液清洗干净后,给予地塞米松20 mg+0.45%氯化钠溶液60 mL灌洗,20 mL/次,连续3次。疗程7 d。
1.2.3观察组 在对照组治疗的基础上加用注射用乌司他丁(规格5万单位/支,国药准字H19990133,广东天普生化医药股份有限公司),剂量为10万单位乌司他丁溶解于0.45%NaCl 20 mL中,静脉推注,3次/d。,疗程7 d。
1.3 观察指标
1.3.1氧合指数、炎症反应相关指标 分别于治疗前后通过动脉血气分析仪(型号NOVA pHOx plus)监测2组患者血氧分压、计算氧合指数(氧合指数=血氧分压/吸入氧浓度);同时采集清晨空腹外周静脉血2 mL,3 500 r/mim离心10 min分离血清,采用免疫吸附(ELISA)法检测血清中核因子-κB(nuclear factor-κB,NF-κB)、血管细胞黏附分子(vascular cell adhesion molecule,VCAM1)、单核细胞趋化因子-1(monocyte chemoattractant factor-1,MCP-1)及白细胞介素-8(interleukin-8,IL-8)水平,试剂盒均购自于贝克曼库尔特商贸中国有限公司。
1.3.2氧化应激指标 取1.3.1项下的血清,采用放射免疫沉淀法检测血清中缺血修饰清蛋白(ischemia modified albumin,IMA)、活性氧(reactive oxygen species,ROS)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPAR γ)及丙二醛(malondialdehyde ,MDA)水平,试剂盒均购自于贝克曼库尔特商贸中国有限公司。
1.3.3TGF-β1/Smads信号通路相关因子 分别于治疗前后采集患者外周空腹静脉血2 mL,用乙二胺四乙酸(elhylene diamine tetraacetic acid,EDTA)抗凝,加入红细胞裂解液(美国Pharmacia公司生产)200 μL,振荡混匀,室温避光5 min,3 500 r/mim离心10 min分离,收集上清液细胞裂解液 ,用BCA试剂盒(碧云天生物技术公司生产)检测样本蛋白浓度;SDA-PAGE垂直电泳分离,转移至预冷的转膜液中,200~250 mA恒流转膜2 h,上样量为30 μg/孔;洗涤液冲洗,10%脱脂奶粉(TTBS配制)4 ℃封闭过夜;分别加入TGF-β1 Ⅰ型受体(tgf-beta 1,TGF-β1RⅠ)、TGF-β1RⅡ、Smad2、Smad3单克隆抗体(抗体稀释液为5%脱脂奶粉)室温孵育4 h;用TTBS洗涤后滴加生物素标记的二抗室温孵育1 h、TTBS洗涤、显色,实验设GAPDH为内参照。应用Image J软件计算目标条带的灰度值,目标蛋白含量以目标蛋白/GAPDH比值来表示。
1.3.4疾病严重程度 由1位5年以上临床工作经验的呼吸内科医师采用双盲法完成疾病严重程度的判断,使用急性生理与慢性健康(acute physiology and chronic health evaluation, APACHEⅡ)评分、全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)评分及LIS评分评估病情。
1.3.5治疗期间指标及临床结局 记录2组患者治疗期间临床结局,包括机械通气时间、ICU时间、住院时间、ARDS发生率、呼吸机相关肺炎(ventilator associated pneumonia,VAP)发生率及总死亡率。
1.4 统计学方法

2 结果
2.1 一般资料
结果显示,2组患者性别、年龄、发病时间及损伤原因等一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。
2.2 血清氧合指数、炎症反应相关指标
治疗前,2组ALI患者血清氧合指数、NF-κB、VCAM1、MCP-1、IL-8水平比较,差异无统计学意义(P>0.05);治疗后,2组患者血清氧合指数较治疗前明显提高,血清NF-κB、VCAM1、MCP-1、IL-8水平较治疗前明显降低,且观察组变化更显著,差异有统计学意义(P<0.01)。见表2。

表1 两组ALI患者一般资料比较Tab.1 Comparison of the general data between the two groups

表2 治疗前后2组ALI患者血清氧合指数、炎症反应相关指标比较Tab.2 The serum oxygenation index and inflammatory response related indexes were compared between the two groups before and after
2.3 血清氧化应激相关指标
治疗前,2组ALI患者血清IMA、ROS、PPAR γ、MDA水平比较,差异无统计学意义(P>0.05);治疗后,2组患者血清PPAR γ较治疗前明显提高,血清IMA、ROS、PPAR γ、MDA水平较治疗前明显降低,且观察组变化更显著,差异有统计学意义(P<0.01)。见表3。
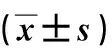
表3 治疗前后2组ALI患者血清氧化应激相关指标比较Tab.3 Comparison of serum oxidative stress related indexes between the two groups before and after
2.4 血细胞TGF-β1/Smads信号通路相关因子
治疗前,2组ALI患者血细胞TGF-β1RⅠ、TGF-β1RⅡ、Smad2、Smad3水平比较,差异无统计学意义(P>0.05);治疗后,2组患者血细胞TGF-β1RⅠ、TGF-β1RⅡ、Smad2、Smad3水平较治疗前明显降低,且观察组变化更显著,差异有统计学意义(P<0.01)。见表4。
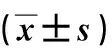
表4 治疗前后2组ALI患者血细胞TGF-β1/Smads信号通路相关因子表达水平Tab.4 Relative expression levels of TGF-β1/Smads signaling pathway related factors in blood cells of patients between the two groups before and after
2.5 APACHEⅡ、SIRS、LIS评分
治疗前,2组ALI患者APACHEⅡ、SIRS、LIS评分比较,差异无统计学意义(P>0.05);治疗后,2组患者APACHEⅡ、SIRS、LIS评分均较治疗前明显降低,且观察组变化更显著,差异有统计学意义(P<0.01)。见表5。

表5 治疗前后2组ALI患者APACHEⅡ、SIRS及LIS评分分]Tab.5 APACHEⅡ, SIRS, and LIS scores before and after treatment between the two
2.6 治疗期间指标及临床结局
结果显示,治疗期间观察组ALI患者机械通气时间、ICU时间、住院时间、ARDS发生率、VAP发生率均较对照组降低,差异有统计学意义(P<0.05);2组患者总死亡率比较差异无统计学意义(P>0.05)。见表6。

表6 两组ALI患者治疗期间指标及临床结局比较Tab.6 Comparison of clinical outcomes between the
3 讨论
ALI作为一种过度反应的急性炎症疾病,往往受到多种内、外源因素的影响,患者病情进展较快,再加之老年群体多存在组织器官功能减退、合并症较多等现象,更易危及生命[8],因此,对ALI患者进行针对性治疗并优化其临床结局显得尤为重要。长期临床实践证实,支气管肺泡灌洗联合局部注药在诸多肺部疾病治疗中发挥着重要效应,其主要优点在于可直视肺内病灶并局部给药,可深达支气管以下肺段及亚肺段水平,能有效清除阻塞支气管的炎性分泌物和痰液,进一步改善气道阻塞并促进肺组织通气[9]。地塞米松是临床最常用的糖皮质激素,能够发挥促进痰液排出、阻滞单核细胞及粒细胞活化等功能,被认为是治疗急危重症患者的良药,而纤支镜下肺内应用地塞米松可提高局部药物浓度,且药物直达肺部患处病变组织,可进一步提升治疗效果[10]。乌司他丁是一种分子质量为67 kDa的蛋白酶抑制剂,可抑制多种水解酶活性、抑制炎症介质释放等;近年来其在心、肝、肺、肾等重要脏器的保护治疗中扮演着重要角色,本研究结果显示,地塞米松灌洗支气管肺泡联合静脉推注乌司他丁较单一用药在整体治疗效果方面更具有优势,能够明显加快患者呼吸系统功能的恢复进程并优化其临床结局,考虑可能是乌司他丁可通过脏器保护作用及信号通路调节等多条路径来促进临床疗效的提高,但仍需进一步验证。
肺纤维化是ALI发展进程中主要的病理进程,而现阶段有大量研究表明TGF-β1参与肺纤维化的发生、发展,其作为一类强细胞外基质沉积促进剂,可直接影响细胞生长、分化、凋亡及迁移等一系列改变,被认为是多种组织发生纤维化的“总开关”[12-13]。TGF-β1异构体基本在所有的细胞内均存在,且其在肺固有细胞、肺间质细胞及浸润炎性细胞等均有分泌,过度表达的TGF-β1可诱导正常成纤维细胞向肌成纤维细胞分化,亦可促进蛋白酶的表达,继而诱导细胞外基质(extracellular matrix,ECM)中多种成分发生水解。生成的肌成纤维细胞也会产生TGF-β1,对负反馈系统造成影响,进一步加速肺部纤维化进程。另外,TGF-β1还能使其他促纤维化因子上调而诱导细胞增殖和凋亡,以实现上皮间质转化过程[14]。Smad家族是TGF-β1的下游底物,在TGF-β1与细胞膜表面受体结合进行跨膜转导过程中,TGF-β1RⅠ和TGF-β1RⅡ形成受体异聚体,促进Smad2/3蛋白磷酸化并进行细胞内转导信号,完成信号跨膜转导,进一步加速巨噬细胞等炎性细胞的渗出和向损伤病灶的移动,进而促进上皮-间质转化过程[15]。因此,本研究通过分析治疗前后患者外周血TGF-β1/Smads信号通路相关因子水平变化,旨在为评价预后提供一线依据。结果显示,观察组经治疗后的外周血TGF-β1RⅠ、TGF-β1RⅡ、Smad2、Smad3水平明显高于对照组,提示乌司他丁对ALI病程中的肺间质纤维化具有显著的抑制作用,这也是其阻止患者病情进展的直观证据。
目前的研究认为除了肺部实质损伤外,在ALI的进展过程中,炎症细胞浸润增强进而导致肺结构的破坏及肺部的病理性改变,故炎症反应程度也可间接反映ALI患者疾病严重程度[16-17]。IL-8能够介导炎症细胞的激活和浸润,在组织损伤后引起的炎性反应及应激反应中显著升高,引起呼吸道痉挛、液体渗出等,进一步抑制了呼吸功能[18]。MCP-1为对单核细胞具有特异性趋化和激活活性的细胞因子,可与单核-巨噬细胞表面受体结合,趋化单核细胞进入肺组织,继而造成肺泡腔内聚集并形成肺泡炎症[19]。VCAM1是100~110 kDa 的I型跨膜蛋白,能够介导炎症细胞与内皮细胞的黏附并促进炎症反应的放大。NF-κB是在炎症反应激活过程中发挥关键作用的转录因子,其既可维持机体内环境的稳定,又可介导病原特异性应答,而肺泡、毛细血管的大量破坏可使NF-κB与其抑制分子IκB解离并成为游离且结合形成无活性的三聚体,保证炎症反应处于持续激活的状态[20]。既往研究发现,炎症反应的激活会进一步引起局部组织中氧自由基过度生成,再加之ALI这一强烈的应激源对氧化应激反应的刺激作用,大量自由基会在病程中大量分泌[21]。IMA属有氧代谢产物,其含量聚集则能够引起组织氧化损伤,故IMA为反映机体应激性损伤的敏感性指标[22]。PPAR γ是核激素受体家族中的配体激活受体,能够在氧化应激过程中发挥抗氧化作用,一项基础实验证实,LPS诱导的RAW 264.7细胞急性氧化损伤模型中,PPAR γ通路会促进自噬和抑制氧化应激反应来缓解细胞损伤[23]。ROS为氧的正常代谢的天然副产物,当人体处于创伤时,会造成呼吸链缺损及解偶联过程能量转换下降,促进ROS的过量释放,而过量的ROS又可与组织局部的脂质成分发生氧化反应,引起MDA大量生成,形成恶性循环[24]。本研究结果显示,观察组患者经治疗后的血清NF-κB、VCAM1、MCP-1、IL-8以及IMA、ROS、MAD均明显低于对照组,而PPAR γ则反之,提示地塞米松灌洗支气管肺泡联合静脉推注乌司他丁能够进一步抑制炎症反应及氧化应激的激活。分析原因可能为乌司他丁可抑制中性粒细胞蛋白酶释放,阻断NF-κB等炎症信号通路,以控制炎性介质过度分泌,同时乌司他丁亦能够有效改善微循环和肺组织灌注,进一步清除自由基,这也是临床需加强抗炎症、增强抗氧化能力时,优先选择联合用药的又一依据。经临床观察发现,在ALI患者整个病理生理过程中呼吸氧合功能存在异常,主要原因为患者胸腔压力增大,下腔静脉受到压迫,引起回流障碍,导致血流动力学异常,进而造成氧合功能异常。本研究结果显示,观察组治疗后氧合指数显著高于对照组,提示地塞米松灌洗支气管肺泡联合静脉推注乌司他丁能够明显改善ALI患者的氧合功能。其作用机制可能与该治疗方案能降低患者肺毛细血管通透性、抑制血肺泡灌洗液炎性反应有关。
综上所述,地塞米松灌洗支气管肺泡联合静脉推注乌司他丁对老年ALI的治疗效果优于单一地塞米松灌洗支气管肺泡,可显著加速病情恢复进程,并改善氧合功能和临床结局,其机制可能与减轻机体全身炎症反应、氧化应激反应并抑制TGF-β1/Smads信号通路的活化有关。但由于本研究仅进行了短期观察,加之未对相关指标进行动态观察,数据结果的代表性有一定局限,因此尚有待更长期的大样本动态研究加以证实。

