Runt相关转录因子3在结直肠癌组织中的表达及意义
王 璧,王战会,韩保卫,郑秋霞,孙宗斌,蔡萌萌,段廷贺
(1.新乡医学院,河南 新乡 453003;2.郑州大学附属洛阳市中心医院肝胆外科,河南 洛阳 471009;3.河南省第二儿童医院胃肠外科,河南 洛阳 471009;4.兰州大学第一附属医院肝胆外科,甘肃 兰州 730000)
结直肠癌是消化系统最常见的恶性肿瘤之一,每年造成约71.5万人死亡,是癌症死亡的第2大病因[1-3]。近年来,结直肠癌的发病率逐渐上升,且有年轻化趋势[4]。由于结直肠癌早期缺乏典型的临床症状,多数患者确诊时已处于中晚期,且目前结直肠癌的诊断尚缺乏特异性强、灵敏度高的检测指标,因此,如何更好地实现早筛查、早诊断,对结直肠癌具有非常重要的意义。有研究指出,结直肠癌相关因子检测及癌前筛查对该疾病的诊断、个体化治疗及预后判断意义重大[5]。因此,结直肠癌的分子标志物成为国内外研究的热点。Runt相关转录因子3(Runt-related transcription factor 3,RUNX3)是新近发现的一种抑癌基因,其在胃癌、肺癌、肝癌等多种消化道恶性肿瘤组织中呈低表达,且与患者的预后有关[6]。研究发现,RUNX3不仅参与细胞的增殖、生长和凋亡,还参与信号转导。RUNX3作为重要的转录因子能够促进转化生长因子-β(transforming growth factor-β,TGF-β)信号通路的激活和Wnt信号通路的抑制,而这些通路的异常转导在结直肠癌的发生、发展中发挥关键作用[7-8],提示RUNX3可能在结直肠癌的发生、发展中也起到一定作用。目前,关于RUNX3在结直肠癌中的作用机制尚未完全明确。本研究对结直肠癌组织中的RUNX3表达水平进行分析,探讨其与结直肠癌临床病理特征及预后的关系,以期为临床寻找结直肠癌标志物提供理论基础。
1 资料与方法
1.1 一般资料选择2017年2月至2020年6月郑州大学附属洛阳市中心医院胃肠外科收治的100例结直肠癌患者为研究对象。病例纳入标准:(1)经影像学、肠镜及术后病理学检查确诊为原发性结直肠癌;(2)患者术前均未接受过新辅助化学治疗、放射治疗及免疫治疗。排除标准:(1)既往患有其他恶性肿瘤者;(2)合并机体脏器严重衰竭者;(3)术前已行化学治疗、放射治疗及免疫治疗者;(4)临床资料不完善者。100例患者中,男52例,女48例;年龄42~79(64.33±12.31)岁,其中≥60岁61例,<60岁 39例;肿瘤部位:结肠48例,直肠52例;肿瘤直径:≥5 cm 43例,<5 cm 57例;分化程度:高分化18例,中分化52例,低分化30例;病理分型:溃疡型66例,隆起型23例,浸润型11例;浸润深度:cT18例,cT230例,cT325例,cT437例;淋巴结转移:N061例,N139例;远处转移:M081例,M119例;TNM分期:Ⅰ期29例,Ⅱ期29例,Ⅲ期26例,Ⅳ期16例。所有患者术中留取结直肠癌组织及距离癌组织边缘5 cm以上的癌旁组织标本,将每例标本均分为2份,其中1份制备石蜡标本,另1份快速保存于-80 ℃冰箱备用。本研究采用查阅电子病历、患者随访系统或电话等方法对所有患者进行随访,随访截止日期为2020年10月,生存期的计算为从患者手术日期到随访截止日期或死亡日期。本研究通过郑州大学附属洛阳市中心医院医学伦理委员会审核批准,所有患者及家属签署知情同意书。
1.2 细胞、主要试剂与仪器人正常结肠上皮细胞NCM460及结肠癌细胞系HCT-116、SW-480细胞均购自中国科学院上海生命科学研究院细胞资源中心,RUNX3一抗购自武汉博士德生物工程有限公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗、辣根过氧化物酶(horse radish peroxidase,HRP)标记的羊抗兔二抗、二氨基联苯胺(diaminobenzidine,DAB)显色液、磷酸盐缓冲液(phosphate buffered saline,PBS)、枸橼酸钠抗原修复液均购自上海碧云天生物技术研究所,内源性过氧化物酶阻滞剂购自武汉伊莱瑞特生物科技股份有限公司,聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、放射免疫沉淀分析(radio immunoprecipitation assay,RIPA)裂解液购自北京索莱宝科技有限公司。
1.3 免疫组织化学染色法检测结直肠癌组织和癌旁组织中RUNX3蛋白的表达取患者术中切除的结直肠癌组织和癌旁组织(距离癌组织边缘>5 cm以上)固定后制作的石蜡标本,层厚5 μm连续切片,80 ℃恒温箱中烤片2 h,将切片置于二甲苯中脱蜡,递减梯度乙醇(无水乙醇、体积分数95%乙醇、体积分数75%乙醇)脱去二甲苯并水化,将切片浸泡于枸橼酸钠抗原修复液中进行抗原修复,自然冷却后使用PBS冲洗,切片;每张切片滴加50 μL过氧化物酶阻滞剂,室温孵育10 min,然后用PBS冲洗;用体积分数5%正常山羊血清封闭,室温孵育10 min,倾去血清;滴加50 μL RUNX3一抗(稀释倍数1100),室温孵育1 h,PBS冲洗3次,每次2 min;加入羊抗兔单克隆抗体IgG作为二抗(稀释倍数150),室温孵育30 min,PBS冲洗3次,每次2 min;DAB显色,苏木精复染,递减梯度乙醇(无水乙醇、体积分数95%乙醇、体积分数75%乙醇)脱水,中性树胶封片,显微镜下观察。细胞核中出现浅黄色、棕黄色或棕褐色颗粒的细胞为RUNX3阳性表达细胞,随机选取5个高倍镜视野,观察并计数阳性细胞数占同类细胞总数的百分比。参照KARPATHIOU等[9]和沈晓健等[10]的方法,根据染色强度及阳性细胞所占比例进行半定量评分:(1)阳性细胞所占比例为0%~25%计为1分,26%~75%计为2分,76%~100%计为3分;(2)无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;(3)2项评分的乘积为每张切片的组织染色最终评分,二者相乘共分为0~9分,0~4分为低表达,5~9分为高表达。分别计数结直肠癌组织和癌旁组织标本中RUNX3蛋白高表达及低表达的例数,计算RUNX3蛋白高表达率和低表达率,高表达率=RUNX3蛋白高表达例数/总例数×100%,低表达率=RUNX3蛋白低表达例数/总例数×100%。
1.4 蛋白免疫印迹法检测结直肠癌组织、癌旁组织和人正常结肠上皮细胞NCM460、结肠癌细胞系HCT-116、SW-480细胞中RUNX3蛋白相对表达量将蛋白酶抑制剂、磷酸酶抑制剂分别按150比例加入蛋白裂解液中混匀,配置蛋白裂解混合液。取1 cm×1 cm×1 cm的结直肠癌组织样本及癌旁组织样本,研磨均匀后分别置于EP管中;另分别取人正常结肠上皮细胞NCM460、结直肠癌细胞系HCT-116、SW-480细胞2×106个,置于相应的EP管;各EP管做好标记,分别加入500 μL蛋白裂解混合液,冰上裂解30 min,12 000 r·min-1离心10 min,收集上清液。根据BCA蛋白浓度测定试剂盒说明书,在96孔板中设置标准孔和待测样本孔,标准孔设置为8个标准品浓度,即于8个标准孔中分别加入相应量的标准品试剂,然后以PBS将其补足为20 μL的终体积,使其标准品终质量浓度分别为0.00、0.05、0.10、0.15、0.20、0.30、0.40、0.50 mg·μL-1;另取裂解后的结直肠癌组织、癌旁组织和人正常结肠上皮细胞NCM460、结肠癌细胞系HCT-116、SW-480细胞上清液各20 μL,分别加入相应的待测样本孔中;最后向标准孔及各待测样本孔中分别加入200 μL工作液,震荡20 s混匀,覆膜后置于37 ℃恒温箱中反应30 min,然后用全波长多功能酶标仪在波长562 nm处测定各孔样本的吸光度(A)值,并建立坐标轴,根据标准曲线计算出各样本的实际蛋白浓度;将所有样本取相同质量并移入新的离心管中,并以PBS补足至相同体积,加入1/4样本体积的loading buffer,充分混匀后置于金属浴中100 ℃加热变性10 min;每个泳道装载20 μg变性蛋白,选择80 V恒压进行电泳约20 min,然后更换至 100 V恒压电泳约1 h;蛋白分离后经湿转法电转至聚偏二氟乙烯膜上;用洗膜液洗膜2次,每次10 min,然后将膜置于高效封闭液中室温摇床震动下孵育15 min;分别将膜放置于配置好的目的蛋白RUNX3一抗溶液(稀释倍数11 000)及内参蛋白GAPDH溶液(稀释倍数11 000)中4 ℃摇床震动下孵育过夜;再次洗膜后将膜置于配置好的二抗溶液(稀释倍数11 000)中室温摇床震动下孵育 2 h;在避光容器中配置增强化学发光显色液,而后将其覆盖于膜表面,放置1 min后在全自动凝胶成像系统中观察、采集图片,应用Image J软件分析各条带的灰度值,计算结直肠癌组织、癌旁组织及人正常结肠上皮细胞NCM460和结肠癌细胞系HCT-116、SW-480细胞中目的蛋白RUNX3的相对表达量,RUNX3相对表达量以目的蛋白RUNX3灰度值与内参GAPDH灰度值的比值表示。实验重复3次,取均值。

2 结果
2.1 结直肠癌组织与癌旁组织中RUNX3蛋白表达率比较结果见表1和图1。结直肠癌组织中RUNX3蛋白高表达率为35.0%(35/100),癌旁组织中RUNX3高表达率为74.0%(74/100);结直肠癌组织中RUNX3蛋白高表达率显著低于癌旁组织,差异有统计学意义(χ2=30.670,P<0.05)。
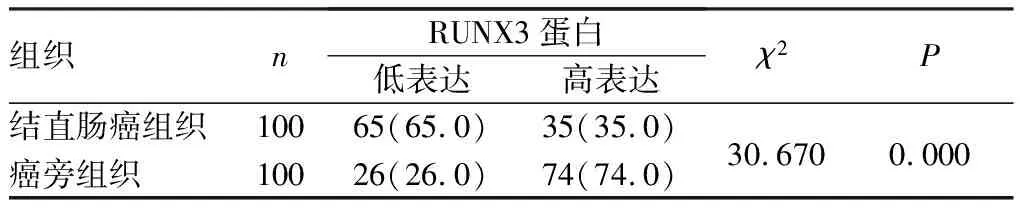
表1 结直肠癌组织和癌旁组织中RUNX3蛋白表达率比较

A:癌旁组织;B:结直肠癌组织。
2.2 结直肠癌组织和结肠癌细胞系中RUNX3蛋白相对表达量比较结果见图2和图3。结直肠癌组织和癌旁组织中RUNX3蛋白相对表达量分别为0.52±0.28、0.99±0.17;结直肠癌组织中RUNX3蛋白相对表达量显著低于癌旁组织,差异有统计学意义(t=2.904,P<0.05)。结肠癌细胞系HCT-116、SW-480细胞和正常结肠上皮细胞NCM460中RUNX3蛋白相对表达量分别为0.58±0.05、0.62±0.09、1.05±0.01,结肠癌细胞系HCT-116和SW-480细胞中RUNX3蛋白相对表达量均显著低于正常结肠上皮细胞NCM460,差异有统计学意义(t=-14.738、-8.082,P<0.05);结肠癌细胞系HCT-116与SW-480细胞中RUNX3蛋白相对表达量比较差异无统计学意义(t=0.554,P>0.05)。
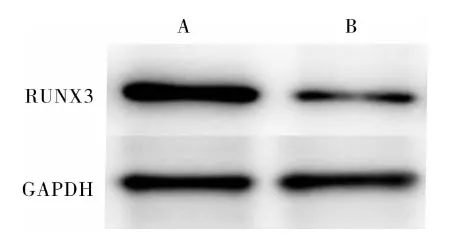
A:癌旁组织;B:结直肠癌组织。
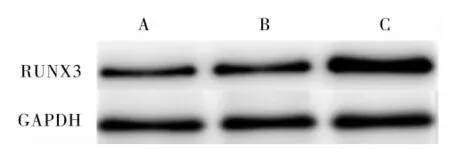
A:结肠癌细胞系HCT-116细胞;B:结肠癌细胞系SW-480细胞;C:正常结肠上皮细胞NCM460。
2.3 结直肠癌组织中RUNX3表达与患者临床病理特征的关系结果见表2。结直肠癌组织中RUNX3表达水平与患者淋巴结转移、远处转移及肿瘤TNM分期有关(P<0.05),与患者的性别、年龄、肿瘤直径、位置、大体分型、浸润深度及分化程度无关(P>0.05)。
2.4 结直肠癌组织中RUNX3表达水平与结直肠癌患者预后的关系结果见图4。Kaplan-Meier生存分析显示,结直肠癌组织中RUNX3低表达患者生存率为60.0%(39/65),高表达患者生存率为71.4%(25/35);高表达患者生存率显著高于低表达患者,差异有统计学意义(χ2=4.413,P<0.05)。

表2 结直肠癌组织中RUNX3表达与临床病理特征的关系

图4 结直肠癌组织中RUNX3高表达和低表达患者的生存曲线
2.5 结直肠癌患者生存影响因素的单因素Cox回归分析结果见表3。单因素Cox回归分析显示,肿瘤浸润深度、有无淋巴结转移、有无远处转移、肿瘤TNM分期及RUNX3表达水平与患者生存显著相关(P<0.05),而患者性别、年龄、肿瘤位置、直径、大体分型、分化程度与结直肠癌患者生存无显著相关性(P>0.05)。

表3 结直肠癌患者生存影响因素的单因素Cox回归分析
2.6 结直肠癌患者生存影响因素的多因素Cox回归分析结果见表4。将单因素Cox回归中差异有统计学意义的因素进一步行多因素Cox回归分析,结果显示,有无远处转移、肿瘤TNM分期及RUNX3表达水平是影响患者生存的独立危险因素(P<0.05)。

表4 结直肠癌患者生存影响因素的多因素Cox回归分析
3 讨论
结直肠癌作为恶性程度较高的消化道肿瘤,侵袭能力较强,易出现早期转移,多数患者预后不良,严重威胁着患者的生命健康[11]。尽管目前结直肠癌发病机制尚未完全阐明,但分子流行病学研究发现,相关基因的遗传多态性在结直肠癌易感性中发挥着至关重要的作用[12-13];因此,将抑癌基因或癌基因作为治疗的靶点是目前结直肠癌研究的热点之一[14]。
RUNX3基因是近年来新发现的一种抑癌基因,又称急性髓性白血病因子2(acute myeloid leukemia 2,AML2)基因,其位于人染色体1号短臂1p36.1和鼠4号染色体上,含6个外显子和1 290 bp的开放阅读框,总长约67 kb,其中启动子p2可控制基因的转录,对细胞的生长发育、凋亡、信号转导及生物学效应的发挥起关键作用。研究发现,RUNX3参与多种恶性肿瘤细胞的生长发育、增殖、凋亡及细胞信号转导通路[15],其中以TGF-β和Wnt信号传导通路为主。RUNX3参与介导TGF-β由细胞质转入细胞核,促使TGF-β与核内靶蛋白相结合,调节靶点基因转录,同时与TGF-β传导通路下游因子相互协同,增强TGF-β抑制细胞增长的能力;RUNX3还可以与Wnt信号转导通路关键效应器T细胞因子4和β-连环蛋白形成复合物,从而抑制T细胞因子4/β-连环蛋白复合物与靶标DNA的结合,减弱目的基因的转录,抑制该通路的致癌作用。RUNX3异常表达导致TGF-β的信号转导通路紊乱,细胞抗凋亡能力增强,从而引发包括结直肠癌在内的恶性肿瘤的发生[16-17]。
RUNX3虽表达广泛,但被认为与胃肠道发育相关,以RUNX3为靶点的研究能够进一步理解结直肠癌的发病机制。RUNX3异常表达不仅与胃腺癌癌前病变及胃腺癌的发生、发展、预后相关,而且参与肺癌、膀胱癌、胰腺癌等恶性肿瘤形成。而RUNX3与结直肠癌发生、发展及临床预后的相关性尚未完全阐明。基于此,本研究通过免疫组织化学染色法检测结直肠癌患者癌组织及癌旁组织中RUNX3蛋白的表达水平,并通过蛋白免疫印迹法检测结直肠癌组织、癌旁组织及正常结直肠上皮细胞NCM460、结肠癌细胞系HCT-116和SW-480细胞中RUNX3蛋白的相对表达量,结果发现,结直肠癌组织中RUNX3蛋白高表达率显著低于癌旁组织;结直肠癌组织中RUNX3蛋白的相对表达量显著低于癌旁组织,结肠癌细胞系HCT-116和SW-480细胞中RUNX3蛋白的相对表达量均显著低于正常结肠上皮细胞NCM460,而结肠癌细胞系HCT-116和SW-480细胞中RUNX3蛋白相对表达量比较差异无统计学意义。贾光辉[18]、孙光源等[19]通过蛋白免疫印迹法检测RUNX3蛋白在66对配伍的结直肠癌组织和癌旁组织中的表达水平,结果发现,RUNX3在结直肠癌组织中的表达较癌旁组织显著下调。另有研究表明,大肠癌中的RUNX3表达量较正常黏膜组织显著降低,且RUNX3在伴有淋巴结转移组和低分化组中的表达水平显著低于未转移组和中高分化组。上述研究与本研究结果一致,即结直肠癌组织中RUNX3高表达率显著低于癌旁组织,结直肠癌细胞中RUNX3的表达水平显著低于正常肠上皮细胞,这提示RUNX3基因的沉默、失活可能与结直肠癌的发生、发展存在相关性。
目前,围绕RUNX3基因表达下调的相关分子机制,有研究指出,RUNX3基因表达下调与该基因启动子区域甲基化密切相关[20],而RUNX3基因表达下调会导致TGF-β信号转导通路受到抑制,造成细胞凋亡失控,引发癌变可能。袁泽龙等[21]在关于zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)和RUNX3在进展期直肠癌新辅助化学治疗敏感性关系的研究中发现,与直肠癌旁组织相比,RUNX3蛋白在癌组织中表达显著下调,可能与 EZH2通过诱导H3组蛋白的第27位赖氨酸发生甲基化而沉默RUNX3蛋白表达有关,其通过多因素logistic回归法分析发现,RUNX3蛋白表达差异也是影响新辅助化学治疗疗效的影响因素之一,即RUNX3蛋白表达越低,疗效越差。LI[22]研究显示,RUNX3基因在结直肠癌组织中显著下调,并且与结直肠癌的分期和转移相关,RUNX3在TNM分期Ⅰ、Ⅱ期患者的癌组织中表达水平高于Ⅲ、Ⅳ期患者,提示低表达RUNX3患者往往预后不良。因此,为进一步探究RUNX3表达与结直肠癌患者临床病理特征及预后的关系,本研究根据免疫组织化学检测结果对结直肠癌患者RUNX3表达水平与患者临床病理特征的相关性进行统计分析,结果发现,RUNX3蛋白表达与患者是否发生淋巴结转移、远处转移及TNM分期相关,这进一步提示,RUNX3可能作为一种抑癌基因抑制结直肠癌的发生、发展, RUNX3表达水平可反映结直肠癌患者的恶性程度,其可作为判断结直肠癌预后的一个指标。
本研究Kaplan-Meier生存曲线分析结果显示,RUNX3高表达患者的生存率显著高于低表达患者,提示RUNX3低表达可能不利于患者生存。同时,本研究通过COX模型单因素及多因素分析显示,肿瘤的 TNM分期及RUNX3表达水平是影响结直肠癌患者预后的独立危险因素。以上结果提示,RUNX3与结直肠癌的发生、发展、不良预后具有高度相关性,可作为判定患者预后的潜在指标。
综上所述,RUNX3在结直肠癌组织中呈低表达,且与结直肠癌的发生、发展及不良预后有高度相关性,其可能参与了结直肠癌的发生、发展,但具体的调控机制尚待进一步研究。

