TNF-α对肠屏障功能的影响及机制
阿曼古丽·莫明,卡依赛尔·阿布都肉苏力,雷泓,张琪,宋云林
1新疆医科大学第一附属医院重症医学中心,乌鲁木齐 830054;2新疆医科大学第一附属医院医学研究中心
肠屏障主要由单层上皮细胞紧密连接组成的机械屏障、黏液层组成的化学屏障和固有层的免疫屏障构成[1]。其中黏液层作为肠屏障中的第一道天然屏障,可将肠上皮细胞层与肠腔隔开,起到保护上皮细胞免受病原菌或其他毒素等的刺激和攻击[2],维持其完整性对于保护肠屏障功能尤其重要。黏蛋白2(MUC2)是黏液层的主要成分,其水平降低会引起黏液层变薄、通透性增加,促进病原菌大量迁移至上皮细胞,进而引起各种肠道疾病[3]。异常水平的肿瘤坏死因子-α(TNF-α)可激活JNK信号通路,形成TNF-α/JNK连接炎症/应激信号的网络,从而影响肠屏障功能[4]。然而,TNF-α、JNK信号通路及MUC2之间的相互影响和肠道发病机制的特征尚不明确。2022年3月—7月,我们探讨了TNF-α对肠屏障功能的影响及作用机制。现报告如下。
1 材料与方法
1.1 材料人结直肠腺癌(Caco-2)细胞购于武汉普诺赛生命科技有限公司,TNF-α购自义翘神州科技股份有限公司;PBS、DMEM高唐培养基和CCK8试剂盒均购自白鲨生物科技有限公司;胎牛血清和胰酶购自美国Gibco公司;兔抗MKK4、MEKK1、GAPDH兔抗多克隆抗体和羊抗兔Ⅱ抗均购自武汉三鹰生物技术有限公司;全蛋白提取试剂盒购自索莱宝生物科技有限公司;RT-PCR试剂盒购自成都福际生物技术有限公司;引物均由上海生工生物工程股份有限公司合成。
1.2 细胞培养及实验分组取Caco-2细胞,使用含20%胎牛血清、1%双抗和DMEM高糖培养基的完全培养基培养,置于37℃、5%CO2的细胞培养箱中,24 h换1次液,待其长满用0.25%胰酶消化,2∶1传代培养,待其稳定生长,取对数生长期的细胞开展后续实验。细胞稳定生长后随机分为四组,对照组给予完全培养基培养,低剂量组给予TNF-α 100µg/L,中剂量组给予TNF-α 120 µg/L,高剂量组给予TNF-α 140µg/L,培养6 h后,收集细胞、上清及蛋白等。
1.3 细胞形态学改变倒置显微镜下观察Caco-2细胞形态学改变。将细胞用胰酶消化,1 000 r/min离心5 min(离心半径17.79 cm),弃上清,加1 mL完全培养基重悬细胞,并使用细胞计数板计数,以1×106/孔的密度接种于6孔板内,每组设3个复孔,放入培养箱内培养24 h,使细胞贴壁并进入对数生长期进行干预,6 h后,弃培养基,用PBS洗1次,使用倒置显微镜观察细胞形态学改变。
1.4 细胞活力检测采用CCK-8法。将稳定生长的Caco-2细胞以1×104/孔的密度接种于96孔板内,每组设5个复孔,放入培养箱内培养24 h,使细胞贴壁并进入对数生长期进行干预,待6 h后,先弃去原有培养基,避光状态下每孔加入100 µL DMEM基础培养基+10 µL CCK-8试剂,再放回细胞培养箱内培养2 h,取出后用酶标仪检测450 nm波长处光密度(OD)。细胞活力=[OD(加药)-OD(空白)]/[OD(未加药)-OD(空白)]×100%,计算每组细胞的细胞活力。
1.5 细胞MUC2 mRNA检测采用RT-qPCR法。使用RNA提取试剂盒提取各组Caco-2细胞总RNA,将RNA反转录为cDNA,再使用实时荧光定量PCR仪进行PCR检测。PCR反应条件:95℃3 min,95℃10 s、60℃30 s共40个循环,最终数据以2-ΔΔCT进行分析,每个样本重复3次。引物序列:GAPDH正向引物:5'-TGCACCACCAACTGCTTAGC-3',反向 引物:5'-GGCATGGACTGTGGTCATGAG-3'。MUC2正向引物:5'-CCTTCCTCTGTGCTTATCTGCTGTG-3',反向引物:5'-GGTGTCTCCGTATGTGCCGTTG-3'。
1.6 JNK1和MKK4蛋白表达检测采用Western blotting法。待干预时间到6 h,收集四组细胞并用预冷的PBS洗2次,用胰酶消化并以1 000 r/min离心5 min(离心半径17.79 cm),再用PBS重悬细胞移至1.5 mL的EP管;根据全蛋白提取试剂盒的操作说明进行贴壁细胞蛋白提取,使用BCA蛋白浓度测定试剂盒检测蛋白浓度,调整各组蛋白浓度至一致并使蛋白变性,上样进行SDS-PAGE分离;电泳结束后用PVDF膜进行转膜,洗膜5次/5 min,牛奶封闭2 h,洗膜5次/5 min;随后加入一抗,JNK1抗体(稀释比例1∶1 500)、MKK4抗体(稀释比例1∶1 000)和GAPDH抗体(稀释比例1∶20 000),4℃冰箱过夜。次日,回收一抗,洗膜5次/5 min,孵育二抗HRP(稀释比例1∶10 000),洗膜5次/5 min,配制ECL显色液,进行曝光。
1.7 统计学方法采用Graphpad Prism 8.0.1软件。计量资料符合正态分布以±s表示,多组数据间的比较用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度TNF-α对Caco-2细胞形态的影响不同浓度的TNF-α分别干预Caco-2细胞6 h后,倒置显微镜观察可见,对照组细胞形态无明显变化,排列整齐,细胞间紧密连接清晰可见(图1A)。不同浓度TNF-α刺激6 h后,细胞形态发生变化,由不均一多边形逐渐转变为圆形,排列紊乱且细胞间紧密连接逐渐消失(图1B-D)。

图1 不同浓度TNF-α对Caco-2细胞形态的影响
2.2 不同 浓 度TNF-α对Caco-2细 胞 活 力 的 影响CCK-8法检测结果显示,对照组、低剂量组、中剂量组和高剂量组细胞活力分别为1.071±0.021、0.767±0.028、0.487±0.021、0.249±0.005;与对照组相比,低剂量组、中剂量组和高剂量组细胞活力下降(P均<0.05);低剂量组、中剂量组和高剂量组两两比较差异均有统计学意义(P均<0.05);TNF-α对Caco-2细胞活性有抑制作用,存在剂量依赖性。
2.3 不同浓度TNF-α对Caco-2细胞中MUC2 mRNA表达的影响RT-qPCR结果显示,对照组、低剂量组、中剂量组和高剂量组MUC2 mRNA相对表达量分别为1、0.451±0.071、0.159±0.040、0.109±0.001;与对照组相比,低剂量组、中剂量组和高剂量组MUC2 mRNA表达逐渐降低,高剂量组较明显,差异均有统计学意义(P均<0.05)。
2.4 不同浓度TNF-α对Caco-2细胞中JNK1和MKK4蛋白表达的影响Western blotting结果显示,与对照组相比,低剂量组、中剂量组和高剂量组JNK1蛋白表达逐渐升高,高剂量组较明显,差异均有统计学意义(P均<0.05);与对照组相比,低剂量组、中剂量组和高剂量组MKK4蛋白表达升高,差异均有统计学意义(P均<0.05)。见表1。
表1 不同组中JNK1和MKK4蛋白表达比较(±s)
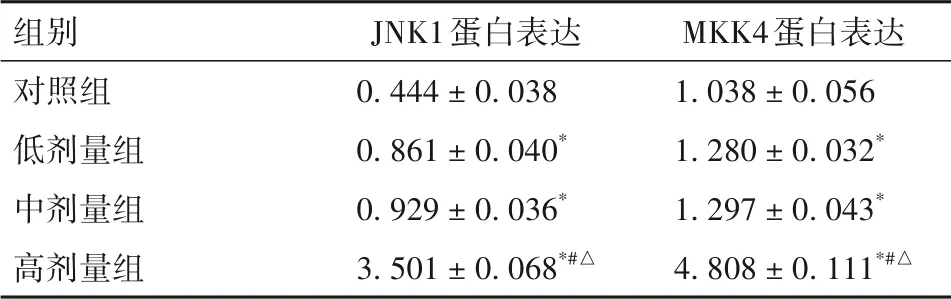
表1 不同组中JNK1和MKK4蛋白表达比较(±s)
注:与对照组比较,*P<0.05;与低剂量组比较,#P<0.05;与中剂量组比较,△P<0.05。
组别对照组低剂量组中剂量组高剂量组JNK1蛋白表达0.444±0.038 0.861±0.040*0.929±0.036*3.501±0.068*#△MKK4蛋白表达1.038±0.056 1.280±0.032*1.297±0.043*4.808±0.111*#△
3 讨论
肠屏障中黏液层是保护胃肠道的第一道防线,可有效防止肠上皮细胞层与肠腔内的病原微生物及毒素等的直接接触,同时在建立共生肠道菌群等方面扮演重要角色[5-6]。目前,虽然对黏液层的调节越来越受到科学界的关注,但因其是一个复杂的动态系统,对其仍知之甚少。MUC2是一种高度糖基化的分泌型黏蛋白,可从杯状细胞被释放后形成黏液层的基本骨架,因此是黏液层最主要的结构和功能成分。其可以通过与肠内的树突状细胞(DC)相互作用,调控免疫信号的传递来阻止肠道抗原的免疫原性,保护肠上皮细胞免遭腔内细菌和食物抗原等的侵害,进而预防肠道炎症的发生[7]。此外,MUC2的寡糖链结构为肠道共生菌提供黏附点,有助于增强益生菌的定殖能力。然而,其合成与分泌的改变均会导致黏液层的变薄,促进病原微生物侵袭和黏附肠上皮细胞,造成肠屏障功能障碍,进而诱发一系列的肠源性疾病发生,如炎症性肠病、结直肠癌、肠道感染(一系列由寄生虫、病毒和细菌引起)、其他肠道疾病(如乳糜泻、囊性纤维化)等[8]。因此,MUC2与许多重要的肠道病理密切相关,在保护肠屏障、调节菌群稳态和预防肠道疾病等方面发挥重要作用[9]。
然而部分炎症标志物,如TNF-α,可激活NF-κB通路并刺激MUC2的转录,而通过JNK通路起到抑制性作用[10]。TNF-α是炎症反应中的重要介质,主要由活化的巨噬细胞分泌,其主要有3种信号传导途径,分别是Caspase家族介导的细胞凋亡、衔接蛋白TRAF介导的转录因子NF-κB和JNK蛋白激酶的活化等[11]。一般情况下,生理水平的TNF-α具有免疫调节和抗感染等作用,但其异常水平和持续时间会破坏机体的免疫平衡,导致其他炎症介质的产生和释放,扩大炎症反应的水平,促进急性期蛋白表达,介导创伤后病理改变,引起多器官功能障碍综合征(MODS)、IBD和CRC等[12-13]。有研究表明,持续高水平的TNF-α会引起急性结肠炎;在肠黏膜损伤过程中,TNF-α活化多形核粒细胞,使其产生大量的氧化剂和蛋白水解酶,最终导致肠屏障功能障碍[14]。与此同时,TNF-α诱导IL-1和IL-6的基因表达,活化磷脂酶A2,使得花生四烯酸分解,生成炎症介质,从而加重肠道的炎症反应和缺血缺氧[5]。
c-Jun氨基末端蛋白激酶(JNK)信号通路作为丝裂原激活蛋白激酶(MAPK)的一个亚家族,是一种细胞应激通路,参与调节多种细胞过程,包括细胞增殖、分化、存活、凋亡和炎症等[15]。MAPK通路中的每一条通路均通过一系列的磷酸化反应激活,在JNK信号通路中,MAP3K家族上游成员磷酸化并激活MAP2K酶(MKK4和MKK7),进而磷酸化并激活JNK。促炎细胞因子和氧化应激等与肠屏障功能障碍相关的因素均会激活JNK信号通路,如异常的TNF-α信号激活JNK信号通路,形成连接炎症/应激信号的网络TNF-α/JNK,随后,通过转录因子c-Jun在转录水平上对某基因的表达进行调节[16-17]。本研究中,使用不同浓度的TNF-α干预细胞,6 h后倒置显微镜观察到细胞形态的变化。对照组细胞形态无明显变化,排列整齐,细胞间紧密连接清晰可见;但用TNF-α处理的3组细胞形态发生变化,由不均一多边形逐渐转变为圆形,排列紊乱且细胞间紧密连接逐渐消失。同时CCK-8检测结果显示,与对照组相比,其他3组细胞活力下降,差异有统计学意义;表明异常水平的TNF-α对Caco-2细胞活性有抑制作用,并且存在剂量依赖性,随着TNF-α浓度升高,对Caco-2细胞活性的抑制作用增强。RT-qPCR结果显示,与对照组相比,其他3组的MUC2 mRNA表达逐渐降低,而Western blotting结果显示,通路相关蛋白JNK1和MKK4表达逐渐升高,差异均有统计学意义。表明TNF-α经JNK信号通路参与了MUC2表达调控,而MUC2表达改变进一步导致肠屏障功能障碍,诱发一系列的肠源性疾病发生。
综上所述,异常水平的TNF-α经过JNK信号通路降低MUC2表达,造成肠屏障功能障碍;其机制可能是异常水平的TNF-α激活JNK信号通路,下调MUC2的表达,使得黏液层变薄、通透性增加,促进细菌大量迁移至肠上皮细胞,引起各种肠道疾病。本研究存在以下不足:①仅进行了细胞实验,并未做到体内-外实验结合;②仅选择了单一时间点对细胞进行干预处理,未做时效研究;③本研究中检测通路相关蛋白时,仅从蛋白水平进行了检测,未在基因水平对其表达进行验证。今后尚需进一步研究完善结论。

