水稻高温感知及响应机制的研究进展*
阚义,林鸿宣†
①中国科学院分子植物科学卓越创新中心,植物分子遗传国家重点实验室,上海 200032;②岭南现代农业科学与技术广东省实验室,广州 511431
近些年来,随着人口的不断增长以及人类活动的不断加剧,全球气候变暖成为世界一大主要问题。极端高温天气的频繁出现,对全球种植业造成严重的损失,气候变化引起农作物的大量减产,威胁世界粮食安全(图1(a)和(b))。据统计,全球年平均气温每升高1℃,会对小麦、水稻、玉米、大豆等主要粮食作物造成6%、3.2%、7.4%和3.1%等不同程度的减产[1]。水稻作为主要的粮食作物之一,为世界上绝大多数的人口提供着主粮,也是科学研究中最重要的单子叶模式植物之一。随着种植技术的发展和水稻育种领域的进步,全球范围内水稻的种植面积逐步扩大,其产量也在逐年攀升。2020年全球水稻种植总面积已超过1.64亿hm²,产量超过7.57亿t。就地区而言,亚洲的水稻产量占全世界水稻产量份额的90.5%,同时,中国已经跃居全球最大水稻生产国(图1(c)~(e))。

图1 全球平均气温及水稻种植面积和产量变化(数据来源:http://www.fao.org):(a)全球温度变化地理分布图;(b)1961—2021年全球平均气温变化图;(c)全球水稻种植面积分布图;(d)1994—2020年各大洲水稻产量分布图;(e)前10位水稻生产国及对应的平均产量
水稻作为一种高温短日照作物,在整个生育周期需要较高的温度,但是苗期和孕穗-灌浆期极易受到高温的影响。尤其是在长江流域地区,水稻孕穗-灌浆时期正值高温,极端高温的出现会造成双季早稻和早熟中晚稻的大面积减产。高温对水稻的影响,包括但不限于:影响花粉发育,造成花粉活力降低;影响花药基部开裂进而影响开花散粉,最终导致授粉受精不良;影响籽粒灌浆速率等过程,导致垩白率增高以及粒重下降,最终导致水稻产量和品质的降低[2-4]。
然而,目前生产上推广的优质高产水稻品种其耐热性能较差。以常规高产籼型水稻——华粳籼74(HJX)为例,灌浆初期暴露在极端高温条件下(正午平均6 h温度:>38℃持续6天,37~38℃持续5天,32~37℃持续10天,< 32℃持续4天),单位面积的小区产量约减少67.14%(图2)。通过正向遗传学手段,挖掘耐高温的自然位点,并通过杂交及分子育种的相关手段,将耐高温位点导入到高产品种中,可减少高温胁迫对水稻产量的影响。例如:导入热带粳稻来源的抗热位点——TT2(Thermotolerance 2)到HJX品种中,可将产量损失率降低到42.87%,使其在高温条件下与对照组相比产量提高80.33%(图2)。因此,培育“环境广适、优质高产”的新型作物是应对全球气候变暖带来的粮食安全问题、实现绿色农业和可持续发展的重要手段。利用遗传群体挖掘优异的种质资源,完善作物感知、应答高温胁迫的分子调控网络,对于培育耐高温作物品种以应对极端高温的自然气候具有重要意义。

图2 高温对水稻产量的影响:(a)上海松江地区25天最高气温和最低气温变化图(左侧),高温处理大棚在25天内每日10:00—18:00温度变化图(右侧),虚线位置表示38℃高温;(b)25天大棚高温处理后,感热水稻和抗热水稻的田间表型(结实率及灌浆程度);(c)感热水稻和抗热水稻在正常条件和热处理后的田间小区产量,t检验结果表明两者具有差异显著性
1 植物如何感知高温
高温以波的形式被植物体所感知,因此植物体对高温的感知几乎不受空间的阻隔,可以同时在多个亚细胞定位水平上发生,同样亦可在信使RNA(message RNA, mRNA)和蛋白水平上同时发生。尽管如此,细胞膜仍然是高温感知的主要场所,蛋白水平上的变化,如亚细胞定位以及蛋白构象发生变化等,则是植物感知高温的主要方式。ELF3(EARLY FLOWERING 3)在低温条件下,通过特定的结构域以活性的状态散布在细胞内部,并且能够与目标基因结合且对其发挥抑制作用,但是当温度升高时,ELF3会形成相分离的液滴,从而阻隔ELF3与目标基因的结合,最终解除其对下游基因的抑制作用,从而将信号传导下去[5]。RNA二级结构的变化,也可以作为一种感知高温的方式。mRNA的5'UTR(untranslational region)会在高温诱导下形成一个特殊的发卡结构,这个结构会诱导mRNA翻译成蛋白,并最终激活下游相关基因的表达[6]。此外,在高温感知的过程中,某些信号分子,如钙信号、一氧化氮(NO)等也发挥必不可少的作用。这些信号往往在高温刺激下快速产生,并通过各种方式辐射到植物体的各个组织,下游响应因子,例如结合钙信号的钙调蛋白以及可被NO亚硝基化的转录因子,可以识别这些信号分子从而实现高温信号的感知[7-8]。
2 植物对于热胁迫的响应
热胁迫使细胞膜流动性以及膜组分发生变化,导致膜损伤,从而打破了细胞的内稳态平衡,进而会影响核内的DNA复制和转录,使内质网中的蛋白质发生错误折叠而产生毒性蛋白,导致叶绿体和线粒体功能失常,进一步诱发胞内活性氧类化合物(reactive oxygen species, ROS)的积累,并最终导致细胞损伤甚至死亡。因此,植物通过各种方式来应对热胁迫带来的内环境稳态的失衡[9]。
2.1 细胞膜流动性的响应
在热胁迫的初期,高温诱导细胞膜中不饱和脂质组分的升高,使得细胞膜处于“活跃”的紊乱状态,因此减少膜的流动性是植物进化出来的一种应对高温胁迫的策略[10]。脂肪酸去饱和酶(fatty acid desaturase, FAD)在高温下降解,从而导致膜饱和度的增加,帮助植物适应热胁迫。在玉米中,转录组测序数据显示FAD家族的ZmFAD2.1和2.3以及ZmSLD1和3的表达量受热均呈现出明显的下调,以降低脂肪酸的不饱和度来应对高温胁迫[11]。在大豆中,FAD表达的降低出现在耐高温的株系中,进一步抑制了热胁迫下不饱和酰基链的水平,最终维持膜的稳定性和正常功能[12]。
2.2 蛋白质内稳态的响应
高温使得蛋白质未折叠或错误折叠而产生毒性蛋白,毒性蛋白的积累使得细胞内稳态濒临崩溃,因此,植物通过各种方式产生热激蛋白(heat shock protein, HSP)和热激响应因子(heat shock response, HSR)来帮助复性错误折叠蛋白,以应对胞内蛋白稳态的失衡。HsfA1作为一个转录因子主导调控植物热休克反应,可以正向激活并调控下游响应因子。在拟南芥中,HsfA1的表达受热诱导:正常温度下,热激蛋白HSP70和HSP90会抑制HsfA1的活性和细胞核定位;而热胁迫条件下,HsfA1从HSP70和HSP90上解离,从而导致HsfA1被激活,进一步启动下游靶基因的表达,增强植物的耐热性[13]。
2.3 活性氧内稳态的响应
高温逆境下,植物细胞会产生大量的活性氧类化合物,比如单线态氧(1O2)、超氧阴离子自由基(O2-)、过氧化氢(H2O2)和羟基自由基(OH-)等。前期积累的ROS作为重要的信号分子激活热休克反应,过量的ROS积累则导致细胞内的氧化不平衡,对细胞造成损伤。植物能够通过激活抗氧化酶,如过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等解除ROS毒害。在印度面包小麦中,WH730基因型的材料可以通过提高旗叶以及发育中的花药的抗氧化酶活性而促进ROS的清除,维持花粉活力和产量,从而表现出潜在的耐热性[14]。
3 水稻耐高温机制研究进展
3.1 细胞膜水平
钙离子通道CNGC(cyclic nucleotide gated channel)家族中的OsCNGC14和OsCNGC16近期被证明参与水稻的热响应和热胁迫耐受,功能缺失的cngc14和cngc16突变体表现出明显的热敏感表型[15](图3)。位于细胞膜上的类受体激酶ERECTA的过表达能够减少热胁迫带来的细胞损伤,并最终增强水稻的抗热能力[16](图3)。25L1和25L2作为两个亮氨酸富集的受体激酶,对于调控水稻温度相关的生长具有重要意义[17]。位于细胞膜上的G蛋白γ亚基——TT2参与调控热刺激下的钙信号,并最终通过影响蜡质代谢途径影响水稻耐热[18](图3)。正常条件下具有7次跨膜域的E3泛素连接酶——TT3.1(thermotolerance 3.1),能够响应高温信号,从细胞表面转移至多囊泡体中,实现高温信号的转导[19](图3)。细胞膜定位的转录因子OsNTL3可以在高温条件下获得入核活性,并激活下游的转录[20](图3)。综上所述,在水稻对于高温的感知和响应过程中,细胞膜上的相关蛋白发挥着重要的作用。
3.2 内质网水平
内质网中的未折叠蛋白响应(unfolded protein response, UPR)是由热胁迫导致的内质网中错误折叠蛋白积累过多而引发的。在内质网胁迫中,高温胁迫促使OsIRE1对OsbZIP74的mRNA加工并剪切掉其中的一段茎环结构,被剪切后的OsbZIP74可以从内质网定位转移到核定位。高温使得内质网定位的OsbZIP74与细胞膜定位的OsNTL3在细胞核中相遇,而OsNTL3可以直接结合到OsbZIP74的启动子区域,并且调控OsbZIP74的表达[20](图3)。相应地,OsNTL3也会受热胁迫诱导,并且该过程依赖于OsbZIP74[20](图3)。
3.3 叶绿体水平
叶绿体对高温胁迫极其敏感,尤其是光系统II中的D1蛋白,会在高温条件下受损严重,因此充足的D1蛋白供应能够保证高温条件下叶绿体的正常运转,保证能量的充足供应以应对极端高温。当通过遗传操作手段,构建起一条由高温响应启动子驱动的细胞核融合基因表达的D1蛋白合成途径,可显著提高水稻在高温条件下的耐受能力,增强光合作用的效率,并最终获得较高的生物量和产量[21]。PGL(pale green leaf)编码叶绿素a加氧酶,当其功能缺失时,水稻呈现出明显的高温不耐受表型[22](图3)。WLP2/OsFLN编码一个pfkB类型的糖类的激酶,它可以通过一个TRX-FLN调控通路与水稻硫氧还蛋白OsTRXz来维持胞内的氧化还原平衡,并保护叶绿体在高温条件下免受损害[23](图3)。HSA1/OsFLN2同样被报道参与高温条件下水稻叶绿体的保护[24](图3)。位于胞质中的叶绿体前体蛋白TT3.2,在高温条件下会以成熟的形式在叶绿体中积累,过度积累的TT3.2会导致叶绿体损伤,进而使得水稻对于热胁迫呈现出敏感的表型,因此及时降解TT3.2,以防止其在叶绿体中过度积累,对于提高水稻耐热具有重要意义[19](图3)。
3.4 核酸层面
当植物暴露在高温胁迫环境时,极端的高温会诱导植物体内产生过高水平的ROS,从而导致基因组DNA的损伤,使得植物在生长发育上出现严重的异常。LS1编码一个RNase H2 复合体的亚基,可以维持基因组的稳定性,并且可以在高温高光的条件下保护植物免受DNA损伤,阻止叶绿体降解和细胞的凋亡[25](图3)。OsNSUN2编码一个m5C(RNA 5-methylcytosine)的甲基化转移酶,OsNSUN2依赖的m5C位点有1/3都聚集在编码叶绿体蛋白的mRNA上,osnsun2突变体呈现出叶绿体功能紊乱的表型,进一步导致光依赖的活性氧积累,并最终降低了水稻的热胁迫耐受能力[26](图3)。
3.5 蛋白层面
高温会导致胞内产生大量的未折叠或错误折叠蛋白,从而进一步产生毒性蛋白。水稻主要通过两种方式应对高温导致的蛋白内稳态紊乱:稳定蛋白质的翻译和清除/复性未折叠毒性蛋白。TOGR1编码一个核定位的DEAD框RNA解旋酶,其表达水平受到高温的诱导,并且可以保护核糖体RNA前体结构的稳定性,保证高温条件下蛋白翻译的正常进行,并最终赋予植物抵抗高温的能力[27](图3)。SLG1编码一个tRNA硫醇化修饰的蛋白,可以通过维持热胁迫下正常的tRNA硫醇化水平来保证蛋白质翻译过程,进而正向调控水稻的耐热能力[28](图3)。AET1编码的是一个tRNAHIS的尿苷转移酶,它对于热胁迫下tRNAHIS前体的修饰十分重要,AET1-RACK1A-elF3h复合体对于高温条件下蛋白质的翻译发挥着至关重要的作用,aet1突变体呈现为热胁迫下发育异常的表型[29](图3)。
在水稻中有一类分子伴侣蛋白HSP,可以稳定、复性或者降解未折叠的蛋白。过表达OsHSP101会增强水稻的耐热性,并且可与HSA32形成正反馈调控[30]。TT1是水稻中定位到的第一个抗热数量性状基因座(quantitative trait locus, QTL)位点,编码26S蛋白酶体的一个亚基(α2),其作用机制是通过降解泛素化的变性蛋白并及时有效地清除高温逆境下细胞内产生的大量变性蛋白,来保证细胞内正常的蛋白质代谢过程,缓解胁迫压力[31](图3)。此外,OsHTAS也能够通过与泛素/26S蛋白酶体的互作来参与未折叠蛋白的清除[32](图3)。
3.6 代谢层面
植物在遭受热胁迫期间会产生大量的ROS,前期积累的ROS作为重要的信号分子激活热休克反应,过量的ROS积累则导致细胞内的氧化不平衡,对细胞造成损伤。OsANN1是一个钙结合的膜联蛋白(annexin),可以通过调节热胁迫下抗氧化物质的积累来赋予水稻热胁迫耐受的能力[33](图3)。OsHTAS编码一个环指(RING-finger)泛素E3连接酶,可以通过脱落酸(ABA)依赖和DST(drought and salt tolerance)依赖的途径来调控胞内过氧化氢的积累,并进一步调节热胁迫下的气孔开度[32](图3)。DST作为一个C2H2锌指结构的转录因子,可以通过调节氧化还原内稳态相关基因的表达来决定水稻的抗热能力[34](图3)。NAC家族的转录因子OsSNAC3,在转录水平上调控ROS清除相关酶的表达,从而维持热胁迫下ROS的平衡,并最终赋予水稻抗热的能力[35](图3)。
另外,黄酮醇可以作为抗氧化剂来调控热胁迫条件下ROS水平的动态平衡,保护花粉免受热胁迫期间ROS升高对花粉活力和花粉管生长的影响[36]。除黄酮醇外,黄酮苷(包括花青素)在高温等非生物胁迫下的积累,对保护植物免受氧化损伤也具有重要意义。逆境胁迫下UDP糖基转移酶——GSA1(grain size and abiotic stress tolerance 1)可以调控水稻代谢的流向,下调木质素合成途径,上调黄酮糖苷等合成途径,例如增强花青素的合成途径,最终使得水稻抵抗热胁迫的能力增强[37](图3)。

图3 水稻在不同亚细胞结构和生理生化过程中的高温响应调控机制。实线直线箭头表示激活的信号转导,虚线直线箭头表示间接激活/推测的信号转导,实线平箭头表示抑制,折线实线箭头表示转录激活
4 水稻耐高温自然位点的定位克隆与功能机制研究进展
目前为止,虽然在水稻中已发现了多个调控水稻耐热能力的功能基因,但其中绝大多数并不是增强抗热的自然变异位点,因此需要人工干预引入强启动子、破坏microRNA结合位点等方式来提高这些基因的本底表达水平。然而,目前转基因技术在农作物农业生产上还不能大面积推广应用,因此利用遗传学手段发掘自然界中优异种质资源中的优良自然变异位点,通过使用分子标记辅助选择进行育种,将优良耐热位点渗入目标品种,实现作物对高温适应力的提高,是应对人口增长和全球气候变暖造成的粮食安全问题的一大重要举措。林鸿宣院士团队长期致力于水稻耐高温位点的定位克隆以及在全球气候变暖的形势下如何提高作物的耐热及稳产的机制研究,目前已取得重要进展。该团队定位到3个重要的水稻抗热QTL位点,并对其机理展开深入研究,揭示了3条崭新的耐热调控通路,为未来精准的分子育种技术提供重要的指导,具有重要的理论和现实意义。
4.1 主动出击、先发制敌——TT1
植物在遭受外界的高温侵害时,往往会产生一系列的应对措施来及时地将高温诱导的胞内有害物质清除,因此应对措施强度和效率的提高,可以有效地帮助植物渡过难关。通过以耐高温的非洲栽培稻(CG14)为供体亲本和相对高温敏感的武运粳7(WYJ)为轮回亲本构建的染色体片段替换系,林鸿宣院士团队成功分离克隆了水稻中的第一个抗热QTL位点——TT1。TT1编码26S蛋白酶体的一个亚基,并且在逆境下蛋白代谢过程中发挥着至关重要的作用。在来自CG14的TT1CG14编码的蛋白中,关键位点上的极性氨基酸精氨酸突变成组氨酸,造成了蛋白功能的差异,蛋白质组和泛素化蛋白组的实验表明,TT1CG14清除变性蛋白的效率更高,能够更好地维持逆境下的蛋白质动态平衡。此外,实验证明,相较于野生型,TT1CG14的表达量对高温的响应更快更高,因此TT1CG14能够显著地提高蛋白酶体对毒性蛋白的清除能力和对高温的响应速率,使得水稻可以在热胁迫来临之际主动出击,先发制敌,及时高效地避免毒性蛋白的积累,维持了胞内的蛋白质代谢平衡,帮助水稻抵御高温[31](图4)。

图4 TT1调控水稻耐热模式图。TT1通过介导高温诱导的变性蛋白降解,调控水稻的抗热能力,相较于亚洲栽培稻WYJ,非洲栽培稻CG14中的TT1有更强的毒性蛋白清除能力,因此赋予水稻高温抗性
4.2 静观其变、不欲其乱——TT2
植物在与高温的长期对抗中进化出不同的应对机制。植物可以主动适应高温逆境,充分调动下游的生理生化响应来对抗高温,但是热响应以消耗能量为前提。在热胁迫下,叶绿体的功能受损,植物长时间处于能量匮乏状态,调动能量来响应高温势必会降低基础生命活动的能量供应,因此,植物也进化出了一条“以静制动”的应对策略。TT2是林鸿宣团队定位到的第二个抗热QTL位点,其编码一个G蛋白γ亚基。相较于野生型TT2HJX,热带粳稻的TT2HPS32位点的第165位发生了碱基替换,使得TT2HPS32基因编码一个提前终止的功能缺失型蛋白,进而赋予水稻抵抗高温的能力。位于细胞膜上的TT2影响高温胁迫下的胞内钙信号,而热诱发的钙信号会通过钙调蛋白CaM被胞内的钙解码转录因子SCT1/2(sensing calcium transcription factor 1/2)所识别,进而将上游离子水平的钙信号转变为下游转录活性的变化,进而影响蜡质调节因子OsWR2(wax synthesis regulatory 2)的表达水平,最终通过影响水稻表层蜡质含量决定水稻的耐热性[18](图5)。在高温敏感的植株中,正常功能的TT2HJX确保高温诱导的胞内钙信号正常产生,钙信号促进SCT1/2-CaM的互作,加强了CaM对SCT1/2转录活性的抑制,最终下调了靶基因OsWR2的表达,使得高温条件下蜡质含量迅速降低。蜡质作为植物抵抗外界胁迫的第一层屏障,它的缺失导致水稻呈现高温敏感表型。然而,在抵抗高温的植株中,功能缺失的TT2HPS32使得高温诱导的胞内钙信号减少,进而减弱了SCT1/2-CaM的互作,从而一定程度上解除了CaM对SCT1/2转录活性的抑制,使得高温条件下OsWR2能维持正常的表达,蜡质含量能维持在正常的水平,最终呈现出高温耐受表型[36](图5)。该研究中阐述的TT2-SCT1-OsWR2调控通路是一条崭新的以蜡质含量变化为最终节点的分子调控通路。不同于以往的耐热机理,TT2和SCT1是调控水稻耐热的负向调控位点,功能缺失后使水稻对于热胁迫变得钝感,因此水稻在高温中能够静观其变,不欲其乱。钝感植株中的蜡质组分不会受热诱导而下调,从而维持了正常的蜡质含量,帮助水稻抵御高温。

图5 TT2通过介导钙信号影响蜡质代谢的调控模式图。TT2-SCT1/2-OsWR2调控通路解析了高温诱导的钙信号是如何解码为蜡质代谢响应这一重要的生理生化过程的。箭头越粗表示抑制或激活的程度更高,~表示基本维持不变,↓表示含量下降
4.3 其应如响、及时止损——TT3
TT3基因是水稻中首例被报道的由两个拮抗基因(TT3.1-TT3.2)组成的控制水稻抗热复杂数量性状的基因位点,同时TT3.1也是作物中被发现的第一个潜在的高温感受器。非洲栽培稻CG14来源的TT3相较于亚洲栽培稻WYJ有更强的抗高温能力,其中TT3.1编码一个细胞质膜定位的E3泛素连接酶,并正向调控水稻的耐热性。进一步的研究发现:TT3.1具备高温感受器的相关特征,正常条件下,TT3.1位于细胞膜这一关键位置,可以及时收集、识别和响应胞外的热刺激,并且迅速地从细胞表面转移至内体(endosome,晚期也称多囊泡体(MVB))中;而TT3.2作为一个水稻耐热的负调控因子,编码叶绿体前体蛋白,高温会导致成熟形式的TT3.2在叶绿体中过度积累,损伤叶绿体,因此在高温条件下有效降低TT3.2的含量,有助于水稻提高抗热能力[19](图6)。研究证明,TT3.1和TT3.2不仅在染色体上的物理位置相近,并且在调控通路上处于上下游关系,感知高温并从细胞膜上转移到MVB中的TT3.1可以招募和泛素化TT3.2进入MVB,并最终使TT3.2通过液泡降解,减轻了TT3.2在叶绿体中的积累,进而提高了水稻的耐热性[37](图6)。TT3.1CG14相较于TT3.1WYJ有更强的E3泛素连接酶活性,从而招募、泛素化更多的TT3.2蛋白,并通过MVB-液泡途径降解TT3.2,减轻了高温条件下TT3.2在叶绿体中的积累,保证了叶绿体的功能,并最终提高了水稻的高温抗性和产量[19](图6)。因此,TT3.1-TT3.2遗传模块阐述了一个从上游高温感知到下游蛋白降解的完整过程,首次将植物细胞质膜与叶绿体之间的高温信号联系起来,证实了植物中存在完善的信号感知-解码的调控通路。该分子模块的存在使得植物对外界刺激能够迅速灵敏地反应,并及时止损,清除掉相应的前体蛋白,以防止成熟蛋白产生,保障细胞功能的正常运转。
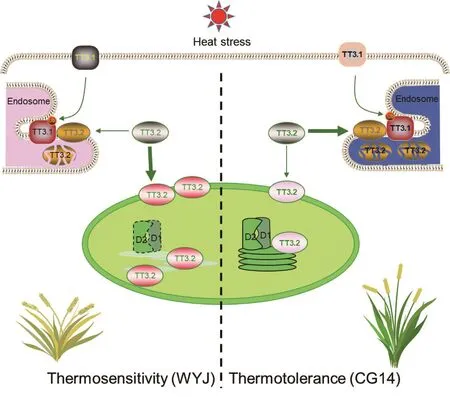
图6 TT3.1-TT3.2介导细胞膜-叶绿体信号转导调控水稻耐热模式图。TT3.1-TT3.2调控模块阐述了高温胁迫下细胞膜到叶绿体的信号转导过程。箭头粗细表示数量,Ub为泛素化,D1、D2为叶绿体关键蛋白,虚线表示蛋白受损
5 展望
随着作物功能基因组学研究的迅速发展,可以通过正向遗传学,借助遗传定位群体或GWAS(genome wide association study)定位克隆优异耐热种质资源中的抗热QTL基因位点,例如TT1、TT2、TT3;或是通过相关突变体克隆作物中调控耐热的关键基因,再寻找该基因在不同品种中的自然突变形式,并将其与耐热性进行关联,例如SLG1。但目前发现的作物抗热基因位点还很少,将来需要挖掘更多的耐热QTL位点/基因,为改善作物耐热性提供非常宝贵的有利基因资源。未来应该充分利用这些资源,实现作物对高温适应力的大幅度提高。
此外,大量证据表明,受到轻度初级胁迫的植物可以获得对第二种强胁迫的抗性,这种现象称为交叉耐性,能够使植物获得对胁迫的广泛耐受性。暴露于一定的压力下可以诱导胁迫记忆,这种记忆是持久的,并帮助植物在随后的胁迫事件中更好、更快地响应,这种现象称为启动[38]。事实上,非生物胁迫以及生物胁迫在农田环境中并非单一影响元素,植物通常同时暴露于多种胁迫下。随着田间种植技术的不断改良,为作物提供一系列的轻度胁迫处理,即通过交叉耐受和启动等可为增强作物综合抗逆能力提供潜在解决方案。

