Affibody分子在生物技术和医学应用中的研究进展*
郑 蕾,李欣禹,成 昭,徐 玥
(1.西安医学院 药学院,陕西 西安 710021;2.陕西省食品药品安全监测重点实验室,陕西 西安 710065)
上世纪90年代末,由于蛋白质工程技术的进步,产生多种非抗体蛋白质的骨架结构[1-2],Affibody分子就是其中之一,已进入早期临床开发阶段[3]。Affibody分子,也被称为亲和体或者多肽适体探针,属于新型亲和配体,是通过组合蛋白工程技术,设计生产的一类通用型的非免疫球蛋白亲和蛋白。自20世纪80年代被首次报道以来,因其区别于一般抗体分子的结构特征,功能方面独具优势,因此Affibody的应用研究与发展迅速,被越来越多的研究者们所关注,现已广泛应用于诊断和治疗领域[4]。作者将对Affibody技术的最新进展,尤其是已经进行转化的研究进行重点综述。
1 Affibody分子的结构与功能特点
Affibody分子是基于三螺旋束结构域框架的小(6.5-kDa)亲和蛋白。作为组合蛋白质工程产物,Affibody的结构能够根据组合蛋白质工程方法,选择性地进行设计,并与所需的靶分子结合,通过体外选择方法产生。Affibody分子为单链结构,1997年,Nord等人发现[5],Affibody分子最初是由葡萄球菌蛋白A的免疫球蛋白结合区域Fc段衍化而来,结构中含有3个α-螺旋亚结构域,呈现出特殊的“Z段”结构,具有相对分子质量小、稳定性高、易于改造等特点[6-8],就目前已报道的临床证据表明Affibody分子应用于人体有效且安全。通常,三螺旋束骨架结构中的螺旋一和二上,共包含可与受体结合的13个氨基酸残基位置,包含58个残基(6.5 kDa),如果希望骨架蛋白结构获得新的亲合活性,最直接有效的办法就是将其受体结合部位上的氨基酸,以合成DNA进行随机化序列重组,可构建获得庞大分子库,通过不同手段进行分离[9-10],改善蛋白支架的性能[11],后续可按需求通过耦合基因型或表型配对的方法进行选择,与不同的蛋白质进行基因融合[12-14]。小尺寸和易于工程化使Affibody分子适用于多特异性构建体,可使Affibody获得更优的亲和活性[15]。最新报道的Affibody分子库设计已运用三核苷酸密码子混合物,而不是简并密码子构建,这一技术实现设计的精准控制(例如实现排除半胱氨酸和脯氨酸的目的)。三核苷酸密码子混合物的设计使用,基于与相同靶标之间的序列相似性和/或基于单个残基对通过丙氨酸扫描获得的结合贡献度等信息,促进第二代亲和体分子具有更强的亲和性和稳定性。目前已有超过400项关于Affibody的研究发表,图1是目前文献报道的或已经进入临床开发阶段的Affibody分子信息[16]。
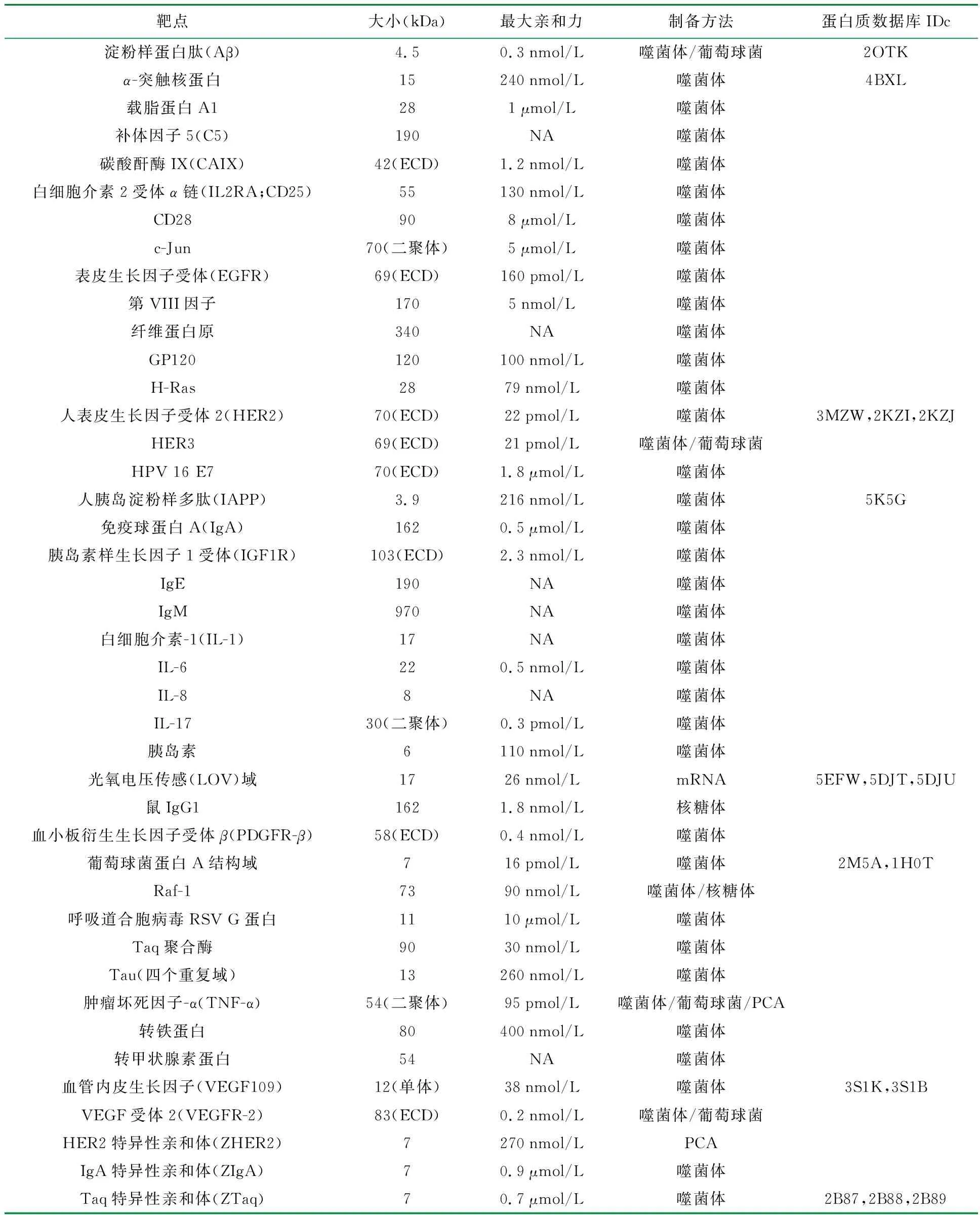
表1 文献报道的、已上市的或正在临床开发阶段的Affibody分子
与单克隆抗体相比,Affibody分子不仅选择性和亲和性高,具有耐热性能,易制备储存,便于化学修饰负载活性基团产生新功能,因其分子量小,也具有较高的细胞/组织穿透能力,使其更容易到达抗体无法到达的靶部位,同时非特异性结合部位中未结合的Affibody也可被迅速清除[4],利用这一性质可通过注射放射性核素标记的Affibody分子,短时间内就可以获得高对比度的图像信息,这对于临床诊断和手术辅助指导都具有重要意义。科学家们通过Affibody不同的特性,探索Affibody分子转化应用的潜力,开发其在影像学和治疗学方面的各项应用。
2 Affibody分子在影像学方面的应用
在疾病的发生发展过程中,某些特异性生物标记物的浓度很低,一般在微摩尔甚至更低的水平,这些痕量物质的获取和定量意义重大,因此临床中检测方法的灵敏度对于疾病的早期和精确诊断至关重要。
卵巢癌在所有妇科恶性肿瘤中的死亡率最高。HER2+是具有侵袭性,使得肿瘤发生远端转移的主要亚型。临床上常规使用PET/CT对卵巢癌进行功能成像检测以评估治疗反应。然而,这种成像方法并不能提供有关HER2等癌症特异性细胞表面生物标志物存在与否的信息,可见传统方法无法帮助医生决定是否选择免疫疗法来控制转移的发生。因此,为了区分卵巢癌肺转移中的HER2+和HER2-病变,Nomani等[17]利用基因工程改造钆(Gd)标记的Affibody-XTEN重组载体,用于检测卵巢癌肺转移,对该载体进行物理化学和生物学表征,以确定其纯度、分子量、流体动力学大小和表面电荷、血清稳定性、内毒素水平、松弛性和靶向HER2抗原的能力,证实通过改造的Affibody可以准确获取转移性病变的关键生物学信息,与其他成像方式结合使用,以预先筛选患者并确定免疫治疗的候选者,帮助医生选择最有效的治疗策略。
Yang等[18]:设计了一种与不同功能的纳米材料金(Au)和氧化铁(Fe3O4)结合的三峰纳米探针,实现了对表皮生长因子受体(EGFR)阳性肿瘤的成像。与其他具有单一成分的常规纳米结构不同,这种三峰纳米探针能够将多种成像模式相结合,提供互补信息。此外,这种异质纳米探针可以为靶向EGFR蛋白和PET成像报告分子,研究表明,所得到的纳米探针为人类EGFR表达细胞和肿瘤的PET和MRI成像提供了高特异性、灵敏度和出色的肿瘤对比度,进一步证明了异质纳米颗粒靶向EGFR及其进一步治疗诊断应用的可行性。
Orlova等[19]将Affibody分子ZHER2:342-pep2与1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸(简称DOTA)螯合剂进行位点特异性和均相缀合,在通过肽合成的单一化学过程。DOTA-ZHER2:342-pep2自发折叠并以65 pmol/L的亲和力与HER2结合。在室温和高达90 ℃下,30 min内即可实现111In掺入量大于95%有效放射性标记,对HER2阳性肿瘤具有特异性。赫赛汀预处理不干扰肿瘤靶向,结果表明,放射性标记的合成DOTA-ZHER2:342-pep2可有效应用于临床诊断HER2阳性表达的体内分子成像。
3 Affibody分子在肿瘤治疗方面的应用
在肿瘤药物治疗中,大多数药物都因具有细胞毒性,造成患者用药的毒副反应大,一定程度上影响了患者的生存质量。因此,越来越多的肿瘤治疗关注靶向作用,这种作用可以使得药物精准定位肿瘤细胞达到有效的治疗浓度,同时又最大程度的降低了对正常的组织器官的损害。近二十年来,Affibody参与纳米给药系统的构建,实现了现有抗癌药物的靶向作用,并在提高药物溶解度、稳定性、缓控释、增效减毒等方面取得了丰硕的成绩。将Affibody分子和抗肿瘤药物进行融合,从而实现肿瘤治疗的靶向性,因此目前Affibody分子在治疗学中主要应用于抗肿瘤治疗研究方向。
Zhang等[20]将G-四面体DNA胶束修饰的Affibody,结合5-氟脱氧尿苷和姜黄素,制备双载药DNA胶束(Cur@affi-F/GQs),其中Affibody可靶向促进HER2受体介导的摄取,用于Her2+胃癌的治疗,这种纳米材料可用于具有显着溶解度差异药物的靶向共递送;研究了5-氟尿嘧啶—Affibody核酸纳米粒用于HER2+乳腺癌[21],为核苷类抗肿瘤药物的转运提供了新的途径;通过链间交联或加合方法将DNA链与顺铂结合,制备DNA四面体-亲和体纳米颗粒,这种顺铂纳米颗粒对乳腺癌HER2过表达细胞BT474表现出高选择性和抑制作用,而在HER2低表达的MCF-7细胞中表现出较低毒性[22]。设计了一种共同装载核苷类似物(5-氟脱氧尿苷,FUdR)和蒽环类药物(阿霉素,Dox)的特异性Affibody-DNA杂化链修饰的金纳米颗粒(AuNP),并证明这些纳米颗粒通过诱导凋亡,对过表达HER2的乳腺癌细胞具有更好的协同抗肿瘤活性[23]。
HER2高表达是多数恶性肿瘤标志物。Altai等[24]研究了靶向HER2的Affibody分子ZHER2:2891与细胞毒性美登素衍生物MC-DM1缀合用于靶向癌症治疗的潜力。所得的Affibody药物偶联物可作用于过度表达的HER2细胞,具有与曲妥珠单抗emtansine相似的IC50值,且不影响HER2低表达的细胞。该化合物8.5 mg/kg剂量下可被小鼠良好耐受,并显示可以延长携带HER2过表达肿瘤的小鼠的存活时间。Zhao等[25]报告了一种钌催化剂Ru-Affibody分子,与肿瘤细胞上的HER2受体结合并原位催化吉西他滨前药活化,提高选择性、抑制肿瘤生长和减少副作用的,揭示了Affibody分子在HER2靶向癌症化疗中的潜力。Lan等[26]设计了一种前药系统ZHER2:2891-ABD-Fcy/5-FC,该系统使用5-氟胞嘧啶(5-FC)和靶向HER2的Affibody蛋白分子ZHER2:2891,与酵母胞嘧啶脱氨酶(Fcy)融合以靶向HER2过表达的癌细胞,并将5-FC转化为毒性显着增加的化疗药物5-氟尿嘧啶(5-FU)。Wang等[27]使用Her2特异性Affibody负载顺铂的纳米颗粒,将Her2靶向、诊断和温度致敏集成为一体,增加了肿瘤放化疗敏感性。Alavizadeh等[28]研究抗HER2-Affibody与顺铂PEG化脂质体的偶联,可有效提高靶向脂质体的治疗效果。Ding等[29]将Affibody载体与被重组表达为与白蛋白结合的融合区域(ABD)结合,用于延长血浆半衰期,1个或3个半胱氨酸结合于细胞毒性mcDM1分子结合的C末端。得到药物偶联物ZHER2-ABD-mcDM1和ZHER2-ABD-mcDM13,体外表征,确定了在携带HER2过表达SKOV3异种移植物的小鼠中的生物分布,载药量增加会导致对HER2的亲和力降低,但对HER2高表达的SKOV3细胞具有更强的细胞毒作用。Khaw等[30]将多柔比星联合anti-HER2-Affibody-anti-DTPA-Fab,治疗HER2+乳腺癌。Xu等[31]设计了一种新型的癌细胞靶向药物偶联物ZHER2:2891-ABD-E3-mcDM1,可有效抑制HER2+肿瘤。
表皮生长因子受体(EGFR)是癌症治疗的有效靶点。在Jia[32]的研究中,载有顺铂的聚乙二醇化脂质体(LS-DDP)——Affibody分子(EGFR拮抗分子),用于EGFR高表达肿瘤,在体内外均可主动靶向EGFR+A431肿瘤细胞,增强了抗EGFR+肿瘤作用。(ZEGFR:1907)2是一种新开发的二聚体亲和体分子,对EGFR的细胞外部分具有高亲和力。Sahlberg等[33]评估了(ZEGFR:1907)2在结肠癌细胞系HT-29和HCT116中靶向EGFR信号通路的细胞抑制作用。Ding等[34]设计了一种双功能抗体MaAbNA(Affibody靶向EGFR1和HER2),与阿霉素(ADM)偶联,形成新型复合抗癌药物MaAbNA-PEG2000-ADM,对高表达EGFR1和HER2肿瘤细胞表现出高度抑制作用,但在低表达细胞中毒性较小。
基于重组肿瘤坏死因子相关凋亡诱导配体(TRAIL)由于半衰期短,临床使用效率低。使用内源性长效蛋白(如IgG和白蛋白)作为载体的亲和控制释放可改善TRAIL的药代动力学特征。Yang等[35]研究了TRAIL结合Affibody分子LgBD,可增加其细胞毒性和抗肿瘤作用。Tao等[36]设计了一个三域TRAIL变体Z-ABD-TRAIL,通过将血小板衍生生长因子受体β(PDGFRβ)特异性亲和体ZPDGFRβ和白蛋白结合域(ABD)顺序融合到TRAIL的N端,从而参与精准癌症治疗。
Affibody分子因其典型的高亲和力、易于生产以及对药物分子装载和空间排列可控等优势,作为用于癌症治疗的细胞毒性药物的载体具有很大的前景。Xia等[37]研究由Affibody分子ZHER2:342和单甲基奥瑞他汀E(MMAE)在水溶液中制备自组装纳米偶联物,成功制备了用于靶向治疗癌症的Affibody-药物偶联物纳米剂,具有良好生物安全性和抗癌作用。Zhang等[38将Affibody共轭RALA(affi-RA)设计用于递送寡聚5-氟脱氧尿苷(FUdR,5-FU的代谢物)链,以提高5-氟尿嘧啶(5-FU)的选择性,降低其毒性并改善其治疗效果。Cho等[39]研究使用人血清白蛋白(HSA)和白蛋白结合肽(ABP)之间的强特异性相互作用来延长尿酸氧化酶(Uox)的释放,用于治疗高尿酸血症的治疗蛋白,通过将ABP-HSA相互作用应用于可注射水凝胶和治疗性蛋白,蛋白的浓度可以在体内长期保持,延长其治疗效果,改善了蛋白半衰期短的问题。Han等[40]探讨了新型靶向化疗药物ZHER2:V2-培美曲塞偶联物,用于晚期非小细胞肺癌的疗效和安全性。Koduvayur等[41]将前体药物激活酶脱氧胞苷激酶(dCK)的编码区与抗Her2亲和体和设计锚蛋白重复蛋白(DARPin)的融合,通过促进核苷类似物氟达拉滨的活化来杀死癌细胞的能力,实现核苷类似物的定点激活,解决了毒性药物可能的脱靶问题。Sochaj-Gregorczyk等[42]合成了包含单个半胱氨酸的3个ZHER2:2891变体,与细胞毒性成分中存在的马来酰亚胺基团进行缀合,将细胞毒性药物Auristatin E与识别HER2的Affibody(ZHER2:2891)偶联,对HER2+肿瘤细胞敏感性更高。
热敏脂质体是用于向肿瘤递送和释放药物的有吸引力的载体。Puri等[43]为了提高乳腺癌治疗的靶向功效,将HER2特异性Affibody分子(ZHER2:342-Cys,8.3 kDa)缀合到脂质体表面,改善抗癌剂的递送。抗体偶联光敏分子可实现理想的肿瘤特异性光动力疗法(PDT),显示出强大的临床应用潜力。Li等[44]设计了一种新的靶向光敏剂,基于非常小的靶向蛋白(一种亲和体分子)与光敏化合物结合,光敏焦脱镁叶绿酸-a(Pyro)用PEG接头(分子量为727 Da)进行修饰,然后与抗HER2Affibody(ZHER2:2891)蛋白进行位点特异性偶联,提供均质的蛋白偶联光敏剂。
4 其 他
与单克隆抗体相比,Affibody分子结构非常稳健,可耐高温,在环境温度下结合并经受多重热循环,因此已被开发成高效的生物技术工具进入市场。例如,作为MabSelect SuRe中的耐碱活性成分,用于mAb的亲和纯化(MabSelect SuRe,目录号17-5438-01,GE Healthcare,Chicago,IL,USA)或作为热启动PCR试剂盒的一部分,其中Affibody分子通过在环境温度下与DNA聚合酶结合并在大量热循环中存活来提高DNA聚合酶的保真度(Phusion Hot Start II DNA Polymerase,目录号:F549L,Thermofisher Scientific,Waltham,MA,USA)。
5 结束语
目前Affibody分子因其稳定性和特异性特点,为其在靶向给药系统的应用提供展示空间,将Affibody分子直接与药物相连,通过其特异性的识别能力引导药物浓集于靶部位,提高药物体内靶向性,减少药物对体内正常组织和脏器的毒副作用,为肿瘤等疾病的治疗带来新的希望。总之,Affibody分子的优势特征将极大程度上推动治疗性蛋白质药物领域的发展。

