卡巴林生物活性研究进展*
高 璐,贺卓琳,常 欢,黄宇韬,冯 溪,关 丽
(西安医学院 药学院,陕西 西安 710021)
卡巴林为吡啶并吲哚结构,又称二氮杂芴。根据吡啶氮原子位置的不同,分为α-卡巴林、β-卡巴林和γ-卡巴林(见图1)。其中深入研究最多的是β-卡巴林类衍生物。卡巴林化合物是一类广泛分布于自然界的具有三环结构的生物碱,其衍生物通常具有良好的药理活性,已被广泛提取分离或化学合成用于医药、农药、香料、染料等研究领域。文献报道的大多数卡巴林生物分子具有良好的生物活性,如抗菌、抗癌、抗白血病、抗糖尿病、抗阿尔茨海默病等活性,作者主要对其活性进行综述。
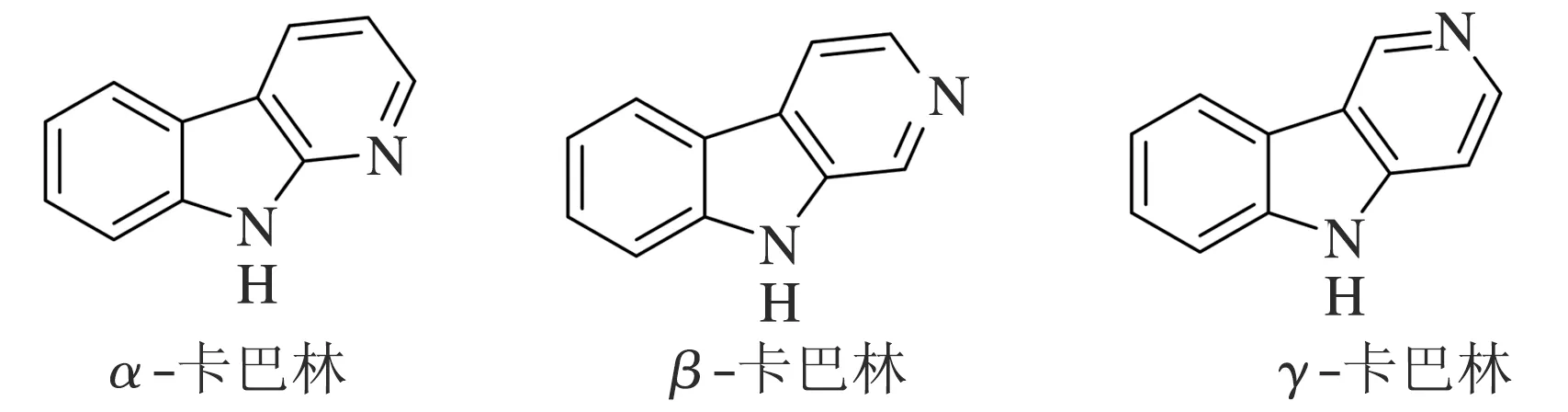
图1 卡巴林骨架的化学结构
1 抗 菌
国内外大量研究表明,卡巴林类化合物有抗菌作用。李兴强等人用市售的2-芳酰肼-1-氯化铵和氯化铵制备了30个新化合物,采用菌丝生长速率法对6株植物病原真菌进行了抑菌活性测定,研究结果表明新的β-卡巴林类化合物(1)具有很强的抗真菌活性[1]。
侯喆等人合成了22个2-芳基-9-甲基-3,4-二氢-β-卡巴林-2-溴化物(2)和4个9-脱甲基衍生物,采用菌丝生长速率法对化合物进行了体外抗真菌活性评价,并建立了结构活性关系。结果表明,化合物2具有良好的抗真菌活性和结构优化设计[2]。
Li等人设计并合成了一系列与氟康唑具有协同作用的抗真菌组蛋白去乙酰化酶(HDAC)抑制剂。发现化合物3对氟康唑耐药的念珠菌病具有良好的协同抗真菌作用,其与氟康唑协同作用,通过阻断细胞形态的相互转化,抑制生物膜的形成,降低病毒的毒力。机制研究表明,耐药逆转是由于唑类靶基因和外排基因表达下调所致。总之,真菌HDAC抑制剂3是一个很有前途的联合治疗唑耐药念珠菌的先导化合物[3]。
Liu等人制备了一系列1,3-二氨基丙烷-2-醇模式的新型四氢卡巴林衍生物,以评估其抗植物病原活性。结果表明,化合物4对水稻白叶枯病和猕猴桃细菌性溃疡病有明显的抑制作用,抑制率分别为51.89%和65.45%。化合物5对柑桔叶片溃疡病有明显的缓解作用。抗菌机制表明,这些四氢卡巴林合物能诱导细菌活性氧的增加,从而使细菌具有明显的凋亡行为[4]。
Ganeshkumar等人成功制备了Callophycin A(6),体外和体内的抗念珠菌活性评价结果显示,化合物6可显著抑制细胞凋亡唑类耐药和敏感白念珠菌[5]。
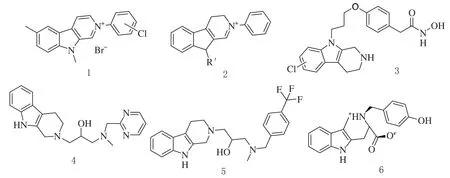
图2 具有抗菌活性的卡巴林衍生物
2 抗 癌
Lu等人报道了10种铜配合物与9-取代的β-羧基配体的制备,作为金属基髓样白血病1(Mcl-1)抑制剂。研究结果表明,该复合物是一种高效低毒的铜基Mcl-1抑制剂(7),可用于Mcl-1相关癌症的治疗[6]。
Liu等人设计并合成了一种新型β-卡巴林衍生物(8),具有抗肿瘤活性和pH响应荧光,这一药物在肿瘤细胞中表现出pH-和GSH-双重响应荧光,而在正常细胞中没有。重要的是,8在小鼠体内表现出有效和选择性的抗增殖活性和结肠肿瘤抑制作用。此外,化合物8还可以通过调节凋亡和自噬蛋白的表达,诱导大肠癌细胞凋亡和自噬[7]。

图3 具有抗癌活性的卡巴林衍生物
Khan等人设计并合成了新的三元配合物(9),通过评估和对癌细胞系人乳腺癌(MCF7)和人肝细胞肝癌(HepG2)以及非致瘤性人胚胎肾(HEK293)细胞的抗癌化疗潜力,证实了化合物9作为抗癌治疗候选药物的巨大潜力[8]。
Lakshmi等人通过将各种β-羧基酸与取代芳基磺酰哌嗪偶联,合成了一系列新的β-羧基连接芳基磺酰哌嗪同系物,研究表明化合物10和11具有潜在的抗癌活性[9]。
Yao等人根据共形限制策略设计了一系列β-卡巴林-1-酮乙内酰脲,通过一锅Knoevenagel缩合分子内环化,并进行了细胞毒性实验。该研究最终确定了12和13这两种药物都能有效抑制乳腺癌和肺癌细胞系[10]。
3 抗糖尿病
1型和2型糖尿病影响全球数亿人,两者最终都是由于功能性胰腺产生胰岛素的β细胞缺乏所致。因此,需要能够在体内或离体诱导成人β细胞再生和扩增的抗糖尿病治疗剂。
Wang等人使用高通量小分子筛选(HTS),发现小分子有害物质的类似物作为一类新的人类β细胞有丝分裂化合物发挥作用。将双特异性酪氨酸调节激酶1a(DYRK1A)定义为有害的可能目标,激活T细胞转录因子家族的核因子可能是人类β细胞增殖和分化的介质。使用3种不同的基于小鼠和人类胰岛的体内模型表明,harmine(14)能够诱导β细胞增殖、增加胰岛质量并改善血糖控制。这些观察结果表明,harmine类似物可能对人类糖尿病治疗具有独特的治疗前景[11]。
彭昆等人以色胺为原料,设计合成了一系列四氢卡巴林类新化合物。体外抗糖尿病活性结果显示,化合物15作为过氧化物酶体增殖物激活受体α(PPARα)激动活性超过了阳性对照药WY14643,PPARγ受体激动活性超过了阳性对照药罗格列酮,显示卡巴林类药物具有抗糖尿病的研究价值[12]。
Eagon等人发现β-卡巴林衍生物是生长抑素亚型受体3(SSTR3)的选择性拮抗剂,可用于治疗2型糖尿病以及与该疾病相关的病症,包括高血糖症,胰岛素抵抗、肥胖、脂质异常和高血压,发明了抗糖尿病的噁二唑β-卡巴林衍生物16[13]。
肝糖代谢异常是糖尿病、肥胖、非酒精性脂肪肝等代谢综合征的主要病理要素,肝脏胰岛素抵抗则是这类疾病发病机制等主要环节,最明显的病理生理特点就是糖异生和糖原分解功能发生紊乱导致糖肝数增多,其中糖异生的作用尤为显著,因此有效抑制肝脏过度糖异生减少内源性葡萄糖生成是治疗这些疾病等重要靶标之一。淮安市厚沐医疗技术咨询中心研究发现,一种β-卡巴林生物碱dichomide F(17)或其葡萄糖苷dichotomide G(18)对肝脏糖异生具有显著的一直作用,因此开发出了具有治疗糖尿病的β-卡巴林生物碱药物[14]。
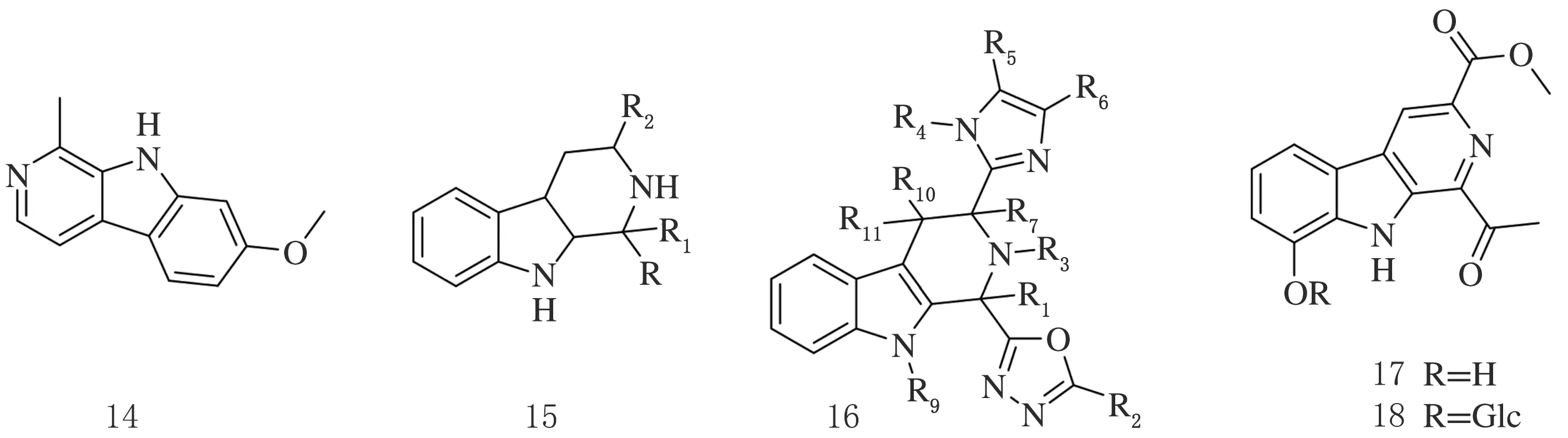
图4 具有抗糖尿病的卡巴林衍生物
4 抗阿尔茨海默病
Liao等人设计并合成了一系列卡巴林衍生物,以期获得低毒、理化性能好的新型多功能分子。特别是18和(19对Aβ聚集有显著的抑制作用(抑制率在25 μmol/L时分别为65%和72%),同时具有中度丁酰胆碱酯酶(BuChE)抑制作用,神经保护效果好,神经毒性低。此外,在阿尔茨海默病(AD)小鼠模型中,19和20可使学习记忆功能恢复到与对照组相当的水平,并且在相对高剂量(600 mg/kg)下在体内没有表现出任何急性毒性。因此,这些新化合物可以作为AD的多功能分子进一步研究[15]。
Lima等人从藤黄中分离到4种吲哚生物碱,其中卡巴林类化合物有Geissochizoline(21)仅对BuChE有抑制作用,其他生物碱对乙酰胆碱酯酶(AChE)和丁酰胆碱酯梅(BChE)有非选择性抑制作用。在细胞活力测试中,只有Geissochizoline(21)没有细胞毒性。此实验研究结果表明,卡巴林类生物碱(20)可用于AD的中重度阶段的治疗。因此,21作为一种可能的多靶点原型出现,在预防神经退行性变和恢复神经传递方面有明确的作用[16]。
Pan等人发现AD的特点是进行性神经退行性变和认知功能受损。Fascaplysin是一种1988年从海绵中分离得到卡巴林生物碱。以往的研究表明,Fascaplysin可能作用于乙酰胆碱酯酶和乙酰胆碱酯酶β-淀粉样蛋白产生抗AD特性。研究合成了Fascaplysin衍生物(22)。该化合物能改善东莨菪碱或Aβ所致的认知功能障碍,是不影响小鼠运动功能的低聚物。作者还发现,化合物22能预防胆碱能功能障碍,降低促炎细胞因子的表达,抑制Aβ-诱导tau过度磷酸化。最重要的是,药效学研究表明,可以穿透血脑屏障,并保留在中枢神经系统。所有这些结果表明,Fascaplysin衍生物(22)是有效的多靶点抗AD药物,可能对AD的临床治疗有用[17]。
Guo等人发现苦参茎的乙酸乙酯提取物对L-谷氨酸刺激的PC12细胞具有潜在的神经保护作用,为了阐明苦皮藤茎乙酸乙酯提取物的活性成分,进行了系统的植物化学研究,共分离鉴定出6种活性成分β-卡巴林生物碱,其中化合物23在体外表现出潜在的神经保护活性[18]。
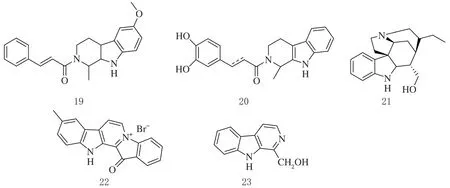
图5 抗阿尔茨海默病的卡巴林衍生物
5 结束语
卡巴林为吡啶并吲哚结构,是很多药物的重要活性基团,含这类结构的药物通常具有抗菌、抗癌、抗糖尿病、抗阿尔茨海默病等生物活性。卡巴林类化合物因具有光谱的生物活性和潜在的药效研究价值,是药物研究的热点。研究该类化合物结构和活性之间的关系、作用机理以及深入动物实验也是进一步研究的重点。总之,卡巴林生物的合成与药理活性发现仍具有较大的研究和发展空间。

