条斑紫菜R-藻红蛋白的分离纯化及稳定性研究
董 硕,姜璐瑶,聂 岩,翟 婧,张 冉,李文军,唐志红
(1.烟台大学 生命科学学院,山东 烟台 264005;2.中国科学院烟台海岸带研究所,山东 烟台 264003)
1 引言
藻红蛋白(phycoerythrin,PE)是存在于多种藻类的重要捕光色素蛋白。在红、蓝藻中,根据光谱性质和起源的不同,将PE分为四类:R-PE,B-PE,C-PE和b-PE[1,2]。PE含有藻胆素,因此呈荧光红色。藻胆素通过特定的半胱氨酸残基,共价连接在脱辅基蛋白上。红藻和蓝藻的PE中通常存在两种色基,包括藻尿胆素(Absmax=495 nm, phycouroblilin, PUB)和藻红胆素(Absmax=540~550 nm, phycoerythrobilin, PEB)。PE是易溶于水的色素蛋白,可用作食品、化妆品领域[3];PE还具有高荧光强度能用于医药领域,并制成荧光试剂用于免疫疾病的诊断[4];同时PE有抗氧化和抗炎活性[5~7]。在不同领域使用PE时对其纯度(Amax/A280)的要求不同,Amax/A280大于0.7为食品级,大于3.0为医药级,大于4.0为试剂级。一般而言,藻红蛋白的光谱学纯度越高,售价越高[8~10]。
国内外已有较多关于PE分离纯化的相关报道,例如:马海乐等[11]以条斑紫菜为原料,采用硫酸铵盐析、超滤、羟基磷灰石层析和DEAE-52阴离子交换层析获得纯化的R-PE,最高纯度(A561/A280)分别为2.76和1.74;付晓苹等[12]采用硫酸铵分级沉淀、离子交换和凝胶过滤柱层析从红毛藻中纯化得到纯度为5.0的PE;Niu等[13]采用硫酸铵盐析、扩展床吸附和离子交换层析3种分离纯化方法相结合,从条斑紫菜纯化得到R-PE纯度为3.2;刁海平等[14]以海生红藻多管藻为材料,采用超滤结合离子交换等3种层析方法分离纯化得到试剂级的PE;赵丽等[15]采用2次双水相层析分离纯化方法,以条斑紫菜为原料纯化得到R-PE的纯度为1.55;郭子叶等[16]以条斑紫菜为原料,采用多次硫酸铵盐析和两次羟基磷灰石层次得到R-PE的纯度为高于4.5。这些制备方法一般采用多步层析技术以获得高纯度的PE,其工艺复杂,得率偏低,生产成本较高,从而使高纯度的PE价格居高不下,极大地限制了其应用。
我国是紫菜养殖生产大国,条斑紫菜细胞中含有丰富的藻红蛋白,但是目前对紫菜的利用仅限于初级产品的加工,深加工技术落后。本研究以条斑紫菜作为原料,目的是得到快速、高效分离纯化藻红蛋白的方法,采用一步疏水层析法分离纯化得到试剂级的R-PE,并对其稳定性进行考察,为条斑紫菜R-PE的大规模生产提供参考。
2 材料与方法
2.1 材料与设备
条斑紫菜购于江苏南通;Phenyl-sepharose FF 购于美国GE公司,SDS-PAGE电泳试剂盒及蛋白质分子量标准购于上海碧云天生物技术有限公司;其它试剂均为分析纯。电热恒温水浴锅(DK-98-1,常州市伟嘉仪器制造有限公司);分析天平(TE313S-DS,德国赛多利斯集团);超微量分光光度计(NanoOne,赛默飞世尔公司);台式高速冷冻离心机(CT15RT,上海天美生化仪器设备工程有限公司);高压双稳电泳仪(DYY-4C,北京六一生物科技有限公司)。
2.2 实验方法
2.2.1 条斑紫菜R-PE的分离纯化
2.2.1.1 细胞的破碎
将新鲜藻体称重,按照1∶10的比例悬浮于磷酸盐缓冲液(20 mmol/L,pH7.2)中,使用组织捣碎机将藻体破碎后反复冻融4次。细胞破碎完全后进行离心(10000 r/min,10 min)处理,去除沉淀,所得上清液即为粗提液。
2.2.1.2 硫酸铵分级沉淀
取一定体积细胞破碎后的粗提液,进行硫酸铵分级沉淀,使得蛋白进一步分离。加入硫酸铵至饱和度为20%,使得蛋白质沉淀。缓慢加入硫酸铵固体粉末,边加边搅拌,防止硫酸铵过多造成蛋白质局部变性,充分搅拌均匀后将蛋白样品在4 ℃下静置10 h,样品进行离心处理(1000 r/min,10 min),上清液进行二步盐析,加入硫酸铵至饱和度为40%,搅拌均匀后在4 ℃静置10 h,离心(10000 r/min,10 min)处理,弃上清,沉淀用少量磷酸盐缓冲液溶解。样品进行全波长扫描,计算R-PE的纯度和回收率。
2.2.1.3 疏水柱层析
疏水层析是利用蛋白质表面某一部分具有疏水性,与带有疏水性的载体在高盐浓度下结合,在洗脱时,采用逐渐降低盐离子浓度,利用其疏水性不同逐个的先后被洗脱下来而纯化。硫酸铵分级沉淀所得蛋白纯度不能达到试剂级,因此需要采用层析法进一步分离纯化,使得样品纯度达到4.0以上。本实验采用疏水层析介质Phenyl-sepharose FF(Vt=2.5 cm×10 cm)对R-PE粗提液进一步分离纯化,进行梯度洗脱,控制流速,使得流速为2 mL/min,使用逐渐降低盐离子浓度的磷酸盐缓冲液(20 mmoL/L,pH7.2)进行洗脱,根据洗脱峰图谱变化收集R-PE组分,进行全波长扫描计算蛋白纯度和回收率。
2.2.2 R-PE含量和回收率(T)的计算
2.2.2.1 含量计算
[R-PE]=0.123×A565-0.07×A616+0.015×A650(mg/mL)
(1)
2.2.2.2 回收率计算
T=(nV[R-PE]/G)×100%
(2)
式(1)、(2)中:[R-PE]为R-PE的含量;A565为R-PE在565 nm处的特征吸收值;A616为R-PE在616 nm处的特征吸收值;A650为R-PE在650 nm处的特征吸收值;n为提取液的稀释倍数;V为提取液的总体积;G为粗提液中R-PE含量。
2.2.3 条斑紫菜R-PE的性质研究
2.2.3.1 光谱特性
对纯化后的R-PE溶液分别进行全波长扫描、荧光光谱扫描及圆二色谱测定,根据图谱分析R-PE的最大特征吸收峰、最大发射峰和二级结构主要组成部分。
2.2.3.2 分子量测定
采用SDS-PAGE法,配制浓缩胶的浓度为4%,分离胶的浓度为12%,对粗提液和层析纯化后的R-PE样品进行亚基分子量的测定,对所得条带分析蛋白纯化结果。
2.2.4 条斑紫菜R-PE的稳定性研究
2.2.4.1 温度对条斑紫菜R-PE稳定性的影响
取纯化后相同浓度的R-PE溶液各1 mL,分别在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃下恒温水浴处理30 min,进行稳定性研究。因PE具有很强的荧光性,因此在实验过程中样品要进行避光保存。对处理后的样品进行全波长扫描,分析不同温度条件下对R-PE稳定性的影响。
2.2.4.2 pH值对条斑紫菜R-PE稳定性的影响
取纯化后相同浓度的R-PE溶液各1 mL,分别将pH值调至3、4、5、6、7、8、9,在4 ℃下避光放置24 h,进行稳定性研究。对处理后的样品进行全波长扫描,分析不同pH值条件下对R-PE稳定性的影响。
3 结果与分析
3.1 条斑紫菜R-PE的分离纯化
3.1.1 硫酸铵分级沉淀
在蛋白质溶液中,高浓度的盐离子会和蛋白质竞争水分子,引起蛋白质表面的水化膜的破会,造成蛋白质溶解度的降低,使其从溶液中沉淀析出。由于硫酸铵温度系数小,溶解度大,且不易引起蛋白变性,因此应用最为广泛。硫酸铵分级沉淀能够从大量样品粗提液中浓缩和纯化部分目标蛋白质,且不会引起蛋白质的变性,是PE初步纯化常用的方法。在本实验中分别采用20%和40%饱和度的硫酸铵,对R-PE含量为0.39 mg/mL、纯度(A565/A280)为0.37的藻细胞破碎液进行分级沉淀,R-PE的纯度(A565/A280)达到0.83,回收率为75.36%。
3.1.2 疏水层析纯化
将R-PE粗提液经硫酸铵盐析后离心,用少量磷酸盐缓冲液溶解沉淀。采用Phenyl-sepharose FF疏水层析介质进行纯化,经洗杂、洗脱后,得到纯化的R-PE,洗脱曲线如图1所示。大多数杂蛋白在较高浓度的硫酸铵条件下流出,而R-PE在含低盐的磷酸缓冲液洗脱时流出,说明条斑紫菜R-PE的表面疏水性较强。经过一步疏水层析后,条斑紫菜R-PE纯度(A565/A280)为5.47,达到试剂纯,总回收率为56.92%。
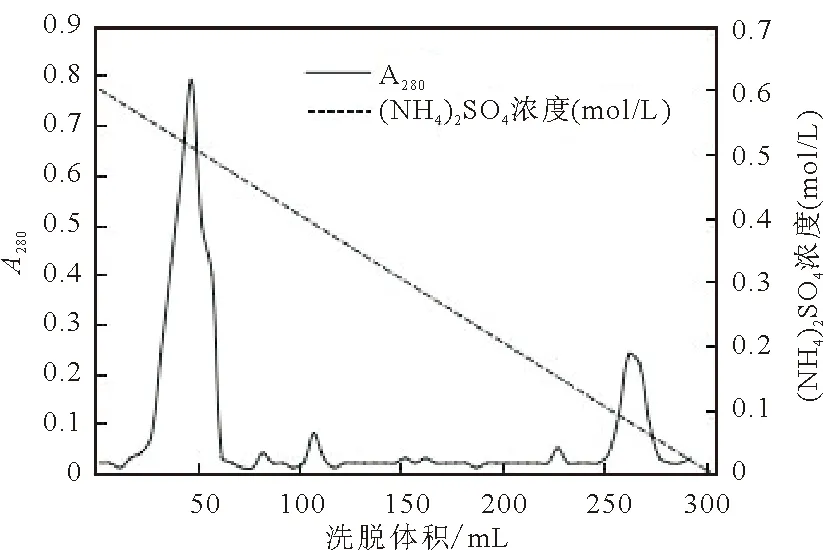
图1 条斑紫菜R-PE洗脱图谱
3.2 条斑紫菜R-PE的鉴定
3.2.1 光谱特性
对纯化的R-PE样品进行全波长扫描,如图2所示。结果显示,R-PE在498 nm和565 nm处有2个完全吸收峰,544 nm处有一肩峰,最大吸收峰位于565 nm,这与方勇等[17]报道的R-PE可见光光谱特性基本一致。565 nm处特征吸收峰是由藻红胆素引起的,498 nm处特征吸收峰是由藻尿胆素引起的,说明条斑紫菜R-PE中含有藻红胆素和藻尿胆素2种藻胆素。

图2 条斑紫菜R-PE全波长扫描
对纯化的R-PE样品进行荧光光谱扫描,如图3所示。从图3a可以看出,R-PE的激发光谱在496 nm、540 nm和560 nm处有峰出现,最大荧光激发峰位于560 nm处;由图3b可以看出,R-PE的最大荧光发射峰位于576 nm处左右,这与臧帆等[18]报道的研究结果基本一致,说明本研究所采用的纯化方法不会影响R-PE结构的稳定性。

图3 条斑紫菜R-PE荧光光谱
对纯化的R-PE样品进行圆二色谱测定,如图4所示。250 nm以下为远紫外光谱区,主要反映的是蛋白质的肽键结构[19],例如α-螺旋和β-折叠。通过色谱带能够反映出蛋白质二级结构信息,R-PE紫外光区的圆二色谱在218 nm和221 nm处有两个负峰,在219 nm处可见一个明显缺口,这是α-螺旋占主导位置的圆二色谱,说明纯化R-PE的二级结构元件主要为α-螺旋。
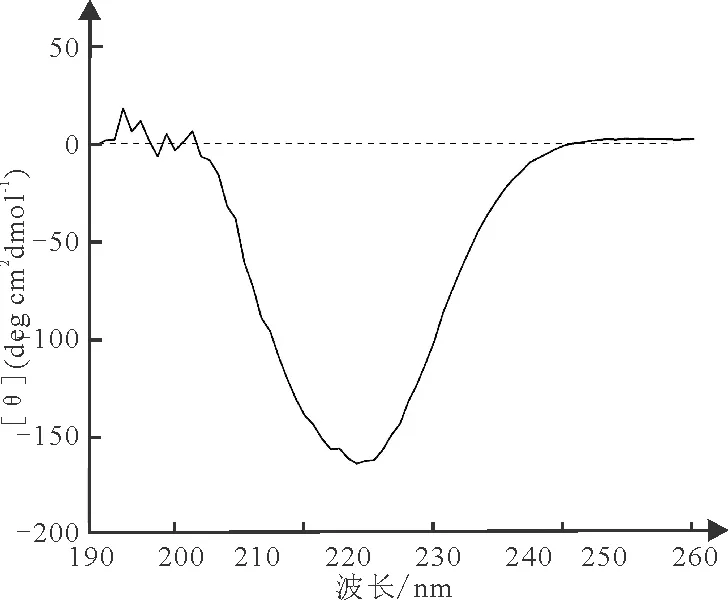
图4 条斑紫菜R-PE的圆二色谱
3.2.2 分子量测定
将粗提液和纯化后的R-PE样品进行SDS-PAGE,如图5所示。结果表明,分子量在14~23 kDa之间的蛋白条带是R-PE的α和β亚基,分子量在30 kDa附近的是γ亚基,2泳道的条带颜色深且宽度大,说明纯化后的R-PE含量和纯度都很高,因为两个亚基的相对分子质量相当接近,因此2泳道出现折叠现象。文献报道条斑紫菜R-藻红蛋白的α、β、γ亚基分子量分别为17、19和33 kDa[20],与本研究的结果相吻合。已知R-PE的存在形式一般为(αβ)6γ[21],故推测条斑紫菜中R-PE的相对分子质量约为279 kDa。
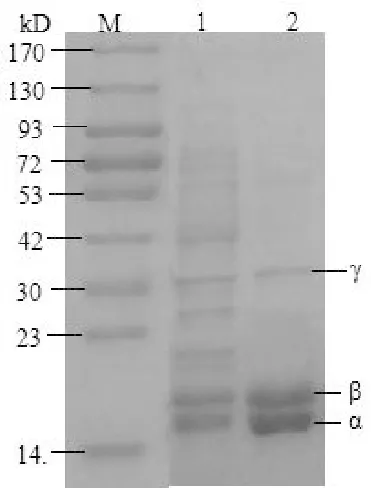
图5 条斑紫菜R-PE的SDS-PAGE图谱
3.3 条斑紫菜R-PE的稳定性研究
3.3.1 温度对条斑紫菜R-PE稳定性的影响
对纯化所得R-PE样品经过不同温度水浴处理30 min后,由图6可以看出,与对照组相比,在30~60 ℃范围内,R-PE的特征吸收峰没有发生太大变化,说明此时对R-PE稳定性没有太大影响,基本保持不变。在70 ℃处理后最大特征吸收峰出现明显下降,经过80 ℃处理后,R-PE最大特征吸收峰消失,R-PE发生了局部变性。通过上述实验结果,说明在低于60 ℃时R-PE较为稳定,当温度超过60 ℃时,藻红蛋白的光吸收值(A565)会显著降低,造成蛋白性质改变。推测超过60 ℃时R-PE的空间结构被破坏,从而对其光吸收值(A565)产生影响,因此在保存或处理条斑紫菜R-PE时应选择低温的环境。

图6 不同温度处理后R-PE的全波长扫描图谱
3.3.2 pH对条斑紫菜R-PE稳定性的影响
对纯化所得R-PE样品经过不同pH条件处理后,如图7所示,与对照组相比,当R-PE溶液处于pH5~7时,其在565 nm处的光吸收值没有发生明显变化。表明在接近中性的条件时,R-PE的光谱学性质较为稳定。但是当R-PE溶液的pH值高于7或低于5时,与对照组相比,其在565 nm处的吸光值显著降低,且分别在pH值为3、4、10时没有出现最大光吸收峰,推测过酸、过碱环境能造成R-PE结构的破坏,因此在保存条斑紫菜R-PE时应选择接近中性的条件。
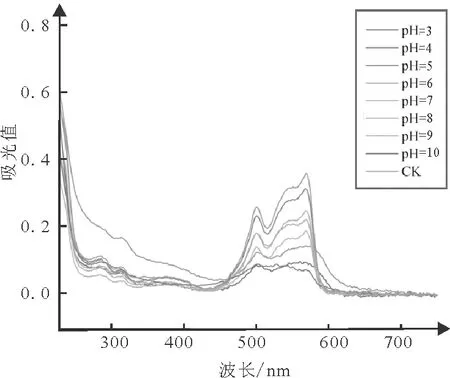
图7 不同pH值处理后R-PE的全波长扫描图谱
4 结论
本研究采用硫酸铵分级沉淀结合疏水层析法纯化,获得的R-PE纯度(A565/A280)达到试剂级。通过对R-PE进行表征结果的分析,确定了其最大特征吸收峰、最大荧光发射峰、R-PE的主要二级结构和亚基分子组成。稳定性研究显示R-PE在低于60 ℃、pH值在5~7条件下能保持相对稳定。本实验采用一步层析法纯化得到较高纯度的R-PE,操作简单,减少了纯化时间和一定的工艺成本,绿色高效,为条斑紫菜资源的后续利用提供了相应的依据。

