高盐废水MBR过程中胞外聚合物提取研究
钟辉,袁野,钟常明,2
(1.江西理工大学 资源与环境工程学院,江西 赣州 341000;2.江西省矿冶环境污染控制重点实验室,江西 赣州 341000)
在高盐废水的处理过程中,膜分离法是目前最高效、适用范围最广的工艺技术[1],但是,相应的膜污染问题也随之而来[2]。目前,国内外普遍认为可溶性微生物产物SMP和胞外聚合物EPS为膜污染的主要原因[3-4]。EPS的提取方法主要分为物理法和化学法,不同方法在不同的污泥中,提取EPS的成分种类和含量各不相同。近年来,对于含盐废水中污泥EPS的提取方式的比较的相关研究报道较少,尤其是高盐下污泥EPS的提取方法尚未定论。因此,本研究采用常见的5种方法,在不同盐度下提取不同的EPS组分并进行分析以期能够探究高盐废水的污泥中EPS适宜的提取方法和组成特性。
1 实验部分
1.1 材料与仪器
NaCl、NH4Cl、KH2PO4、NaOH、H2SO4、葡萄糖、37%甲醛、苯酚、无水乙醇、考马斯亮蓝G-250、牛血清蛋白(BSA)、丙三醇、3,5-二硝基水杨酸(DNS)均为分析纯;实验所用污泥,由污水处理厂的剩余污泥驯化后得到盐度不同的活性污泥,在MBR中稳定培养后,各盐度下活性污泥对COD的去除均达到95%以上,污泥具体参数见表1。
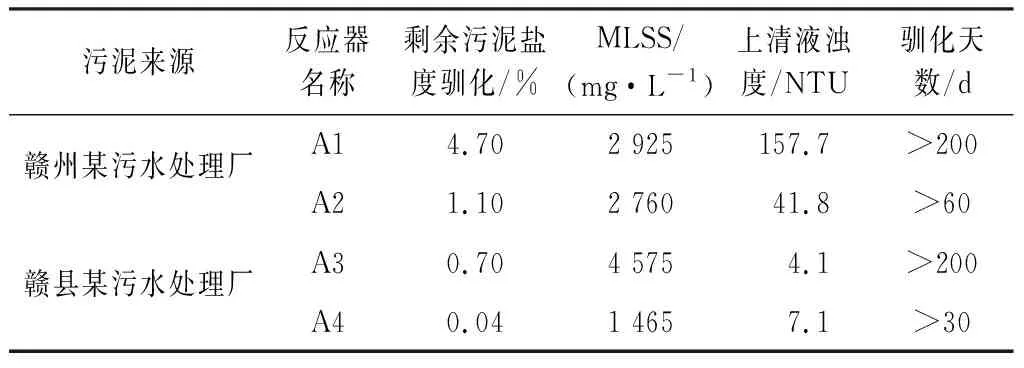
表1 污泥来源和参数Table 1 Sludge sources and parameters
LP-40低噪声空气泵;PX224ZH/E电子天平;HH-2数显恒温水浴锅;DHG-9247A电热恒温干燥箱;X5紫外可见分光光度计;KH20A高速台式离心机;F-280三维荧光光谱仪。
1.2 污泥EPS的提取
在各反应器的曝气区取10 mL混合液于10 mL离心管中,同一批次下,每个反应器取12个样,静置(4 ℃,30 min),离心 10 min[4 ℃,2 000 g(6 700 r/min)],上清液通过0.45 μm滤膜得到SMP,往泥饼中加入由纯水配制的0.9% NaCl溶液至10 mL,静置(4 ℃,1 h),离心 10 min[4 ℃,5 000 g(10 600 r/min)],上清液通过0.45 μm滤膜得到LB-EPS,再往泥饼中加入由纯水配制的0.9%NaCl溶液至5 mL,振荡,静置(4 ℃,1 h),以同一反应器的两个样为一组,进行离心法、超声法、加热法、甲醛法、甲醛+NaOH法,具体操作如下。
①离心法:补充0.9%NaCl溶液至10 mL,4 ℃,6 700 r/min离心20 min(作为对照组)。
②超声法:补充0.9%NaCl溶液至 10 mL,130 W 超声10 min。
③加热法:补充0.9%NaCl溶液至10 mL,70 ℃水浴加热30 min。
④甲醛法:加入0.2 mL 37%甲醛,补充0.9% NaCl溶液至10 mL。
⑤甲醛+NaOH法:加入0.2 mL 37%甲醛,再加入2 mL NaOH,补充0.9%NaCl溶液至10 mL。
采用上述不同方法处理后,各样品在8 000 g(18 000 r/min),4 ℃,离心10 min,上清液通过 0.45 μm 滤膜得到TB-EPS。最后得到各反应器的SMP,LB-EPS和TB-EPS,冷藏24 h后进行检测分析。
1.3 EPS成分分析
本研究中,蛋白质PN和DNA含量采用紫外吸收法测定[5-6],多糖PS含量采用苯酚-浓硫酸测定法[7],提取总量是指蛋白质、多糖和DNA质量之和,结果表示为mg/g SS。
1.4 EPS三维荧光及方法分析
利用三维荧光光谱仪对上述SMP、LB-EPS和TB-EPS进行测样,利用MATLAB中drEEM工具箱实现平行因子分析(PARAFAC),设置参数如下:激发波长Ex(240~550 nm),发射波长Em(240~550 nm),激发/发射间隔5 nm,激发/发射狭缝 5 nm,增益倍数为1。通过origin2021和visio作图。
2 结果与讨论
2.1 混合液上清液、SMP、LB-EPS的成分分析
对4组盐度下活性污泥的SMP和LB-EPS进行提取,混合液上清液以及污泥的SMP和LB-EPS中各组分含量见图1。
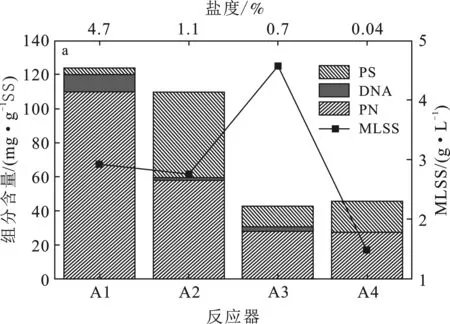
图1 各组混合液上清液、SMP和LB-EPS的组分变化与MLSS的对应图Fig.1 Correspondence diagram between component changesof supernatant,SMP and LB-EPS of each group and MLSSa.混合液上清液;b.SMP;c.LB-EPS
由图1可知,四组盐度下提取的SMP和LB-EPS中都含有蛋白质、DNA和多糖,含量从大到小依次为蛋白质>多糖>DNA,说明在高盐环境中蛋白质依旧是活性污泥胞外聚合物的主要成分,此结果与Tang的研究相一致[8]。本实验中,SMP经过0.45 μm滤膜后,A1的组分总量最低,其次是A3、A4、A2,含量分别为5.92,29.57,56.03,132.34 mg/g SS。但在实验过程中发现,对四个反应器中过滤后的上清液进行组分测定A1、A2、A3、A4,含量分别为123.59,109.75,43.0,45.88 mg/g SS,其中,蛋白质组分含量分别为110.02,57.97,27.89,27.48 mg/g SS,蛋白质含量与盐度呈正相关,多糖含量在A2中达到最大值,在A1中为最小值。经过滤膜处理后,A1中SMP的蛋白质含量骤降说明蛋白质以某种大分子形式存在,大量蛋白质被滤膜截留使得A1的SMP和LB-EPS的蛋白质含量低。Krisna等[9]认为这是高盐度下蛋白质的盐析作用所导致。DNA的含量决定细胞的破碎程度[10-11],混合液上清液的A1中DNA含量相对较高,说明在高盐下,部分微生物容易破碎。LB-EPS经过0.45 μm滤膜后,A3的组分总量最低,其次是A1、A2、A4,含量分别为3.22,7.48,7.69,8.76 mg/g SS。A1中的DNA含量比其它的盐度的DNA含量相对较多,说明在SMP去除后,胞外聚合物的内部结构更加脆弱,胞内DNA在离心作用下释放出来。各盐度下组分含量差异较小,说明在去除SMP后,各盐度下污泥处于同一比较水平[12],此时,EPS的差异性通过成分含量和成分种类得以体现。
2.2 不同污泥不同提取方法TB-EPS的差异
由图2可知,采用5种提取方法对不同盐度污泥的提取效果总体如下:甲醛+NaOH>甲醛>加热>超声>离心。5种方法的TB-EPS的平均提取量分别为208.03,67.85,48.55,3.29,3.22 mg/g SS。超声法的总提取效率略高于对照组,表明超声法提取不同盐度的TB-EPS效果与离心法相比无明显差异,这与王淑莹等[13]研究结果相一致。甲醛法对多糖的平均提取量为 63.9 mg/g SS,占总平均提取量的94.2%,表明甲醛能够有效提取EPS中的多糖物质。加热法对污泥的EPS提取效率适中,但由于DNA占比相对较大,细胞破裂严重,不宜作为分析指标[11]。甲醛+NaOH法是通过甲醛保护多糖的降解同时利用NaOH使污泥pH升高,增加带电EPS分子间的斥力,从而提高EPS提取效率[13]。在四组盐度下,甲醛+NaOH法的提取效率都远高于其他提取方法。说明甲醛+NaOH法更适合提取含盐污泥的ESP。此外,由图2中可以看出,在A4盐度的提取量最高,达到414.61 mg/g SS,在盐度A3组中,TB-EPS的提取含量为最低水平,这与王子超等[14]发现TB-EPS的蛋白质和多糖会随盐度增加而增加的研究结果并不一致。分析原因可能是本实验中的污泥取自不同的污水处理厂以及后期驯化的条件不同所导致。

图2 不同盐度下不同提取方法的组分比较Fig.2 Component comparison of different extractionmethods under different salinity1.离心(对照);2.超声;3.加热;4.甲醛;5.甲醛+2 mL NaOH
2.3 SMP、LB-EPS、TB-EPS的三维荧光分析
在经过1.2节处理后,对四类污泥提取的SMP、LB-EPS和TB-EPS进行三维荧光分析,分析的数据通过Matlab去除瑞利散射和拉曼散射[15]和空白后进行平行因子分析并得到图3和图4。根据Chen[16]对三维荧光光谱物质的划分。

图3 不同盐度下SMP和LB-EPS的EEM
由图3可知,4种污泥提取的SMP中都存在类胡敏酸(Ex/Em,290/360,460 nm)[16]和类富里酸(Ex/Em=260~280 nm/450~464 nm)[17],在A4中类胡敏酸荧光强度最低,这与安莹等[4]研究相符,类胡敏酸和类富里酸受盐度冲击影响。但在本实验中它们并没有呈正相关趋势,分析原因可能是高盐度下,蛋白质的盐析作用产生的蛋白质沉淀在经过滤膜时被截留[18]。A3的SMP组分中几乎没有可溶性微生物副产物(Ex/Em=250~280 nm/300~350 nm)[17],而LB-EPS中却存在,荧光强度也远高于其它组,该荧光区域范围(Ex/Em=320~370 nm/410~460 nm)属于类腐殖酸[19],结合图1b,这也证实了蛋白质、多糖和腐殖酸是SMP的主要成分[20]。在LB-EPS中,4种盐度的污泥都含有类胡敏酸、类富里酸以及类色氨酸(Ex/Em=275~296 nm/340~380 nm)[21],且类色氨酸的荧光强度与盐度呈正相关,类富里酸和类胡敏酸的荧光强度与盐度呈负相关,这与安莹[4]的研究相一致。
由图4可知,在除甲醛法外的其他4种TB-EPS提取方法中,A1提取的TB-EPS几乎具有最强的荧光峰。说明高盐下TB-EPS的提取效果更好。离心法和加热法中A1的荧光峰最强,两种提取方法都有类蛋白质(Ex/Em=275~285/346~368 nm)和类胡敏酸,类蛋白质荧光峰中心位置存在偏差,加热法在Ex/Em=285~295/350 nm,离心法在Ex/Em=275/310 nm,原因分析可能是蛋白质受热后发生变性,物质的特征峰发生偏移。用甲醛+NaOH法提取的物质在Ex/Em=310~315/380~400 nm处存在独有的荧光峰,属于类腐殖酸。李欢等[22]也提出了碱破解可促使污泥中腐殖酸溶出的结论。碱溶过程所产生的物质主要为大分子物质,造成大分子物质可能在过0.45 nm滤膜时被截留,同时盐度也影响着颗粒粒径,这就使得甲醛+NaOH法提取的类腐殖酸荧光强度没有明显随盐度变化的现象。但总体来说高盐下污泥TB-EPS中存在的类腐殖酸含量更高。甲醛法与离心法对比下可发现,甲醛虽然作为一种萃取剂[23],但对溶解性有机物DOM的提取似乎存在某种保护机制,尤其是在高盐环境下,其原因尚未可知。

图4 不同盐度不同提取方法TB-EPS的EEMFig.4 The EEMs of TB-EPS with different salinityand different extraction methods
2.4 平行因子分析
对2.3节得到的三维荧光数据进行平行因子分析,在拆半分析验证中[24],发现只有加热法提取的TB-EPS中存在2组组分,见图5,组分1的荧光峰为350/450 nm,组分2的荧光峰为280/355 nm。根据Chen[16]的分类对应组分分别是类胡敏酸和类蛋白质。平行因子分析说明加热法存在共同组分,为EPS分析提供两种新的提取分析方式,通过组分荧光强度的比较,可以对比不同盐度污泥TB-EPS的提取效果。还可结合其他影响因素进行后续分析。

图5 加热法和甲醛法对应共同组分的EEM和波长图Fig.5 The EEMs and wavelength diagrams of commoncomponents corresponding to heating and formaldehyde
3 结论
(1)本研究中,SMP提取总量:A2>A4>A3>A1,LB-EPS提取总量:A4>A2>A1>A3,但在A1、A2的上清液中测出蛋白质含量分别为 110.02 mg/g SS 和57.97 mg/g SS。说明要探究高盐下污泥的特性,还需考虑混合液中的组分。
(2)5种方法提取TB-EPS的排列如下:甲醛+NaOH法>甲醛法>加热法>超声法>离心法。同时甲醛能够有效提取EPS 中的多糖。高盐环境下污泥EPS的多糖含量要低于低盐环境。
(3)在三维荧光分析中,四组盐度污泥的LB-EPS都含有类胡敏酸、类富里酸以及类色氨酸,且类色氨酸的荧光强度与盐度呈正相关,类富里酸和类胡敏酸的荧光强度与盐度呈负相关。甲醛+NaOH法能够提取类腐殖酸物质。
(4)在平行因子分析中,加热法和甲醛法各存在2组组分,这为污泥的TB-EPS比较提供两种途径。

