活性炭逆转利伐沙班对凝血试验干扰的效果评价
陆松松,李梦,奴尔扎特·胡尔曼,丁庆明,徐秦竹,宋英,苏明△
利伐沙班是一种口服抗凝药(direct oral anticoagulants,DOACs),在血栓性疾病的预防和治疗领域应用广泛[1]。有研究显示,利伐沙班可使凝血酶原时间(PT)和活化部分凝血活酶时间(APTT)明显延长[2]。即使在患者血浆中的DOACs浓度较低时仍有可能干扰凝血试验,导致临床上对患者凝血功能的误判。为避免血浆样本中残留的DOACs对凝血试验的影响,一般需要在最后给药后延迟3 d或更长时间进行检测才能获得真实的凝血试验结果。近年研究显示,活性炭能够吸附检测血浆样本中的DOACs,从而逆转DOACs对体外凝血试验检测的影响,且活性炭自身对凝血试验影响较小[3]。但也有研究发现并非所有含有此类药物的血浆样本都可被活性炭完全逆转[4]。目前国内活性炭逆转利伐沙班对凝血试验干扰的相关研究较少。本研究通过观察活性炭对不同质量浓度利伐沙班血浆的吸附效果,分析活性炭在凝血试验中排除利伐沙班影响的有效性,并就该方法在临床应用中的实践价值进行探讨。
1 材料与方法
1.1 样本采集及分组选取2021年5—9月于北京大学人民医院体检中心体检的人群。纳入标准:近3个月无抗凝及止血用药史,无糖尿病、高血压、脑血管疾病、心脏病、恶性血液病、实体肿瘤病史;血常规、肝肾功能检测无异常。取临床常规凝血项目检测后的枸橼酸钠抗凝血样本,每次方便抽取20例,重复24次,共纳入480例,男213例,女267例,年龄22~64岁,平均(39.8±7.8)岁。所有抗凝血样本室温2 000 r/min离心15 min,获得乏血小板血浆(血小板计数<10×109/L)。将20例血浆样本(每例0.25 mL)混合配制成正常混合血浆(NPP)5 mL,取1 mL NPP为N1组;另取1 mL NPP经活性炭处理后为N2组:10 mg医用活性炭(400目,北京迈瑞达科技有限公司)和1 mL血浆在EP管中混合5 min,2 000 r/min离心2 min后将上清液转移到另1个EP管中再次2 000 r/min离心2 min,取上清液即活性炭处理的血浆;N3组为NPP加入利伐沙班标准品(CAS NO 366789-02-8,国家标准物质资源平台)使利伐沙班理论终质量浓度分别为100、200、300、400 μg/L,记为N3A组、N3B组、N3C组和N3D组,每份终体积为1 mL,每个质量浓度重复6次。N4组为N3组经活性炭处理(方法同前)。所有样本在采样后4 h内完成检测。
收集同期急诊科首次使用利伐沙班治疗的患者22例,男15例,女7例,年龄51~82岁,平均(63.4±5.2)岁。首次服用利伐沙班前6 h采集血样为S1组,服用利伐沙班后6 h采集血样为S2组。所有样本室温2 000 r/min离心15 min,获得乏血小板血浆。S2组经活性炭处理后(由于样本量有限,处理方法为5 mg活性炭处理500 μL血浆,方法同N2组)为S3组。每份患者血浆样本量均为500 μL,所有样本在采集后4 h内完成检测。本研究方案符合赫尔辛基宣言,并经北京大学人民医院伦理委员会批准(批准文号:2020PHB409-01)。
1.2 液相色谱-联用串联质谱(HPLC-MS/MS)测定利伐沙班质量浓度取N3组及S2组血浆50 μL,加入甲醇(HPLC级)180 μL混合去蛋白质,添加利伐沙班内标。将血浆混匀5 min,-80℃冷冻60 min保存,检测前室温融化后,3 000 r/min离心5 min,将上清液转移到350 μL样本管中。使用液相色谱系统UltiMate 3000 RS(Dionex,Sunnyvvale,加利福尼亚)与三 重 四 极 杆6500串 联 质 谱 仪(AB Sciex,Foster City,California)进行HPLC-MS/MS测定利伐沙班质量浓度。
1.3 凝血试验及凝血因子活性检测 使用凝血分析系统(型号ACL TOP 700,美国IL公司)及其配套试剂检测N1、N2、N3、N4组PT、APTT、凝血酶时间(TT)及纤维蛋白原(FIB)水平,蛋白C(PC)、蛋白S(PS)、抗凝血酶Ⅲ(AT-Ⅲ)以及凝血因子FⅡ、FⅤ、FⅦ、FⅧ、FⅨ、FⅩ、FⅪ、FⅫ活性,N1、N2、N3、N4、S1、S2和S3组抗Xa因子(Anti-Xa)活性。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析,通过Kolmogorov-Smirnov法检验数据的正态性,符合正态分布的数据以均数±标准差(±s)表示,多组间比较用单因素方差分析,组间多重比较采用Tamhane's T2法;非正态分布的数据以中位数和四分位数[M(P25,P75)]表示,多组间比较采用Friedman检验,组间多重比较采用Wilcoxon检验。相关性分析采用Spearman法。P<0.05为差异有统计学意义。
2 结果
2.1 活性炭和利伐沙班对凝血试验及凝血因子活性的影响与N1组比较,N2组PT、APTT、INR、FIB、PC、PS、AT-Ⅲ、Anti-Xa、FⅡ、FⅤ、FⅦ、FⅧ、FⅨ、FⅩ、FⅪ、FⅫ活性差异无统计学意义;N3组PT、APTT延长,INR、PS、AT-Ⅲ和Anti-Xa活性升高,FⅡ、FⅤ、FⅦ、FⅧ、FⅨ、FⅩ、FⅪ、FⅫ活性降低(P<0.05),FIB水平及PC活性差异无统计学意义;N4组APTT延长,PS、FⅤ、FⅧ、FⅪ、FⅫ活性降低(P<0.01),PT、INR、FIB水平,AT-Ⅲ、Anti-Xa、FⅡ、FⅦ、FⅨ、FⅩ活性差异无统计学意义。与N3组比较,N4组PT、APTT缩短,INR水平,PS、AT-Ⅲ和Anti-Xa活性明显降低,FⅡ、FⅤ、FⅦ、FⅧ、FⅨ、FⅩ、FⅪ、FⅫ活性升高(P<0.01),FIB水平和PC活性差异无统计学意义,见表1。
2.2 利伐沙班对患者Anti-Xa和APTT的影响与S1组比较,S2组Anti-Xa活性升高,APTT延长;S3组APTT延长(P<0.01),Anti-Xa活性差异无统计学意义。与S2组比较,S3组Anti-Xa活性降低,APTT缩短(P<0.01),见表2。
2.3 利伐沙班质量浓度对凝血试验及凝血因子活性的影响N3A、N3B、N3C和N3D组PT、APTT、INR、PS水平及Anti-Xa活性逐次升高,FⅤ、FⅦ、FⅧ、FⅨ、FⅪ活性逐次降低(P<0.01);N3C和N3D组FⅡ、FⅩ和FⅫ活性均低于N3A组,AT-Ⅲ活性高于N3A(P<0.01),见表3。
2.4 利伐沙班质量浓度与Anti-Xa活性相关性分析N3组利伐沙班质量浓度与Anti-Xa活性呈正相关(rs=0.989,P<0.01)。S2组利伐沙班质量浓度[55.64(16.78,109.44)μg/L]与Anti-Xa活性呈正相关(rs=0.969,P<0.01)。
3 讨论
利伐沙班作为一种DOACs已广泛应用于临床预防血栓,但由于目前对利伐沙班药物浓度或活性的监测并未普及,因此其在临床中引发的出血事件逐渐显现[5-7]。利伐沙班作为口服的活性药,其血药浓度的达峰值时间是4 h,但体外直接将利伐沙班溶于血浆,可立即起效。研究表明,体外血浆中的利伐沙班药物活性在室温可稳定8 h[8],其药理机制为结合血浆中活化的FⅩ(FⅩa),使凝血酶原酶不能顺利合成[9],最终导致凝血酶不能被激活,从而预防血栓形成。因此,利伐沙班对采用凝固法检测的凝血试验有相同的作用,可干扰试验中凝血酶的生成,导致APTT和PT延长,凝血因子活性假性降低,PS活性假性升高[10-12]。本研究通过在NPP中加入利伐沙班以及对口服利伐沙班患者血浆进行凝血试验,结果与既往研究基本一致。随着利伐沙班的浓度升高,PT、APTT延长,INR、PS活性及Anti-Xa活性假性升高,FⅤ、FⅦ、FⅧ、FⅨ、FⅪ活性假性减低;N3C和N3D组FⅡ、FⅩ和FⅫ活性均低于N3A组,AT-Ⅲ活性高于N3A,N3A组与N3B组AT-Ⅲ活性差异无统计学意义,表明AT-Ⅲ活性检测在利伐沙班浓度发生较大变化时才会受到影响。AT-Ⅲ检测方法为发色底物法,利伐沙班可直接结合AT-Ⅲ检测试剂中的FⅩa,因此可能导致AT-Ⅲ活性假性升高。此外,本研究也证实利伐沙班对PC及FIB的检测没有影响,因PC检测为采用发色底物法直接检测血浆中PC的含量,而FIB的检测是通过记录试剂中凝血酶将血浆中FIB变成纤维蛋白的时间来测定FIB的活性,这2项检测均无FⅩa的参与,不受利伐沙班的影响。
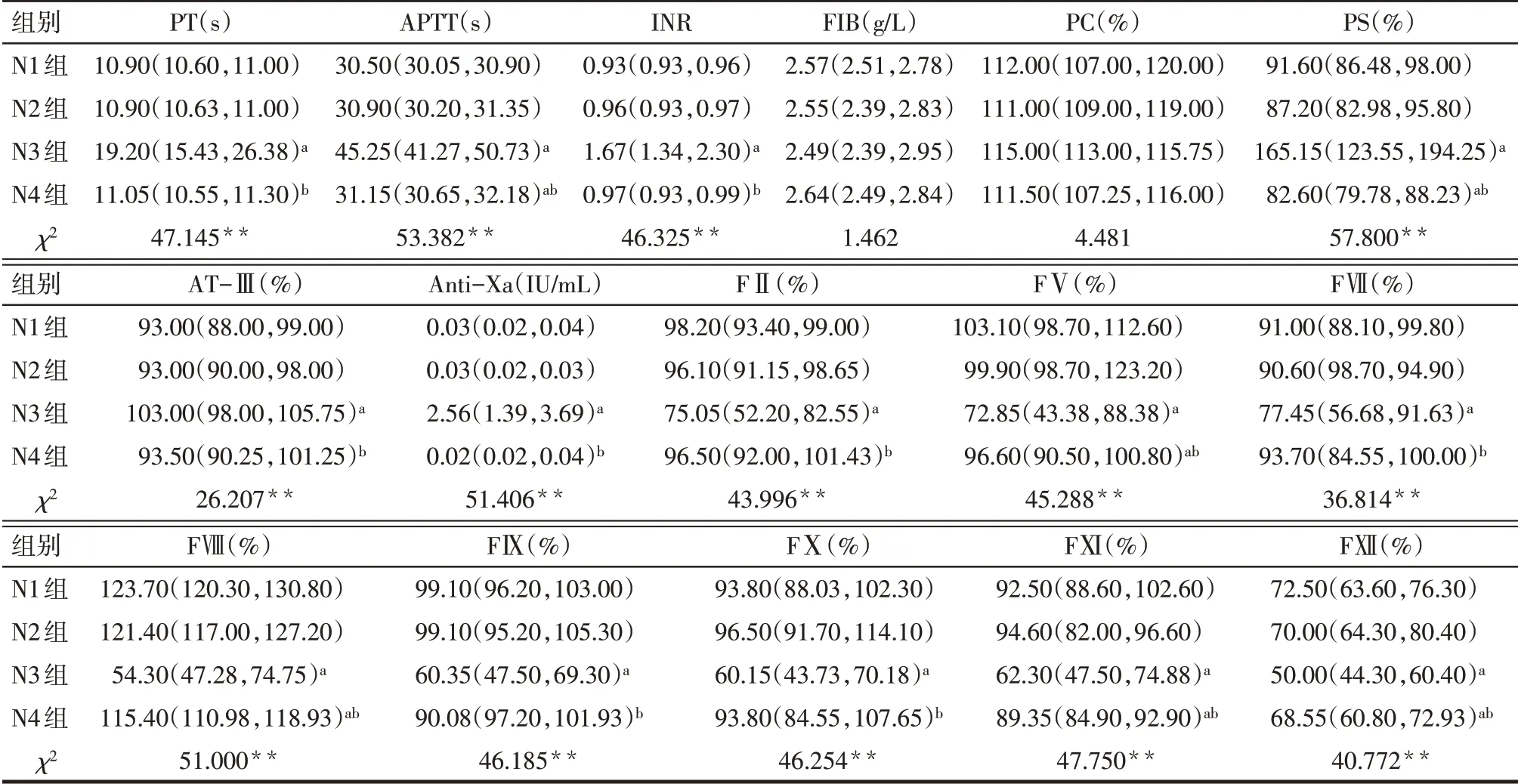
Tab.1 Comparison of coagulation test indexes and activity of coagulation factors between the four groups表1各组凝血试验指标及凝血因子活性比较 [n=24,M(P25,P75)]

Tab.2 Comparison of Anti-Xa level and APTT between the three groups表2 S1、S2和S3组Anti-Xa活性和APTT比较[n=22,M(P25,P75)]
活性炭表面的微孔直径大多为2~50 nm,每克活性炭的表面积为500~1 500 m2,具有较强的吸附功能[13],且其吸附能力主要针对小分子的化学物质,而血浆中的蛋白质由于分子质量较大,不能通过活性炭的孔径[14]。本研究比较NPP中加入活性炭前后的凝血指标变化(N1组与N2组),结果显示活性炭对凝血因子没有吸附能力,其本身对凝血试验没有影响。临床已有活性炭胶囊用于治疗药物过量时吸附体内药物的案例[15-17]。国外的大多数研究为应用基于活性炭的商品化试剂盒(DOAC-REMOVE,DOAC-STOP)在体外去除利伐沙班[3-4],国内目前尚无成品的试剂盒可以应用。本研究中,课题组选用常规的医用活性炭(400目)进行应用研究,N4组与N1组Anti-Xa活性差异无统计学意义,且与N3组比较,N4组所有检测项目的水平均明显逆转,证实活性炭具有去除利伐沙班的能力。通过S3组与S1组比较,服用利伐沙班后的血浆经过活性炭处理,Anti-Xa活性与服药前无差异,可见口服方式进入循环系统的利伐沙班同样可被活性炭吸附。
在Anti-Xa活性检测尚未完全普及的情况下,临床在观察利伐沙班活性时监测PT会比APTT更为敏感[18]。但本研究的主要目的是观察活性炭是否可以有效吸附血浆中的利伐沙班,由于N4组的APTT较N1组延长,而2组间PT差异无统计学意义,因此,在首次服用利伐沙班患者样本量有限的情况下,本研究选择APTT进行检测,发现在服用利伐沙班患者血浆经活性炭处理后,APTT水平较服药前6 h延长,其具体机制需要进一步研究,如活性炭是否会吸附APTT检测试剂中的磷脂而引起APTT变化。

Tab.3 Comparison of coagulation indexes and activity of coagulation factors between the four groups表3 N3A、N3B、N3C和N3D组凝血实验及凝血因子活性比较 (n=6)
在临床工作中,笔者曾多次发现患者应用利伐沙班后PT和(或)APTT明显延长,此时若进行凝血因子活性检测,可表现为多个凝血因子活性降低,易造成误导,甚至影响临床决策。若实验室可以明确凝血指标异常是否由药物引起,以及预测药物代谢后患者凝血指标水平变化,则可以协助临床做出更准确的处置,对临床治疗有重要的指导意义。再者,若延长的PT和(或)APTT可通过活性炭纠正,也能避免继续检查PT和(或)APTT相关的凝血因子活性、狼疮抗凝物和凝血因子抑制物,节省医疗资源。本研究中利伐沙班的最高质量浓度为400 μg/L,实际活性炭的处理能力可能远高于此浓度。若血浆中药物浓度较高,考虑一次活性炭处理未能完全吸附,可以重复处理的步骤,直至完全去除为止。
尽管目前的检测系统中Anti-Xa活性的检测是通过肝素来定标,但本研究应用此检测系统结果可见Anti-Xa活性与利伐沙班质量浓度呈正相关,其相关系数在N3组中为0.989,在S2组为0.969。因此,针对肝素定标的Anti-Xa活性分析同样可以用于检测利伐沙班,与既往研究一致[19-20]。本研究主要探讨活性炭对利伐沙班的吸附作用,而既往研究[3-4]显示,活性炭可能会对其他口服的抗凝药物有类似的吸附效果,如在临床应用中笔者曾尝试采用活性炭去除血浆中的达比加群酯,效果同样显著,但缺乏大样本的重复实验;然而,华法林抗凝机制为抑制维生素K依赖的FⅡ、FⅦ、FⅨ、FX的生成[21]。因此,活性炭即使可以吸附华法林,也不能改变FⅡ、FⅦ、FⅨ、FX生成减少引起的凝血指标异常。
综上所述,本研究证实活性炭能有效去除血浆中的利伐沙班,逆转由利伐沙班引起的异常凝血指标。但本研究中没有考虑活性炭是否对凝血检测试剂中的磷脂有吸附作用,且多数研究中,并没有区分患者服用利伐沙班的品牌,因此对不同品牌口服利伐沙班之间是否有区别需要进一步研究。

