食管癌患者三切口食管切除术后发生颈部吻合口瘘的列线图预测模型构建
李殿波 李金龙 于海防 刘赵庆 武霞
食管癌的治疗手段目前以手术治疗为主,三切口食管切除术(McKeown术)在切除病灶和清扫淋巴结方面具有明显的优势,在临床上得到了广泛的应用[1]。但该术式的创伤大,患者围术期应激反应和并发症较多,其中颈部吻合口瘘(anastomotic fistula,AF)较为常见。AF发生后会增加感染病例,延长住院时间,增加不良预后的发生风险,病死率升高[2]。虽然目前随着手术微创化和围术期管理精细化,颈部AF的发生率有所下降[3]。AF治疗方案包括肠内外营养、抗生素等保守治疗和内镜下治疗、手术治疗等,尚无有效且完善的治疗方案[4]。目前,仍认为McKeown术后颈部AF重在预防,对发生风险及时进行有效的处理或控制,是改善食管癌患者McKeown术后颈部AF预后的关键。因此,应积极寻找与食管癌患者McKeown术后颈部AF发生相关的因素,加强对食管癌患者McKeown术后颈部AF发生的预防和控制。目前,已有研究分析食管癌患者McKeown术后颈部AF发生的风险因素,如研究发现吸烟史、术中出血量等是食管癌术后发生颈部AF的高风险因素[5]。基于此,本研究尝试构建食管癌患者McKeown术后颈部AF发生的预测模型,为临床预防提供参考。
1 资料与方法
1.1 一般资料 经医院医学伦理委员会审核通过,选取临沂市肿瘤医院2017年3月至2021年3月收治的503例拟行McKeown术的食管癌患者作为研究对象,患者与家属均签署同意书。研究对象中男295例,女208例;年龄42~79岁,平均年龄(52.93±6.55)岁;病理类型:鳞癌366例,腺癌137例;肿瘤位置:颈段56例,胸段447例;TNM分期[6]:Ⅰ期121例,Ⅱ期215例,Ⅲ期167例。
1.2 纳入与排除标准 (1)纳入标准:①符合《食管癌和胃癌治疗指南》[7]中食管癌诊断标准;②经食管镜检查确诊为食管癌;③实施McKeown术;④首发食管癌,首次接受McKeown术;⑤TNM分期为Ⅰ~Ⅲ期;⑥全麻可单肺通气。(2)排除标准:①肿瘤远处转移;②合并其他恶性肿瘤;③术前接受放疗、化疗等相关治疗;④凝血功能异常;⑤心肝肾等重要脏器疾病。
1.3 方法
1.3.1 基线资料收集方法:①手术前,记录患者资料,包括年龄、性别(男/女)、体重指数、肿瘤位置(划分为颈段/胸段)、病理类型(划分为鳞癌/腺癌)、TNM分期划分为Ⅰ期/Ⅱ期/Ⅲ期)、腹部手术史、糖尿病、心脑血管疾病、胃供血动脉钙化。②采集2 ml空腹静脉血,3 000 r/min(半径12 cm)离心10 min,全自动生化分析仪(日立,Hitachi型)测定白蛋白、总胆红素。③使用肺功能检测仪(日本美能,AS-507型)检测肺功能FEV1%。④手术完成后,统计手术时间、术中出血量、淋巴结请扫数量。
1.3.2 颈部AF的评估方法及分组方法:查阅食管癌根治术后患者临床表现,若其出现颈部皮肤红肿、伴有压痛感,皮下气肿、且存在积液,或切口处有气体排除等情况,则怀疑发生颈部AF。通过CT、胸片检查发现以下一项判定为颈部AF:①颈部切口拆开直接可见瘘口;②上消化道泛影葡胺造影发现造影剂外溢现象;③患者口服亚甲蓝后,胸腔、颈部或者纵膈引流管出现引流液染色现象;④数字减影血管造影(digital subtraction angiography,DSA)发现吻合口处有造影剂外溢。根据术后颈部AF发生情况分为颈部AF组(发生颈部AF)和无颈部AF组(未发生颈部AF)。

2 结果
2.1 食管癌患者McKeown术后颈部AF发生情况 503例食管癌患者中,20例在McKeown术后发生AF,发生率为3.97%(20/503)。
2.2 McKeown术后发生、未发生颈部AF的食管癌患者基线资料比较 颈部AF组肿瘤位置在颈段、合并心脑血管疾病、合并胃供血动脉钙化的比例高于无颈部AF组,白蛋白、FEV1%低于无颈部AF组,手术时间长于无颈部AF组,差异有统计学意义(P<0.05);2组其他基线资料比较(P>0.05)。见表1。
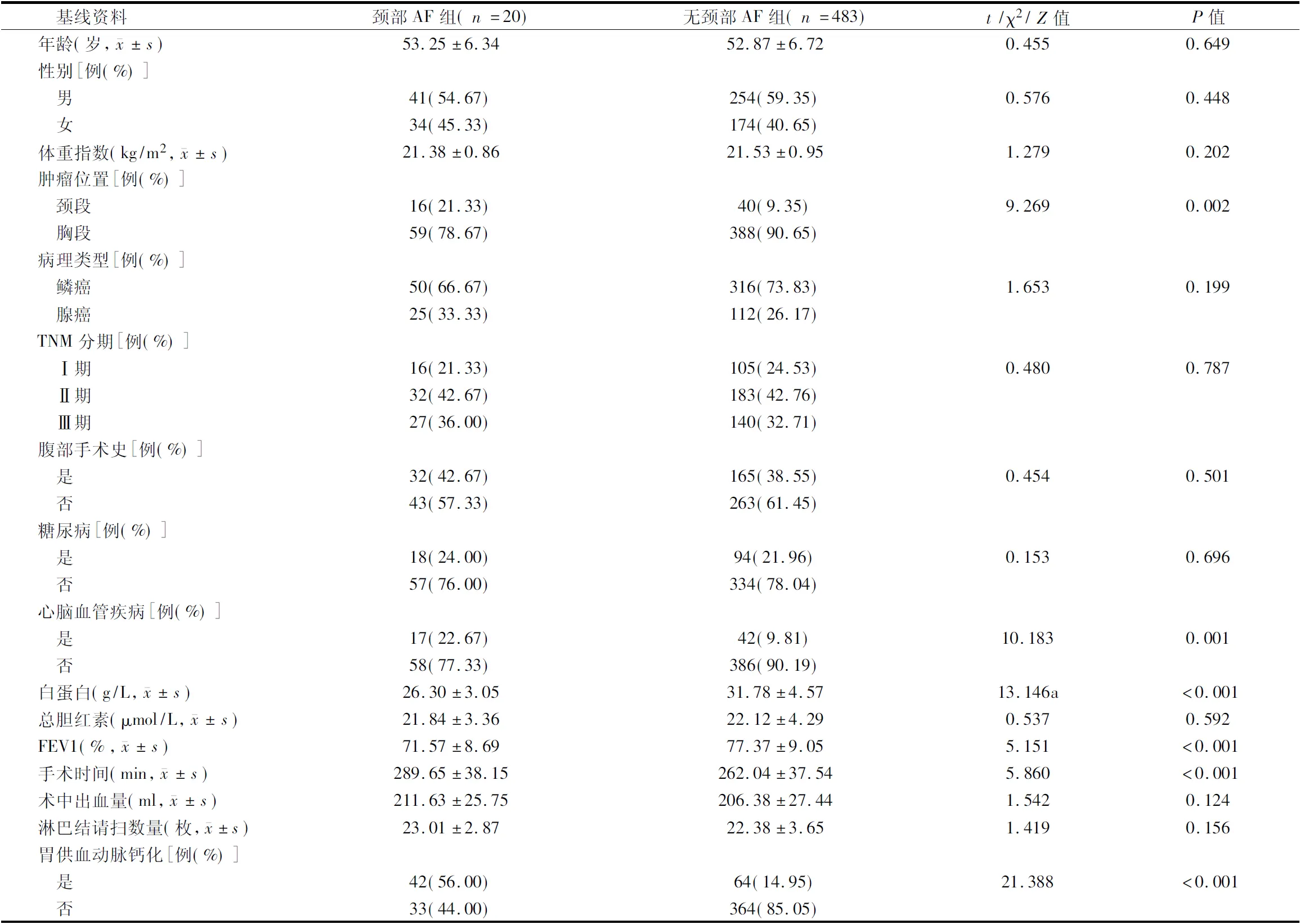
表1 McKeown术后发生、未发生颈部AF的食管癌患者基线资料比较
2.3 食管癌患者McKeown术后发生颈部AF影响因素的Logistic回归分析 将2.2中经比较差异有统计学意义的变量纳入作为自变量,其中包括项目和赋值分别为肿瘤位置(1=颈段,0=胸段)、心脑血管疾病(1=是,0=否)、白蛋白(连续变量)、FEV1%(连续变量)、手术时间(连续变量)、胃供血动脉钙化(1=是,0=否),将食管癌患者McKeown术后颈部AF发生情况作为因变量(1=颈部AF发生,0=颈部AF未发生),结果显示,肿瘤位置在颈段、合并心脑血管疾病、手术时间长、合并胃供血动脉钙化是食管癌患者McKeown术后颈部AF发生的影响因素,差异有统计学意义(OR>1,P<0.05);白蛋白、FEV1%水平高是食管癌患者McKeown术后颈部AF发生的保护因素,差异有统计学意义(OR<1,P<0.05)。见表2。

表2 食管癌患者McKeown术后颈部AF发生影响因素的Logistic回归分析结果
2.4 构建颈部AF风险预测模型及模型验证 绘制列线图,将2.3证实为可能的影响因素(肿瘤位置、心脑血管疾病、白蛋白、FEV1%、手术时间、胃供血动脉钙化)列入,构建颈部AF风险预测模型,经Bootstrap法重复抽样1 000次验证模型,结果显示,C-index值为0.873,模型区分度良好;绘制准曲线显示,校准曲线Y与X直线相近,模型准确度良好。见图1、2。

图1 颈部AF风险预测模型列线图
2.5 颈部AF风险预测模型预测食管癌患者McKeown术后颈部AF发生的决策曲线 以净受益率为纵坐标,高风险阈值为横坐标,绘制决策曲线,结果显示,在阈值0~1.0内,颈部AF风险预测模型预测食管癌患者McKeown术后颈部AF发生的净受益率基本>0,有临床意义,净受益率最大值为0.15。见图3。

图2 颈部AF风险预测模型校准曲线

图3 颈部AF风险预测模型预测食管癌患者McKeown术后颈部AF发生的决策曲线
3 讨论
手术是目前治疗食管癌患者的主要方式,可有效切除病变,遏制肿瘤进展,从而延长患者生存时间。但是食管癌手术难度较大,持续时间较长,术后易并发并发颈部AF,影响恢复情况,可造成切口感染,增加病死风险[8]。McKeown术在食管癌患者中应用较为广泛,在胸腔镜的应用下逐渐实现微创化,降低了术后颈部AF的发生风险[9]。但是,AF发生的影响因素较多,仍有部分食管癌患者在McKeown术后发生颈部AF。因此,积极寻找影响食管癌患者McKeown术后颈部AF发生的因素是有必要的,后续需积极采取措施预防和治疗颈部AK。
本研究结果显示,研究内503例食管癌患者中,20例在McKeown术后发生AF,发生率为3.97%。研究表明,食管癌患者术后颈部吻合口瘘的发生率为16.1%[10],本研究与之相符。说明,目前仍存在部分食管癌患者在McKeown术后发生颈部AF。经Logistic回归,结果显示,肿瘤位置在颈段、合并心脑血管疾病、手术时间长、合并胃供血动脉钙化是食管癌患者McKeown术后颈部AF发生的影响因素;白蛋白、FEV1%水平高是食管癌患者McKeown术后颈部AF发生的保护因素。分析原因可能为:肿瘤位置高的患者在接受McKeown术时,清扫淋巴结的位置相对更高,需要颈部淋巴结清扫的几率也更大,对颈部食管的血流灌注产生较大的影响,损伤创面,不利于吻合口的愈合,从而增加颈部AF的发生风险[11]。而且,肿瘤位置在颈段,食管切除高度更高,造成吻合口处的张力增大,造成颈部AF发生风险增加[12]。
合并心脑血管疾病的患者免疫功能相对更低,组织的愈合能力也相对更低,在McKeown术后,患者进入应激状态,抗感染能力不足,并发症发生的风险相对更高[13]。而且,合并冠心病、高血压等心脑血管疾病的患者往往存在微血管损伤,对微循环产生抑制,患者血液灌注存在一定的缺陷,从而诱发AF或加重AF进展[14]。因此,对于合并心脑血管疾病的食管癌患者应在McKeown术前尽量控制疾病,调节血压、血脂等,预防术后颈部AF的发生。
手术时间可能与食管癌患者McKeown术后颈部AF的发生有关,食管癌McKeown术操作复杂,手术时间越长,越增加术野暴露时间,对机体呼吸系统造成的影响也就越大,增加了呼吸循环系统相关并发症发生风险,如呼吸衰竭、肺部感染等,会降低肺组织的氧合能力和个体对缺氧的耐受能力,造成吻合口处供氧不足而引起颈部AF的形成[15]。而且,手术时间长较长意味着对肺组织的影响也更大,增加手术中操作对血管网的损伤,引起吻合口局部供血障碍;另外,手术时间延长会扩大对机体血液循环系统的影响,可能造成吻合口处缺血坏死,增加术后颈部AF发生的可能[16]。因此,McKeown术治疗食管癌患者时应尽量缩短手术时间,对手术时间较长的患者引起关注,加强对患者吻合口处性状的检查,及时防治术后颈部AF。
合并胃供血动脉钙化的患者全身血管条件相对更差,容易形成动脉粥样硬化,对吻合口局部血流灌注产生负面的影响,可能引起血流障碍而增加AF发生风险[17]。合并胃供血动脉钙化可能造成机体胃部血管缺血缺氧,影响术后吻合口的供血供氧,造成颈部AF形成风险增高[18]。因此,对于合并胃供血动脉钙化的食管癌患者,应在McKeown术前做好充分准备,术后加强预防。
白蛋白与人体的营养状态有关,食管癌患者由于厌食、进食困难等症状,可能出现营养不良,白蛋白水平随之下降。营养状态良好的患者机体蛋白代谢平衡,吻合口愈合较快,不易发生颈部AF[19]。而营养不足的患者肠道吸收功能不佳,造成肠壁水肿,食管胃血液供应不佳,吻合口由于缺乏营养而出现瘘,且营养不足可能增加术后胸腔感染、切口感染等发生风险,不利于吻合口愈合,造成颈部AF发生[20]。因此,术前应正确评估患者营养状况,对术前白蛋白低于35 g、存在营养不良的食管癌患者应给予营养支持,纠正营养不良,术后积极合理补充营养,从而降低术后颈部AF发生风险。
FEV1%是肺功能指标,FEV1%高的食管癌患者肺功能相对更高,肺部氧气交换和通气正常尽行,机体有效摄入氧气,局部吻合口供氧供血充足,利于吻合口组织愈合,因此不易发生颈部AF。FEV1%高的食管癌患者肺功能更高,McKeown术后咳痰较为顺利,不易发生肺部感染,降低了颈部AF的发生风险[21]。若肺功能较低则可能减少摄入氧气,加重术后器官和组织缺氧,造成愈合不良,诱发颈部AF;而且更可能伴随肺不张、肺部感染等,增加剧烈咳嗽排痰的可能,吻合口受到牵拉和冲击,可能增加AF的发生风险[22]。因此,对肺功能较低的食管癌患者应引起重视,术后加强咳嗽排痰管理,注意避免对吻合口造成较大的压力。
本研究根据以上因素绘制列线图构建颈部AF风险预测模型,验证模型显示C-index值为0.873,模型区分度良好,校准曲线Y与X直线相近,模型准确度良好;绘制决策曲线,结果显示,在阈值0.0~1.0,颈部AF风险预测模型预测食管癌患者McKeown术后颈部AF发生的净受益率基本>0,有临床意义。
综上所述,食管癌患者McKeown术后颈部AF发生与肿瘤位置、心脑血管疾病、白蛋白、FEV1%、手术时间、胃供血动脉钙化有关,根据这些因素建立的颈部AF风险预测模型具有一定的预测价值,可获得较高的净受益率。

