不同发酵水分及菌酶协同发酵对豆粕品质的影响
许蒙蒙,罗 怡,王顺洋,张 悦,李梦云,霍文颖,牛丽珠,车 龙
(河南牧业经济学院动物科技学院,河南 郑州 450046)
豆粕粗蛋白含量高、氨基酸含量丰富且比例相对均衡,其中赖氨酸、色氨酸、蛋氨酸等必需氨基酸含量较高,是畜牧养殖业常用的植物性优质蛋白质饲料[1],但豆粕中含有蛋白酶抑制剂、大豆抗原蛋白、大豆凝集素等抗营养因子[2],不仅不能被动物机体利用,还会影响其消化吸收和健康水平[3],因此, 将豆粕中大分子蛋白转变成肽类或氨基酸等小分子物质是提高豆粕蛋白质利用率的关键。
发酵豆粕可以将豆粕中的抗营养因子降解,并将豆粕中大分子蛋白降解为可溶性蛋白和小肽,产生大量益生菌、乳酸、寡肽等活性物质[4],同时益生菌发酵过程可产生多种有益物质, 从而改善豆粕品质、增加适口性、提高饲料养分利用率。发酵豆粕中的微生物还可以改善肠道的微生态环境,增加肠道微生物菌群多样性,提高免疫功能[5]。饲粮中添加适量发酵豆粕能显著提高母猪繁殖性能[6]、断奶仔猪生长性能[7]、蛋鸡产蛋性能[8]、肉鸡生长性能[9],从而提高生产效率。
目前,基于高料水比、单菌种条件下开展的大量研究不断优化发酵豆粕的生产工艺, 而在低水分条件下发酵豆粕的研究相对较少。 微生物在发酵过程中可合成蛋白酶降解大分子蛋白产生肽类物质, 同时发酵产生的有机酸和芳香味物质对改善饲料适口性有重要意义, 单一的微生物发酵因蛋白酶产量不足导致发酵效率较低无法满足生产需求[10],因此,生产中多采用酶解法利用外源蛋白酶将蛋白质降解为多肽以提高豆粕中蛋白质的利用效率, 但有研究显示酶解法易产生苦味物质从而影响适口性[11]。 采用复合菌种协同蛋白酶进行豆粕发酵是改善豆粕品质、 提高生产效率的有效途径。 该研究选择枯草芽孢杆菌、酵母菌、粪肠球菌作为复合发酵菌种, 探讨不同发酵水分及菌酶协同发酵对豆粕品质的影响, 确定合适的发酵水分及蛋白酶添加量, 为发酵豆粕的生产提供数据参考。
1 材料与方法
1.1 试验材料
1.1.1 发酵原料
枯草芽孢杆菌(1×1011CFU/g)、粪肠球菌(1×1011CFU/g) 购买于河南根源生物科技有限公司;酵母菌(2×1010CFU/g)购买于安琪酵母股份有限公司。 中性蛋白酶(50 000 IU/g),购买于山东隆科特酶制剂有限公司。豆粕、葡萄糖、稻糠、玉米由河南通洲生物科技有限公司提供。
1.1.2 主要试剂
LB 培养基、MSY 培养基、YPD 培养基购自北京奥博星生物技术有限责任公司,乳酸试剂盒(南京建成生物工程有限公司)、硫酸(分析纯)、盐酸(分析纯)、 氢氧化钠(分析纯)、0.2%氢氧化钾溶液、10%三氯乙酸、柠檬酸钠溶液(0.1 mol/L)混合指示剂(甲基红乙醇溶液和溴甲酚绿乙醇溶液等体积混合)、硼酸吸收液(20%)、凯氏定氮催化剂片、茚三酮溶液。
1.1.3 主要仪器设备
立式压力蒸汽灭菌锅(YM100LII,上海三申医疗器械有限公司)、双人超净工作台(SW-CJ-2,苏州净化设备有限公司)、 电热恒温培养箱 (dhp-9052,上海捷呈试验仪器有限公司)、全自动凯氏定氮仪(K9860,山东海能科学仪器有限公司)、台式pH 测定仪(PB-10,德国sartorius)、石墨消解仪(SH420F,山东海能科学仪器有限公司)、紫外可见光分光光度计(UV-1100,赛默飞世尔科技)、综合型超纯水机(Master-S15,上海和泰仪器有限公司)、超声波振荡器(KQ-500DB,昆山市超声仪器有限公司)。
1.2 试验方法
1.2.1 菌种活力鉴定
菌种于液体培养基置于37 ℃恒温摇床培养30 min 使其复苏,在无菌操作台中倍比稀释,选择10-8、10-9、10-10梯度稀释液,将枯草芽孢杆菌、粪肠球菌、 酵母菌分别涂布在已灭菌的LB 培养基、MSY 培养基、YPD 培养基上, 涂布完成后于37 ℃恒温培养箱培养24 h,计数并计算各菌种活力。
1.2.2 豆粕发酵方法
首先, 采用单因素试验设计分别设置5 个不同水分处理组,料水比分别为1∶0.4、1∶0.5、1∶0.6、1 ∶0.7、1 ∶0.8, 发 酵 料 水 分 含 量 计 算 值 分 别 为28.6%、33.3%、37.5%、41.2%、44.4%,每个处理组3个重复;其中每个处理组菌种按枯草芽孢杆菌∶粪肠球菌∶酵母菌=1∶1∶1 的方式添加, 每种菌接种量为5.0×107CFU/g,发酵底物为95%豆粕+2%稻糠+2%玉米粉+1%葡萄糖。37 ℃恒温发酵72 h 后收集发酵豆粕样品,保存待测。 其次,根据上述方法确定最适料水比,采用单因素试验设计,分别设置5个不同蛋白酶添加量处理组, 添加量分别为0、100、200、400、800 IU/g, 每个处理组设3 个重复,菌种添加方式同上,37 ℃恒温发酵72 h 后收集发酵豆粕样品,保存待测。
1.2.3 样品采集
发酵过程中每隔24 h 观察发酵袋发酵产气情况,取发酵0、72 h 鲜样约100 g,取样前摇晃混匀,使所取的样品均匀分布,取15 g 鲜样分别测定水分、pH 值并平板涂布检测菌的数量, 剩余鲜样65 ℃烘干粉碎后留存待测。
1.2.4 测定指标及方法
水分测定:参照中华人民共和国国家标准《饲料中水分测定方法》(GB/T 6435—2014)。 活菌数量测定: 将10 g 样品与90 mL 无菌水混合置于摇床上200 r/min 摇动20 min 制备成菌悬液,倍比稀释后用平板涂布法接种于已灭菌的YPD、MRS、LB 培养基,37 ℃恒温培养24 h 后计算菌的存活量。 YPD 培养基:培养基中加入青霉素、链霉素各50 μg/mL,用于真菌(酵母菌)的培养;MRS 培养基:选择性培养乳酸菌(粪肠球菌);LB 培养基:用于枯草芽孢杆菌的培养, 根据菌落形态计数枯草芽孢杆菌数量;培养基的制备参考张亚辉[12]报道的方法。 pH 值测定:称取5.0 g 鲜样置于烧杯中加入10 mL 蒸馏水, 用玻璃棒搅拌均匀后放置于超声波振荡仪处理30 min 后利用台式pH 仪测定pH 值。 乳酸测定:使用乳酸测定试剂盒测定乳酸含量,并用朗伯比尔定律计算各样品中乳酸含量。粗蛋白测定:按照中华人民共和国国家标准《饲料中粗蛋白的测定》(GB/T 6432—2018)方法进行测定。样品蛋白质浓度及蛋白质亚基分布测定:取烘干粉碎后的样品0.1 g, 加入2 mL 蛋白质裂解液,用漩涡仪振荡1 h,2 000 r/min 离心10 min, 取上清液于干净EP 管中备用。 使用BCA 蛋白质浓度测定试剂盒(购买于碧云天生物科技有限公司)测定总蛋白浓度后制备电泳样品。 配制浓缩胶和10%的分离胶,上样20 μL,在电泳槽中进行SDSPAGE 凝胶电泳(70 V 电泳30 min,110 V 电泳1 h),使用考马斯亮蓝快速染色液(购买于碧云天生物科技有限公司)染色并用脱色液脱色,观察并统计蛋白质分布情况。
1.3 统计分析
使用Excel 软件对数据进行初步整理后,使用SPSS 22.0 统计学软件对试验数据进行单因素方差分析, 用Tukey 法进行多重比较, 试验结果用“平均数±标准误” 表示,P>0.05 表示差异不显著,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 不同发酵水分对豆粕表观及营养指标的影响
从图1 中可知,随着发酵水分的增加,发酵豆粕颜色逐渐变深、水溶液浑浊度逐渐增加。 如表1所示,豆粕发酵后pH 值随着发酵水分的增加而极显著(P<0.01)降低;乳酸含量随着水分的增加极显著(P<0.01)提升,其中1∶0.6、1∶0.7 和1∶0.8 组乳酸含量极显著(P<0.01)高于1∶0.4 和1∶0.5 组;发酵后的粗蛋白含量比发酵前有所增加, 但各处理组间差异不显著 (P>0.05), 其中料水比为1∶0.6组粗蛋白含量最高,达到47.17%,较发酵前提高了9.39%。

表1 不同发酵水分对豆粕营养指标的影响 单位:%

图1 不同发酵水分条件下豆粕的颜色
2.2 不同发酵水分对豆粕菌含量的影响
由表2 可知, 发酵豆粕中枯草芽孢杆菌、酵母菌、粪肠球菌存活量随着发酵水分增加而极显著(P<0.01)提升,料水比为1∶0.4 和1∶0.5 组3 种菌的存活量极显著(P<0.01)低于其他组;料水比为1∶0.8 组中3 种菌的存活量显著(P<0.01)高于其他4 个处理组,存活总量达到1.43×109CFU/g。结合上述试验结果并考虑工业化生产条件,选择料水比为1∶0.6 作为最适发酵水分开展后续试验。

表2 不同发酵水分对豆粕菌含量的影响 单位:×107 CFU/g
2.3 不同蛋白酶添加量对发酵豆粕表观及营养指标的影响
如图2 所示,随着蛋白酶添加量的增加,发酵豆粕颜色逐渐变深、水溶液浑浊度逐渐增加。由表3 可知, 各处理组间发酵72 h 后水分变化无显著(P>0.05)差异;与不同料水比发酵试验相似,粗蛋白含量在蛋白酶添加后有所提高, 但不同组间无显著(P>0.05)差异;与未添加蛋白酶组相比,添加蛋白酶组发酵豆粕的pH 值显著(P<0.05)增加;同时,随着蛋白酶添加量的增加,乳酸含量呈现降低趋势, 表明蛋白酶的添加对豆粕发酵产酸能力有抑制作用。

图2 不同蛋白酶添加量对发酵豆粕颜色的影响

表3 不同蛋白酶添加量对发酵豆粕营养指标的影响 单位:%
2.4 不同蛋白酶添加量对发酵豆粕菌含量的影响
由表4 可知,3 种菌的存活量随着蛋白酶添加量的增加而降低,0 IU/g 和100 IU/g 处理组中的枯草芽孢杆菌和粪肠球菌的存活量极显著 (P<0.01)高于其他3 个处理组,但2 组存活量无显著(P>0.05)差异。 酵母菌的存活量在蛋白酶添加量为100 IU/g 和200 IU/g 处理组极显著(P<0.01)高于0、400、800 IU/g 处理组。
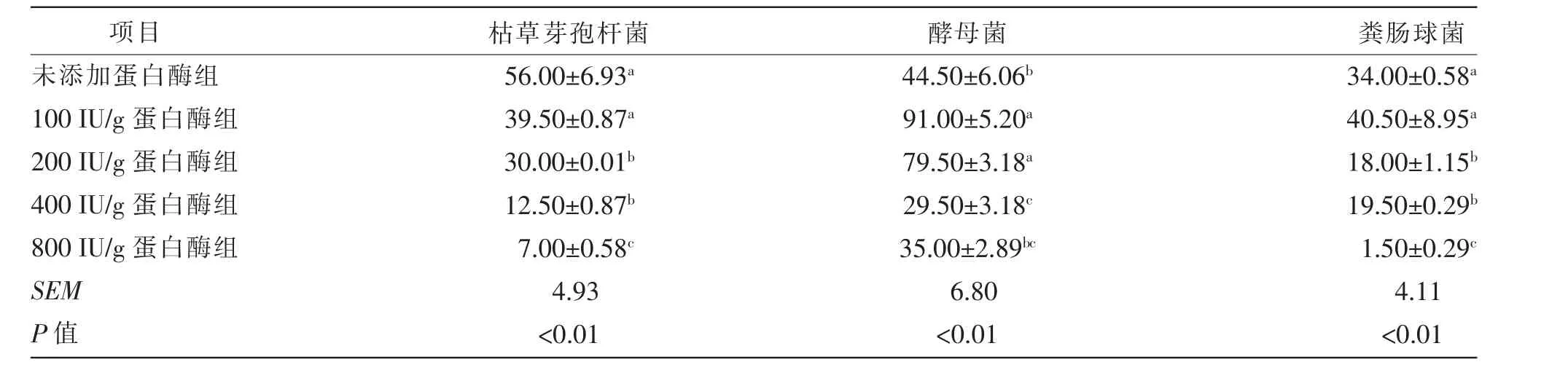
表4 不同蛋白酶添加量对发酵豆粕菌含量的影响 单位:×107 CFU/g
2.5 不同蛋白酶添加量对发酵豆粕蛋白质亚基分布的影响
由图3 可知,随着蛋白酶添加量的增加,大分子蛋白会被降解成小分子蛋白和小肽。 与益生菌发酵组相比, 不同剂量的蛋白酶与益生菌协同发酵组的豆粕中大分子蛋白被显著降解,16~30 kDa的条带颜色随蛋白酶添加量的增加而加深。 由表5 可知,与未发酵的豆粕相比,豆粕在菌酶协同发酵后,30 kDa 范围内的小分子蛋白显著增加,并随着蛋白酶添加量的增加而增加。 100 IU/g 蛋白酶添加组30 kDa 范围内的小分子蛋白达到46.06%,是未添加蛋白酶组的1.83 倍;800 IU/g 蛋白酶添加组30 kDa 范围内的小分子蛋白达到65.56%,是未添加蛋白酶组的2.61 倍。

表5 不同蛋白酶添加量对发酵豆粕蛋白亚基分布的影响 单位:%

图3 不同蛋白酶添加量发酵豆粕蛋白SDS-PAGE 电泳图
3 讨论
3.1 发酵水分对豆粕品质的影响
豆粕发酵过程中, 益生菌会代谢底物中的碳水化合物等养分, 合成菌体蛋白和蛋白酶等活性物质,使发酵后的粗蛋白含量相对增加,但该研究发现不同料水比发酵组粗蛋白含量无显著差异,这与吝常华等[13]研究料水比对豆粕发酵的影响结果相似。料水比为1∶0.6 的处理组中粗蛋白含量最高,达到47.17%,粗蛋白含量增加了9.39%,但随着料水比的增加,粗蛋白含量无显著差异,可能是。因为微生物密度与活性变化所导致。 发酵起始基质含水量高,容易导致基质多孔性降低,减少基质内气体,同时增加营养成分和菌体的流动性,因此菌的活性和发酵效率提高;而含水量低,造成基质膨胀程度低,菌体生长受抑制,酶产量下降,从而影响微生物的生长[14]。由该试验结果可知,随着料水比的增加, 发酵豆粕中益生菌的存活量呈增加趋势,料水比为1∶0.8 处理组中复合菌存活总量达到1.43×109CFU/g,这与李龙[15]研究复合益生菌发酵饲料的结果相似, 其含水量为50%的发酵饲料菌总数较含水量为30%、40%组显著提高,但密度和活性的增加导致微生物代谢加快, 增加了对基质中营养物质消耗量, 从而导致该试验中高料水比组粗蛋白水平有所降低。pH 值和有机酸含量是衡量发酵豆粕品质的重要指标,饲粮pH 值降低可提升饲粮适口性和消化率, 同时饲粮中酸性物质
刺激唾液和酶的分泌,增加动物食欲[16]。该试验中随着料水比的增加乳酸的产生量显著提升,pH 值显著降低,对改善饲粮品质有重要意义,但过高的水分将极大增加烘干所需成本。综上所述,该试验选择料水比为1∶0.6 进行菌酶协同发酵试验。
3.2 菌酶协同发酵对豆粕品质的影响
利用复合益生菌发酵豆粕时, 外源添加蛋白酶有效降低大豆球蛋白含量, 同时抑制有害菌的增殖提高豆粕营养价值[17]。该研究结果显示,在选定适宜发酵水分的基础上, 添加不同量的蛋白酶进行菌酶协同发酵, 发酵后豆粕的颜色加深呈现深棕色, 且随着蛋白酶添加量的增加水溶液的浑浊程度加深, 表明蛋白酶的添加对豆粕中小肽的产生有显著促进作用, 与SDS-PAGE 胶电泳分离蛋白结果一致, 电泳条带显示蛋白酶添加组小分子蛋白(<30 kDa)含量随酶的添加量增加而显著增加,大分子蛋白(>66 kDa)含量显著降低,表明酶促水解可以加快大豆发酵过程中蛋白质的降解,从而提高肽的产量[18]。 张亚辉[12]的研究报道显示,发酵后的大分子蛋白明显降低,主要集中在<26 kDa 的范围内,是总蛋白的75.25%。在该试验中,随着蛋白酶添加量的增加,豆粕粗蛋白水平无显著差异,但大分子蛋白被酶不同程度地降解,大部分小分子蛋白落在<30 kDa 范围内。当蛋白酶添加量为800 IU/g 时,<30 kDa 范围内的小分子蛋白达到65.56%,是未发酵豆粕的4.24 倍,是未添加蛋白酶组的2.61 倍,这与前人菌酶协同发酵豆粕工艺的优化研究结果相似, 菌酶协同发酵时中性蛋白酶添加量为1 250 IU/g 时,<31 kDa 的蛋白显著增多,是未发酵豆粕的2.23 倍[19]。 综上所述,菌酶协同发酵可有效降解豆粕中的大分子蛋白,改善豆粕的品质,且发酵效果优于未添加蛋白酶组。
该试验结果发现,随着蛋白酶添加量的增加,乳酸的含量呈现下降趋势, 这与前人在菌酶协同发酵豆粕试验中乳酸含量变化结果不一致[20],可能由于蛋白酶的添加促进蛋白质的分解产生胺类物质或氨气使得产物pH 值升高,中和了部分乳酸所致。同时,菌的存活量随着蛋白酶添加量的增加而降低, 蛋白酶添加量为800 IU/g 的处理组中的存活总量为4.35×108CFU/g, 显著低于对照组(1.34×109CFU/g) 及100 IU/g 的 蛋 白 酶 添 加 组(1.71×109CFU/g),同时100 IU/g 组枯草芽孢杆菌和粪肠球菌存活量均高于其他处理组, 表明高剂量蛋白酶的添加对菌的存活有抑制作用。 蛋白酶添加降低乳酸含量和菌的活力, 可能与菌酶之间产生拮抗有关[21],因为枯草芽孢杆菌和粪肠球菌代谢将会产生一定量的蛋白酶, 蛋白酶累积过多将会负反馈抑制枯草芽孢杆菌、粪肠球菌的活力,使菌的存活量减少,导致pH 值及乳酸含量都出现不同程度的变化。
4 结论
结合该试验结果并考虑工业化生产条件和成本,料水比为1∶0.6(水分含量:37.5%)条件下添加100 IU/g 的中性蛋白酶进行固态发酵可有效改善豆粕品质。

