不同剂型苯甲酸在体外和体内的控释效果研究
赵晓南,胡友军,程皇座,刘 坚,陆信芳,李海芸
(广东酸动力生物科技有限公司,广东 清远 511500)
苯甲酸作为酸化剂,在动物饲粮中适量添加,能有效提高动物生长性能、维持肠道微生态平衡,从而保障畜禽健康[1-2]。 但添加苯甲酸常规剂型时,其可快速进入血液,引起血糖升高,产生饱腹感,从而降低采食量[3]。 此外,分子态苯甲酸虽具有良好的抑菌能力, 但在胃肠道生理环境下会迅速离子化[4],失去抑菌能力,不能有效到达肠道中后段的菌群富集处发挥功效,因此,在畜禽养殖生产上常通过剂量效应来达到抑制有害菌繁殖和促生长的效果[5]。 通过包被控释工艺处理,使苯甲酸分子安全过胃,且避免在肠道前段大量离子化,实现其在全肠道的长效抑菌功效, 是经济有效的使用途径。 该试验通过体外溶出试验和体内控释试验, 比较研究普通型与控释型2 种剂型苯甲酸的控释效果, 为控释型苯甲酸在畜禽养殖生产上的科学应用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 苯甲酸及相关试剂
普通型苯甲酸为市售产品, 苯甲酸含量≥99%; 控释型苯甲酸由广东酸动力生物科技有限公司生产,苯甲酸含量≥40%。 0.1%普通型苯甲酸的面粉丸剂、 含0.1%控释型苯甲酸的面粉丸剂,制作方法:取少量干面粉,加微量水,搅拌后搓成细条, 分成微小的丸剂, 提前1 d 测算鸡的采食量, 按0.1%比例称取普通型和控释型苯甲酸,均匀黏附在上述丸剂,即得。 对照品苯甲酸,纯度≥99%,购自阿拉丁试剂公司。 甲醇为色谱纯,购自天津市科密欧化学试剂有限公司; 其余试剂为分析纯,水为超纯水。
1.1.2 人工胃液和人工肠液
人工胃液和人工肠液参照 《中国药典》2015版配制。人工胃液制备方法:取浓盐酸23.4 mL,用水定容至100 mL 配制成稀盐酸, 取上述稀盐酸16.4 mL,加水500 mL 与10 g 胃蛋白酶混匀,搅拌均匀,加水稀释定容至1 000 mL,调pH 值至3.5;人工肠液制备方法:取6.8 g 磷酸二氢钾,加500 mL水溶解,与10 g 胰蛋白酶混匀,加水稀释定容至1 000 mL,调pH 值至6.8。
1.1.3 主要仪器
Agilent-1260 高效液相色谱仪, 安捷伦科技(中国)有限公司产品;雷磁PHS-3C 型pH 计,上海雷磁仪器有限公司产品;RC806D 溶出度仪,天津市天大天发科技有限公司产品。
1.1.4 试验动物及饲养管理
体重相近、健康的60 日龄清远麻肉鸡36 只,购自广东省佛山新广农牧有限公司。 试验在广东酸动力创新中心动物试验基地进行。预饲期间,试验鸡自由采食和饮水。
1.2 试验方法
1.2.1 体外溶出试验
1.2.1.1 体外试验苯甲酸含量测定方法
①溶出度仪参数设置:开启溶出度仪,将控温设置为39.0 ℃,转速设置为100 r/min,调整溶出度仪的取样参数分别为1、2 h(人工胃液)和1、2、3、4 h(人工肠液)。
②启动溶出度仪升温系统,待水温达到39 ℃时, 分别称取普通型苯甲酸和控释型苯甲酸样品各1 g(精确至0.000 1 g)于200 目转篮中,置于对应的溶出杯中,各加入500 mL 的人工胃液或人工肠液,启动溶出度仪搅拌系统,开始计时。
③在试验设定的各时间点, 分别吸取对应样液5 mL,过滤,并置于对应的具塞比色管中。
④从对应的比色管中分别吸取1 mL 样液于对应的10 mL 容量瓶中, 用蒸馏水定容至刻度摇匀,参照《食品安全国家标准 食品中苯甲酸、山梨酸和糖精钠的测定》(GB 5009.28—2016),应用高效液相色谱(HPLC)技术检测苯甲酸含量。
1.2.1.2 指标计算方法
溶出度(%)=人工胃液或人工肠液中的苯甲酸含量/样品中测定的苯甲酸含量×100。
留存率(%)=100-溶出度。
1.2.2 体内控释试验
1.2.2.1 试验设计
将36 只清远麻肉鸡随机分为3 组, 每组12只。 用不含苯甲酸的空白饲粮预饲7 d,第8 天晨饲后立即分别投喂纯面粉丸剂 (对照组)、含0.1%普通型苯甲酸的面粉丸剂 (普通型苯甲酸组)、含0.1%控释型苯甲酸的面粉丸剂(控释型苯甲酸组),在投喂后0、1、2、4 h 时,麻醉、屠宰肉鸡并取样。
1.2.2.2 样品采集与处理
在投喂后0、1、2、4 h,每个时间点每组屠宰3 只鸡,迅速取腺胃、肌胃、十二指肠、空肠、回肠、盲肠、结肠、直肠内容物,分装于灭菌EP 管中,-20 ℃保存,待测苯甲酸浓度。
1.2.2.3 胃肠内容物苯甲酸含量测定方法
取内容物样品0.5 g 左右, 精确至0.000 1 g,用0.1 mol/L 稀盐酸溶解, 超声30 min 后, 用0.1 mol/L 稀盐酸定容至50 mL,过滤,滤液经高效液相色谱仪检测,并采用外标法,计算内容物中苯甲酸浓度。
色谱条件:Agilent-1260 高效液相色谱仪;色谱 柱:Thermo Scientific Hypersil GOLD aQ (150 mm×4.6 mm,3 μm);柱温:30 ℃;流动相:甲醇-乙酸铵(5∶95),流速1 mL/min;紫外检测波长:230 nm;进样量:20 μL。
1.3 数据处理
试验数据采用Excel 2007 进行初步整理。 体内试验数据采用SPSS 22.0 统计学软件进行单因素方差分析, 采用Duncan′s 法进行组间多重比较;体内试验测定结果以“平均值±标准差”的形式表示,以P<0.05 作为差异显著性判断标准。
2 结果与分析
2.1 不同剂型苯甲酸的体外控释效果
2.1.1 不同剂型苯甲酸在人工胃液中的留存效果
由表1 可知,在人工胃液中1 h,控释型苯甲酸的留存率即过胃率是普通型苯甲酸的3.45 倍;在人工胃液中2 h 时, 普通型苯甲酸的含量低于检测下限,而控释型苯甲酸的留存率为56.18%。

表1 不同剂型苯甲酸在人工胃液中的留存率 单位:%
2.1.2 不同剂型苯甲酸在人工肠液中的留存效果
由表2 可知,在人工肠液中1 h,普通型苯甲酸含量已低于检测下限, 而控释型苯甲酸的留存率为70.13%;至4 h 时,控释型苯甲酸的留存率为40.10%。

表2 不同剂型苯甲酸在人工肠液中的留存率 单位:%
2.2 不同剂型苯甲酸的体内控释效果
2.2.1 采食后0 h 肉鸡胃肠道内容物中苯甲酸浓度
如表3 所示,采食后0 h,与对照组相比,不同剂型苯甲酸组在各区段胃肠道内容物中的苯甲酸浓度差异均不显著(P>0.05)。

表3 采食不同剂型苯甲酸后0 h 肉鸡胃肠道内容物中的苯甲酸浓度 单位:μg/g
2.2.2 采食后1 h 肉鸡胃肠道内容物中苯甲酸浓度
如表4 所示,采食后1 h,与对照组相比,采食普通型苯甲酸或控释型苯甲酸显著(P<0.05)增加胃肠道内容物中的苯甲酸浓度(盲肠、结肠+直肠段除外); 苯甲酸主要集中在胃部和十二指肠,以控释型苯甲酸组在腺胃+肌胃中的苯甲酸浓度最高,是普通型苯甲酸组的5.46 倍,二者差异显著(P<0.05)。 这表明,采食后1 h,不同剂型苯甲酸可增加胃肠道内容物中的苯甲酸浓度, 控释型苯甲酸效果优于普通型苯甲酸。
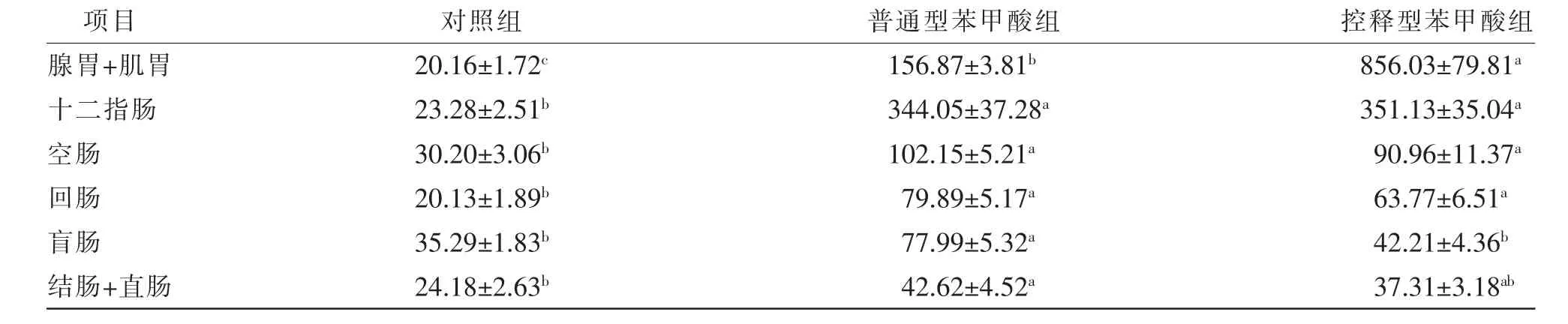
表4 采食不同剂型苯甲酸后1 h 肉鸡胃肠道内容物中的苯甲酸浓度 单位:μg/g
2.2.3 采食后2 h 肉鸡胃肠道内容物中苯甲酸浓度
如表5 所示,采食后2 h,与对照组相比,采食普通型苯甲酸或控释型苯甲酸依然显著(P<0.05)增加胃肠道内容物中的苯甲酸浓度(结肠+直肠段除外);苯甲酸主要集中在小肠和盲肠段,其中,控释型苯甲酸组在小肠后段(空肠、回肠)和盲肠内容物中的苯甲酸浓度显著(P<0.05)高于普通型苯甲酸组,空肠、回肠、盲肠内容物中的苯甲酸浓度分别是普通型苯甲酸组的1.61、2.43、1.95倍。 这表明,采食后2 h,不同剂型苯甲酸均可过胃进入肠道,控释型苯甲酸过胃率高于普通型苯甲酸。

表5 采食不同剂型苯甲酸后2 h 肉鸡胃肠道内容物中的苯甲酸浓度 单位:μg/g
2.2.4 采食后4 h 肉鸡胃肠道内容物中苯甲酸浓度
如表6 所示,采食后4 h,与对照组相比,采食普通型苯甲酸或控释型苯甲酸显著(P<0.05)增加肠道内容物中的苯甲酸浓度(盲肠、结肠+直肠段除外); 普通型苯甲酸组主要在空肠和回肠段;控释型苯甲酸组在小肠后段和大肠段均有大幅度提升, 且回肠内容中的苯甲酸浓度是普通型苯甲酸组的6.68 倍,二者差异显著(P<0.05)。 这表明,采食后4 h, 控释型苯甲酸仍能在小肠后段存留,缓慢释放苯甲酸。

表6 采食不同剂型苯甲酸后4 h 肉鸡胃肠道内容物中的苯甲酸浓度 单位:μg/g
3 讨论
苯甲酸具有广谱且稳定的抑菌能力, 广泛应用于食品防腐[6]。 同时,苯甲酸作为一种酸度调节剂广泛应用于饲料养殖行业, 用于改善动物肠道菌群和提高生产性能[7-8]。 研究表明,苯甲酸的良好抑菌能力取决于其特殊的抑菌机理, 即分子态苯甲酸自由扩散进入细菌细胞膜, 在细菌体内弱碱性环境下迅速解离为酸根离子和氢离子, 扰乱细菌内稳态,影响细菌正常代谢和繁殖,而细菌为调节内环境稳态, 启动氢离子转运泵将多余的氢离子转运出体内,这一过程需要耗能,最终导致细菌衰竭死亡,从而起到抑菌杀菌作用[9]。 但由于苯甲酸本身特殊的代谢和理化特性, 在动物机体内,其能够快速吸收进入血液引起血糖升高,并在动物肠道生理环境下快速离子化而失去抑菌能力[3]。 故常规未处理或普通制剂处理的苯甲酸通常会在消化道前段离子化,发挥消化酸作用,能到达肠道尤其是肠道后段发挥抑菌作用的苯甲酸分子数量大大降低,不能有效发挥抑菌作用。 Silveira等[10]研究显示,添加不同剂量苯甲酸使仔猪胃中pH 值均显著降低, 而肠道中pH 值无显著变化,充分证明了未经处理的苯甲酸大部分在胃中被离子化。
分子态苯甲酸具有显著抑菌能力, 通过路易斯酸碱电子理论可以得到解释, 这与苯甲酸分子和苯甲酸根离子电子云密度分布密切相关,因此,一直以来, 人们通过剂量效应提高苯甲酸在肠道内的分子留存率,从而达到抑菌促生长效果。众多研究表明, 在仔猪饲粮中至少添加5 kg/t 苯甲酸才具有抑菌效果[11-15]。 但这也极大地增加了动物脾、肝、肺等内脏功能损伤的风险和养殖成本[16-17],甚至有抑制生长的负面结果[18],因此,国际上从2016 年就开始了苯甲酸的制剂化探索和应用,通过包被控释处理的方式提高苯甲酸在胃肠道内的分子留存率[19],进而减少添加量。 在该研究中,相较于普通型苯甲酸, 控释型苯甲酸在体外和体内试验中均有较高的过胃率, 且能在肠道后段长效控释,这与Yousaf 等[19]的研究结果一致。 这表明控释型苯甲酸可实现在畜禽全肠道持续缓慢释放,能够以分子态发挥抑菌促生长作用,最终实现低剂量添加、降本增效的目的。 Morel 等[20]在30~60 kg 生长猪上开展了2.1 kg 包被苯甲酸和5 kg普通苯甲酸的比较试验, 结果表明包被苯甲酸组日增重、采食量和料重比均有改善,这也说明控释型苯甲酸具有使用剂量低、 产出效果高的应用价值。
4 结论
体外和体内试验均表明, 与普通型苯甲酸相比, 经包被等制剂化处理的控释型苯甲酸能有效过胃并进入肠道后段,在整个肠道缓慢释放,实现长效抑菌功效。

