高中化学解题中建模思想的有效应用
杨 洋
(江苏省淮安市楚州中学 223200)
建模思想是一种运用模型分析、解决问题的思想.在教学实践中,教师应从模型构建、模型应用两个方面展开教学,深化学生对化学知识的认识与理解,提高学生建模思想应用意识,帮助其积累建模思想应用经验,促使学生的解题能力提升到一个新的高度.
1 氧化还原反应模型及应用
氧化还原反应是高中化学非常重要的模型.构建氧化还原反应模型应从化合价的变化判断出氧化剂和还原剂,其中氧化剂得到电子被还原对应还原产物;还原剂失去电子被氧化对应氧化产物.该模型牢记两个非常重要的关系:得失电子守恒关系和氧化性、还原性强弱关系.氧化剂得到的电子数目与还原剂失去的电子数目始终相等.同时,氧化剂的氧化性强于氧化产物,还原剂的还原性强于还原产物.守恒关系可用于相关参数的计算,氧化性还原性强弱关系可用于判断化学反应的先后顺序.当然应用氧化还原反应模型解题还应注重元素守恒的应用,以构建相关等式关系.
例1在适量的浓硝酸中融入一定量的金属铜,铜无剩余,测得生成了混合气体共1.8mol(含NO、N2O4、NO2).将得到的气体平均分成两份,一份与标准状况下8.96L氧气反应后用水吸收,无剩余气体;一份刚好被500mL 2mol/L的NaOH溶液吸收,生成含有NaNO2和NaNO3的盐溶液,则NaNO3的物质的量为( ).
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
直接写出化学方程式还需配平,相对来说较为繁琐.运用氧化还原反应模型,氮元素守恒,分析两份气体的内在联系.同时,因气体和氧气反应后均转化成稀硝酸,采用整体思想,设出并求出氮元素化合价变化的平均值,借助钠元素守恒以及得知电子守恒,可顺利求解出结果.
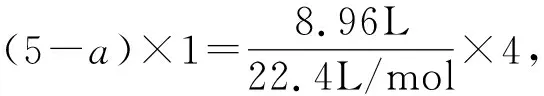
2 离子方程式正误判断模型及应用
离子方程式正误判断是高中化学测试以及高考的参考题型.教学实践中教师应分析离子方程式书写时注意的事项,通过构建针对性模型,将判断正误的知识点系统起来,指引学生以后更好的解题.首先,分析物质状态,确定是否将物质拆分成离子形式.其中氧化物、易挥发物、难电离物质、难溶物质,不拆分.同时,对于生成物为气体、沉淀的应标明对应符号;其次,看参加反应物质的顺序、比例是否正确.对于有多种物质的存在的反应需根据氧化性、还原性强弱,判断反应顺序是否正确以及参与反应的物质关系、对应的生成物是否正确;最后,分析电荷是否守恒.离子方程式两边电荷应守恒.为使学生运用离子方程式正误判断模型全面的考虑问题,提高解题正确性,教师应做好典型例题讲解,做好习题中错误离子方程式的纠正.
例2下列离子方程式书写正确的是( ).
A.丙烯醛和足量溴水反应:

2Br-+2H++CH2BrCHBrCOOH
B.Na2O2固体投入到H218O中:

C.向Na2SO3溶液中通入少量Cl2:
D.用高锰酸钾溶液滴定草酸:
10CO2↑+2Mn2++8H2O
习题考查的知识点较多,包括有机物中的加成、氧化反应、物质自身的氧化还原反应、受物质的量影响的氧化还原反应.教师授课时需应用模型知识逐一进行分析,展示模型知识的具体应用.
解析A项有碳碳双键存在因此发生加成反应,Br2具有较强氧化性可将—CHO氧化成—COOH,正确;B项,反应中Na2O2既为氧化剂又是还原剂,水的化合价并未发生改变,正确的离子方程式为

错误;D项草酸为弱酸,离子式不拆开,错误.综上分析选择A项.
3 化学平衡模型及应用
化学平衡是高中化学的重难点.为提高学生解决化学平衡问题的能力,教学实践中,教师应与学生一起构建化学平衡模型,将相关因素对化学平衡的影响整合到一个模型之中,深化学生理解,为其灵活应用奠定坚实基础.温度、物质的量浓度、压强对化学平衡的影响从整体上遵循勒夏特列原理.但是对于压强这一因素较为特殊,如可逆反应是相对分子质量不变的反应,增大压强并不会影响化学平衡移动.另外,计算与化学平衡相关的参数,注重列出三段式,设出相关参数,结合题干条件构建、求解方程.对于范围类的问题可采用极限思维进行分析.

A.正反应吸热
B.甲容器压强增大可能由气体总物质的量增大引起
C.a点平衡常数K=12
D.气体总物质的量na 图1 以图像为背景考查学生化学平衡知识的掌握与理解情况,是化学平衡部分的常见题型.针对该题应找到引起图线变化的主要因素,借助化学平衡模型有效地切入,尤其通过分析图像参数、图线高低关系,找到隐含的物质的量关系. 原电池模型是高中化学非常重要的模型.教学实践中,教师应注重预留空白时间要求,学生自己构建原电池模型,加深对原电池的深层次认识.根据物质元素化合价变化,确定失去电子和得到电子的物质以及电极名称.结合氧化还原反应模型可知,失去电子被氧化,得到电子被还原,即正负电极对应的反应类型为:还原反应、氧化反应.电子通过导线转移,但不过溶液.溶液中的离子按照阴向负,阳向正的原则移动,即阴离子向负极移动,阳离子向正极移动.对于相关物质参数的计算依据电极反应方程式进行.为锻炼学生的学以致用能力,教师应与学生一起完成相关例题的解答. 例4如图2为一种以MoS2为电极催化剂的Zn-NO电池系统.系统既能合成氨又能提供电能,工作原理如图2所示.其中双极膜可将水解离为H+与OH-,并实现定向通过,则以下说法不正确的是( ). 图2 A.电势Zn/ZnO电极低于MoS2电极电势 B.电池工作时NaOH溶液与Na2SO4溶液浓度均变小 D.电路通过1mol电子,整个电池系统质量会增大3g 由原电池模型能很快判断出电极的正负,NO→NH3的转化对应正极.判断物质浓度变化情况,结合电极反应方程式中的产物不难作出判断.结合氧化还原反应以及原电池模型,可顺利写出对应电极的电极反应方程式求出相关参数. 盐类的水解是高中化学较为抽象的知识点.教学实践中教师应构建盐类的水解模型,使学生牢记“越弱越水解,谁强显谁性”,理解该句话表示的含义.比较溶液中离子浓度大小应判断水解与电离之间的强弱关系、溶液的pH,借助电荷守恒、元素守恒、物料守恒做出判断.另外,教师应在学生牢记该模型相关规律的基础上,多组织学生训练,深化其理解,锻炼其解题能力,提高其解题水平. 例5将0.02mol/L的MOH溶液逐滴滴加到100mL0.01mol/L的HA溶液中.混合溶液pH和加入MOH溶液体积之间的关系如图3所示(忽略溶液体积变化),则( ). 图3 A.MOH为一元强碱溶液pH和MOH体积关系图象 B.K点对应的溶液中:c(M+)+c(MOH)=2c(A-) C.K点对应的溶液中:c(OH-)+c(MOH)-c(H+)=c(M+) D.N点水的电离程度较K点水的电离程度小 结合物质的量浓度之间的大小关系以及图像pH分析出物质的强弱.同时,确定不同条件下溶液的中含有的物质,按照盐类的水解模型,构建离子浓度的相等关系,通过整合等式得出最终结果. 解析由图可知起初0.01mol/L的HA溶液的pH=2,表明其为强酸.当MOH和HA完全反应消耗50mL的MOH,由图可知对应的pH<7,表明MOH为弱碱.由反应可知K点为等物质的量的MOH、MA混合溶液,由物料守恒可得K点对应的溶液中:c(M+)+c(MOH)=2c(A-),由电荷守恒关系可得:c(OH-)+c(A-)=c(M+)+c(H+),因pH>7,则c(OH-)>c(H+),联立可得c(OH-)+c(MOH)-c(H+) 综上所述,建模思想无论是深化学生理解,还是在提高学生解题能力上均有着积极促进的作用.教学实践中教师应将建模思想纳入教学重点,结合教学内容设计建模环节,鼓励学生做好化学模型的构建以及总结.同时,做好化学模型的应用讲解,使学生体会建模思想的重要价值,增强其学习与应用的自觉性.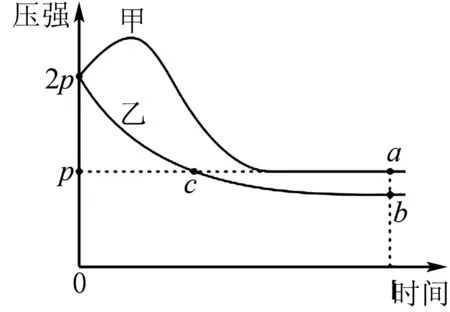
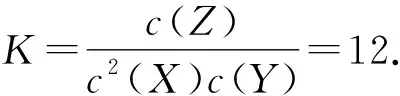
4 原电池模型及应用



5 盐类的水解模型及应用


