樟科植物花部蜜腺与性系统的系统发育分布规律初探
金晓芳,肖昌龙,侯杰希,张北红,李春江,李 凤,金志农
(1.南昌工程学院 江西省樟树繁育与开发利用工程研究中心,江西 南昌 330099;2.武汉大学 生命科学学院,湖北 武汉 430072)
很多开花植物通过蜜腺组织分泌蜜液作为报酬物来吸引动物为其传粉[1]。Delpino根据蜜腺的功能和位置将其分为花外蜜腺和花内蜜腺。花内蜜腺的来源多为未分化的花被、退化雄蕊、雄蕊以及心皮,其中退化雄蕊是最常见的形式[2]。
樟科作为核心被子植物基部类群木兰类中物种数量最多的一个科,目前全世界有约65属,3000多种[3-4]。中国有约24属,446种[5]。在中国,该科植物主要分布在热带亚热带地区,少数种属延伸到温带地区[6]。樟科的花部蜜腺在不同属、种之间呈现出多样性。樟科植物存在两种类型的花内蜜腺:退化雄蕊蜜腺(staminodial nectary)和可育雄蕊基部的蜜腺(staminal nectary)。这两种蜜腺在樟科植物雌性先熟两性花的开花过程中“分工合作”,分期吸引传粉者:当进入雌性功能期(花药散粉前),第1~3轮雄蕊会展平,暴露出第4轮的退化雄蕊蜜腺,此时退化雄蕊蜜腺会分泌花蜜,如图1(a)中黄绒润楠(MachilusgrijsiiHance)退化雄蕊蜜腺正在分泌花蜜(图1中,S1~S3分别代表第1~3轮可育雄蕊,SDN为退化雄蕊蜜腺,SN为可育雄蕊蜜腺,PI为雌蕊);当进入雄性功能期时(花药散粉后),位于第3轮雄蕊基部的可育雄蕊蜜腺分泌花蜜[7],以花粉和花蜜共同作为报酬物吸引传粉者[8-9],此时第3轮雄蕊会立起来,将退化雄蕊藏在最内轮,如图1(b)中黄绒润楠可育雄蕊蜜腺正在分泌花蜜。这种雌性先熟的开花方式在樟科植物两性花中广泛存在[7,10-13]。 樟科植物除了两性花,还存在由于败育而成的单性花,单性花又包括雌雄同株或雌雄异株[14]。两性花植物存在两种类型的蜜腺,而单性花植物一般丢失了退化雄蕊蜜腺。

图1 黄绒润楠(Machilus grijsii Hance)不同开花阶段花蜜分泌情况
到目前为止,关于樟科植物两种花部蜜腺的系统发育分布鲜有报道[15-17]。本文统计了两种蜜腺在樟科植物中的系统发育分布,并对其与性系统的关系和生态学意义进行讨论。
1 材料与方法
1.1 系统树构建
从NCBI下载已有的樟科植物完整叶绿体基因组序列,共获得24属,65种。选取腊梅科(Calycanthusfloridusvarglaucus)作为外类群(表1)。采用最大拟然法(maximum likelihood,ML)和贝叶斯法(Bayesian Inference,BI)建立系统发育树。用phylosuite软件[18]处理序列。用 MrBayes3.2.6[19]构建贝叶斯系统发育树,选择partition模型(2 parallel runs,运行长度107次),burnin值为0.25。最大似然法在PhyloSuite平台的IQTree进行[20]。并通过中国植物志等网站收集第1~4轮四蜜腺数和性系统数据。
表1 本研究所用樟科植物系统发育树植物GenBank号
续表1
1.2 两种花部蜜腺蜜量与含糖量调查
为了验证两种类型蜜腺的花蜜分泌功能是否存在差异,选择武汉植物园内种植的3种樟科两性花植物(包括樟属的阴香,楠属的紫楠和浙江楠),分别检测其花蜜量及糖浓度进行对比分析。于盛花期提前一天将花苞标记并套袋处理。第2~3d分别选取雌性功能期(退化雄蕊蜜腺分泌花蜜)和雄性功能期(可育雄蕊蜜腺分泌花蜜)的花,用内径0.1mm毛细管吸取6朵花测蜜量,10~20朵花测含糖量(折光仪型号为Eclipse 45-81)。根据前期研究经验[11],选取雌雄功能期时间段内各选2~3个时间点检测蜜量和含糖量(见表2)。
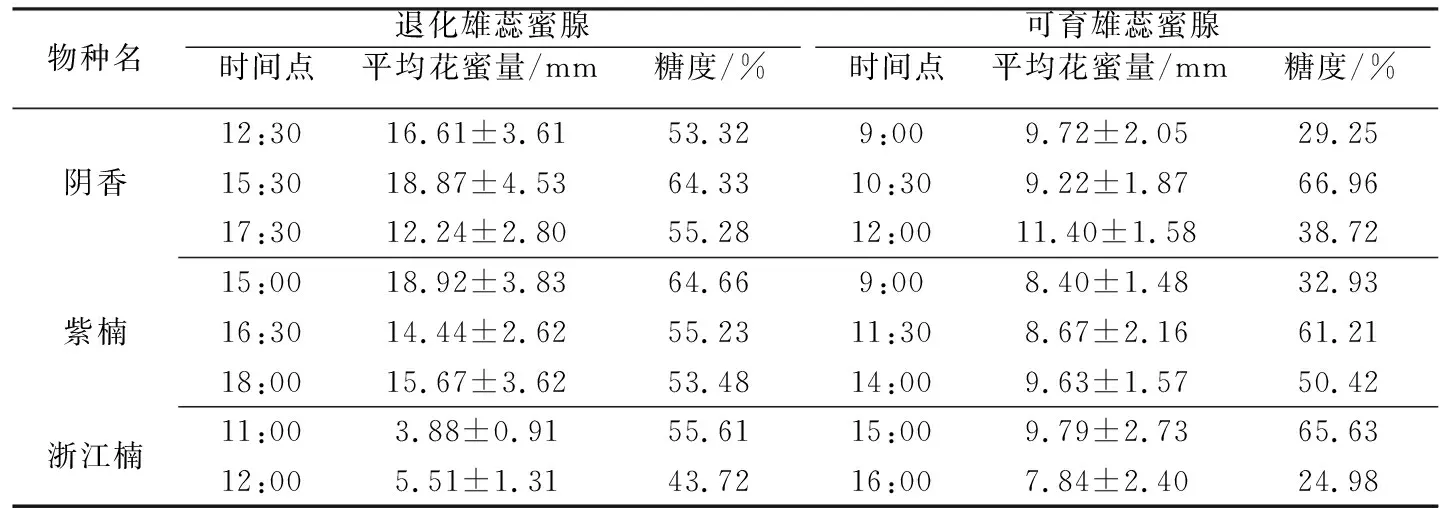
表2 樟科3种两性花植物蜜量及糖度测量
2 结果与分析
2.1 樟科系统发育树
樟科系统发育树中将樟科分为7个分支,分别是:楠属—厚壳桂属分支Belischmiedia-Cryptocarya clade(S02,ML-BS=100,BI-PP=1.00),无根藤分支Cassytha clade(S03,ML-BS=100,BI-PP=1.00),檬果樟属分支Caryodaphnosis clade(S04,ML-BS=100,BI-PP=1.00),新樟属分支Neocinnamomum clade(S05,ML-BS=100,BI-PP=1.00),润楠—鳄梨属分支Machilus-Persea clade(S06,ML-BS=100,BI-PP=1.00),樟属分支Cinnamomum clade(S07,ML-BS=100,BI-PP=1.00),月桂—新木姜子属分支Laurus-Neolitsea clade(S08,ML-BS=100,BI-PP=1.00)(图 2)。第1类群较为原始,包含琼楠属(Beilschmiedia)、厚壳桂属(Cryptocarya)、土楠属(Endiandra)、铁樟属(Eusideroxylon)、油果樟属(Syndiclis)(S02,ML-BS=100,BI-PP=1.00);第2类群更为进化,包含无根藤属(Cassytha)(S03,ML-BS=100,BI-PP=1.00);第3个类群包括檬果樟属(Caryodaphnopsis)(S04);第4个类群包括新樟属(Neocinnamomum)(S05)。在樟科的核心类群中,又分为3个分支,其中第一个分支包括第5个类群的油丹属(Alseodaphne)、润楠属(Machilus)、鳄梨属(Persea)以及楠属(Phoebe)(S06);第6个类群包括樟属(Cinnamomum)、柑樟属(Nectandra)、檫木属(Sassafras)(S07);第7个类群包括木姜子属(Litsea)、新木姜子属(Neolitsea)、拟檫木属(Parasassafras)、山胡椒属(Lindera)、月桂属(Laurus)、黄肉楠属(Actinodaphne)(S08)。
蜜腺和性系统标记在系统树上(图2)。图2中的发育树包括65个樟科植物,采用最大拟然法和贝叶斯法构建,分支上的数字为贝叶斯后验概率/最大拟然法自展值。三列花部性状分别为性系统、第4轮退化雄蕊蜜腺存在与否、第3轮可育雄蕊蜜腺存在与否(星号为性状无法确定,空心图标表示双性花和没有蜜腺)。右侧分别为:大叶新木姜子(A),山橿(B),毛桂(C),黄绒润楠(D),无根藤(E)。图2中显示两性花出现在进化树的基部,是一种比较原始的性状。单性花最早出现在蜜樟属(Nectandra)及檫木属,在山胡椒属、木姜子属及新木姜子属开始大量出现。

图2 樟科系统发育树
2.2 两种花部蜜腺蜜量与含糖量调查
阴香、紫楠和浙江楠花蜜分泌均雌性功能期显著高于雄性功能期(F1,34=6.028,P=0.019),(F1,34=12.187,P=0.009),(F1,22=4.545,P=0.044)。
3 讨论
本文利用樟科植物叶绿体基因组来构建系统发育树,再结合其花部性状特征进行系统发育分析。结果显示,樟科植物两性花和单性花有着很明显的分化界限;退化雄蕊蜜腺似乎也随着单性花的出现而在雄花中消失(如新木姜子属某些种类雄花无退化雄蕊蜜腺),而可育雄蕊蜜腺依旧保留在雄花的可育雄蕊基部,这与前期研究结果一致[3]。但是,在比较原始的土楠属中,退化雄蕊蜜腺消失,第1~2轮花药也经常退化或消失,推测其可育雄蕊基部的腺体可能同时承担了雌性阶段和雄性阶段的分泌花蜜的功能。在单性花山胡椒属、木姜子属、新木姜子属中,也有部分单性花的雄花依然存在退化雄蕊蜜腺,而这些物种并不位于在单性花出现与退化雄蕊蜜腺开始消失的系统树位置,有些甚至位于在进化树上较高的位置,因此推测这些植物的蜜腺功能很可能是在散粉期协助其他花药基部的腺体分泌花蜜。丢失退化雄蕊的类群如月桂属,往往保留可育雄蕊基部蜜腺分泌花蜜[21]。
两种蜜腺蜜量实验结果显示,在阴香、紫楠和浙江楠中,退化雄蕊蜜腺蜜量显著多于可育雄蕊蜜量,可能是退化雄蕊蜜腺是雌性功能阶段的唯一吸引传粉者的报酬,而可育雄蕊分泌花蜜是作为花粉报酬的补充。
4 结束语
随着樟科植物由两性花向单性花演化,雄花的退化雄蕊蜜腺也逐渐消失,故推测由于退化雄蕊蜜腺在两性花中的主要功能是在未散粉阶段作为报酬物吸引传粉者,而雄花已无需经历此阶段,因此退化雄蕊蜜腺也逐渐丢失花蜜分泌功能。

