不同生境中喜旱莲子草雄蕊雌化的发生及其在花序内的分布模式
张日谦,何孟莹,钱美娇,张 雪,刘依琳,宛传捷,张 震,2
(1安徽农业大学资源与环境学院,合肥 230036;2农田生态保育与污染防控安徽省重点实验室,合肥 230036)
0 引言
随着经济全球化趋势不断发展,国际交流、人口流动持续推进,为外来物种的传播创造了有利条件。由于人为引入和自然扩散等,中国生物入侵现象日益严重,已成为遭遇外来入侵生物危害最严重的国家之一[1-2]。
喜旱莲子草俗称水花生、革命草,是一种多年生宿根性杂草,可水陆两栖,广泛分布于农田、水塘中,生命力和适应性强。主要通过根、茎进行营养繁殖,繁殖力强[3-4]。由于喜旱莲子草在全球传播泛滥,对当地经济发展和生态环境造成了严重影响,是世界公认的恶性入侵植物[5]。
雄蕊雌化,指雄蕊发生突变而转化成为类似于雌蕊结构的一种现象[6]。近年来,随着学者对雄蕊雌化现象的不断探索,已经发现该现象存在于多种植物中,如辣椒、水稻、喜旱莲子草、油菜[7-10]。据前人研究推测,雄蕊雌化现象的发生可能主要由花器官间同源异型转换、外界环境影响、基因突变所引起的突变体等3种原因引起。但雄蕊雌化现象的发生是否受其他基因调控或其他外界因子影响还有待进一步的研究[11]。
陈倬[9]在1964年就对喜旱莲子草的雄蕊雌化现象进行了相关报道,该现象在喜旱莲子草中广泛存在。目前,关于喜旱莲子草的研究多集中在其形态特征、遗传特性、高度可塑性及生物、化学防治方法和开发利用等方面,而对于该入侵植物的雄蕊雌化的发生机理尚未开展深入研究[12]。本研究主要研究喜旱莲子草在不同水陆生境及同一花序内不同位置的雄蕊雌化现象,以期补充该入侵植物的入侵理论,从而为其综合防治提供理论依据。
1 材料与方法
1.1 研究材料
喜旱莲子草于2019年10月中上旬取自安徽农业大学校园内,包括农田(旱生环境)、池塘边(湿生环境)、池塘(水生环境)等3种生境。于不同生境喜旱莲子草中各随机挑选出20个花序,共60个花序作为研究材料。
1.2 研究方法
1.2.1 样品的保存 在长势良好的旱生、半旱生、水生喜旱莲子草植株中,取若干花带回实验室,将其根据取样地点及生境标号分别放入FAA固定液中直接保存。
1.2.2 花序位置的划分 将喜旱莲子草花序内花的位置从底部到顶部,分为底部花、中部花和顶部花3种,根据(实际花位置-1)/(总花数-1)计算相对花位置,均等分出花序中的底部花、中部花和顶部花,以量化喜旱莲子草花在花序内的分布模式[13]。
1.2.3 解剖及观测 使用解剖镊和解剖针对花序内花进行解剖,轻轻剥除花被,避免雌雄蕊被一起剥离,用解剖针在雌雄蕊基部将其拨出,保证其具有较好的完整性,将其置于解剖镜下观察。根据观察到的不同程度的雄蕊雌化现象,统计3种生境中喜旱莲子草花序内底部、中部和顶部花中各种形态雄蕊的种类和数量;根据每朵花中完全雌化雄蕊的数量,统计3种生境中喜旱莲子草花序内底部、中部和顶部花中发生各种雄蕊雌化频率花的种类和数量。
1.3 指标计算
共设定3种生境条件,每种生境有20个重复,测定每朵花中各种类型雄蕊的数量,按照其雄蕊雌化程度,计算3种生境及3种花序位置上每朵花中雄蕊的平均雌化程度,即雄蕊雌化程度(D);计算3种生境及3种花序位置上每朵花中发生完全雌化雄蕊出现的频率,即雄蕊雌化频率(F)。计算如式(1)~(2)。

式(1)中,S为雄蕊种数,di为雌化程度i的雄蕊的雌化程度,Ni为雌化程度i的雄蕊的个数,N为各种雄蕊的总数。式(2)中,S为雄蕊种数,fi为雌化频率i的花的雌化频率,Nj为雌化程度j的雄蕊的个数,N为各种花的总数。
1.4 数据处理
采用Excel 2019软件进行数据统计分析,SPSS 23.0进行单因素方差分析。
2 结果与分析
2.1 喜旱莲子草的雄蕊雌化现象
早在20世纪60年代,陈倬[9]就指出喜旱莲子草雄蕊雌化具有渐进的过渡现象,除正常的具药雄蕊和已经雌化的雄蕊,还有多种未完全转化仍处于过渡阶段的雄蕊。根据本次观察得到的结果,将不同雄蕊雌化程度区分为7种雄蕊雌化类型,分别是正常具药雄蕊(类型1);雄蕊花药顶部衍生出一柱头(类型2);花药消失,顶部仅有一柱头(类型3);雄蕊花丝开始膨大,子房和子房柄逐渐形成(类型4);雄蕊花丝膨大为近似子房大小,花柱较细,雌蕊形成(类型5);雌蕊完全形成,花柱粗细较正常(类型6);雌蕊完全形成,花柱较粗,且可观察到分支(类型7)。
正常喜旱莲子草花中具有5枚雄蕊和1枚雌蕊,野外生长的喜旱莲子草雄蕊雌化现象较普遍,其雄蕊经雌化会转变为不育雌蕊[14]。观察结果显示,喜旱莲子草花具有多态现象,根据花中雌化雄蕊的数目,可以将观察结果区分为6种不同雌化频率,如表1。

表1 喜旱莲子草不同花类型的雄蕊雌化频率
调查表明喜旱莲子草大部分雄蕊发生了雌化现象(图1),且主要以完全雌化的雄蕊为主,其中处于雄蕊雌化过渡阶段的种类虽多,但数量较少。喜旱莲子草的花也大部分发生了雌化现象,正常两性花数量较少,且大部分花中有多枚雌蕊发生了完全雌化,甚至5枚雄蕊完全发生了雌化现象。
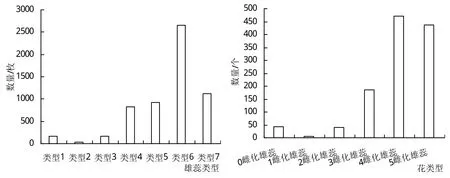
图1 喜旱莲子草各种类型花及雄蕊的数量
2.2 不同生境及花序位置中喜旱莲子草的雄蕊雌化程度
通过对旱生、湿生、水生3种生境中各种雄蕊类型进行多度统计,旱生和湿生生境中均可观察到各种雄蕊类型,水生生境中除类型1未观察到,其他类型均可观察到(表2)。
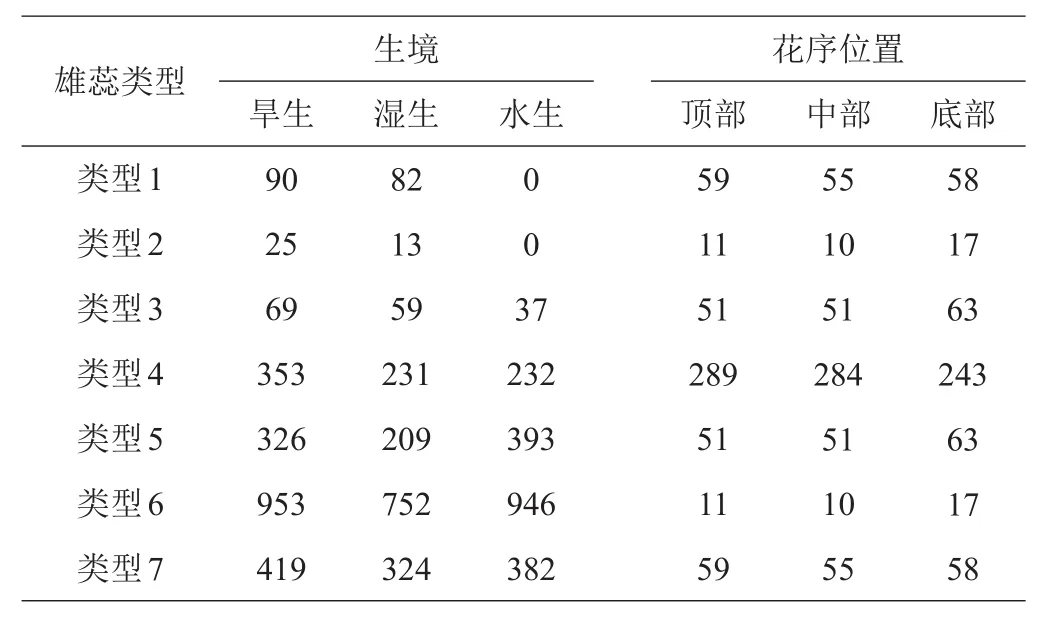
表2 3种生境及花序位置中各种雄蕊类型的多度分析
根据喜旱莲子草雄蕊雌化程度的差异,将7种雄蕊类型按照雄蕊雌化程度由低到高划分为6种程度,其中类型1~5分别对应于程度1~5,类型6~7都已完全雌化,只在花柱粗细上存在差异,因此将类型6~7统一归于程度6。计算每朵花的平均雄蕊雌化程度,得到表3。
表3 表明,不同生境中喜旱莲子草的雄蕊雌化程度差异性显著,其中水生生境中最高,为5.5032,旱生生境中最低为5.2066,水生生境显著高于旱生生境中喜旱莲子草一朵花的雄蕊雌化程度,水生生境和湿生生境间、旱生与湿生生境间喜旱莲子草一朵花的雄蕊雌化程度虽然差异不显著,但是从旱生到湿生到水生生境中,喜旱莲子草花的雄蕊雌化程度有上升趋势。在不同花序位置中,喜旱莲子草的雄蕊雌化程度差异性不显著,其中花序顶部雄蕊雌化程度最高(5.3268),花序底部与花序顶部雄蕊雌化程度相近(5.3194),花序中部雄蕊雌化程度略低(5.3039)。

表3 3种生境及花序位置中的雄蕊雌化程度
图2 表明,3种生境中,水生生境中喜旱莲子草完全发生雌化的雄蕊(类型6、7)所占比例最高,为66.74%,其次是湿生生境(64.82%),旱生生境中最低(61.53%)。且水生生境中无正常具药雄蕊,即雄蕊全部发生了一定程度的雌化,而湿生生境及旱生生境中仍有少量具药雄蕊,分别占比为4.94%和4.04%。在不同花序位置中,大部分雄蕊已完全发生雌化,仅有少量(近3%)的具药雄蕊,花序顶部、中部及底部各类型雄蕊所占比例相近。
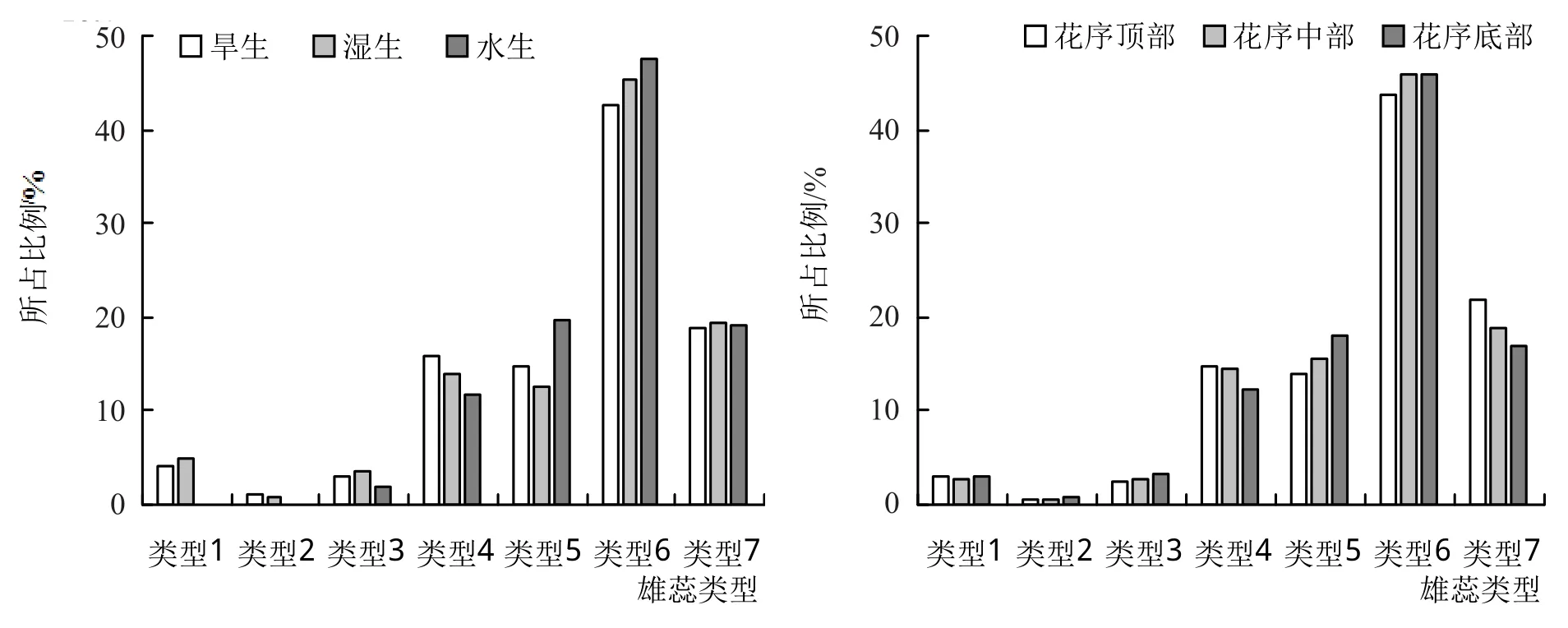
图2 3种生境及花序位置中各种雄蕊类型数量对比
2.3 不同生境及花序位置中喜旱莲子草的雄蕊雌化频率
喜旱莲子草雄蕊雌化过程中,除正常具药雌蕊,还产生了一部分轻微雌化而雌蕊未形成的过渡类型(即类型2、3、4),其未完全转化为雌蕊,雌化特征不明显,因此不将其统计为雌化雄蕊,故仅将已有雌蕊形成的雄蕊(类型5、6、7)统计为雌化雄蕊,得到表4。
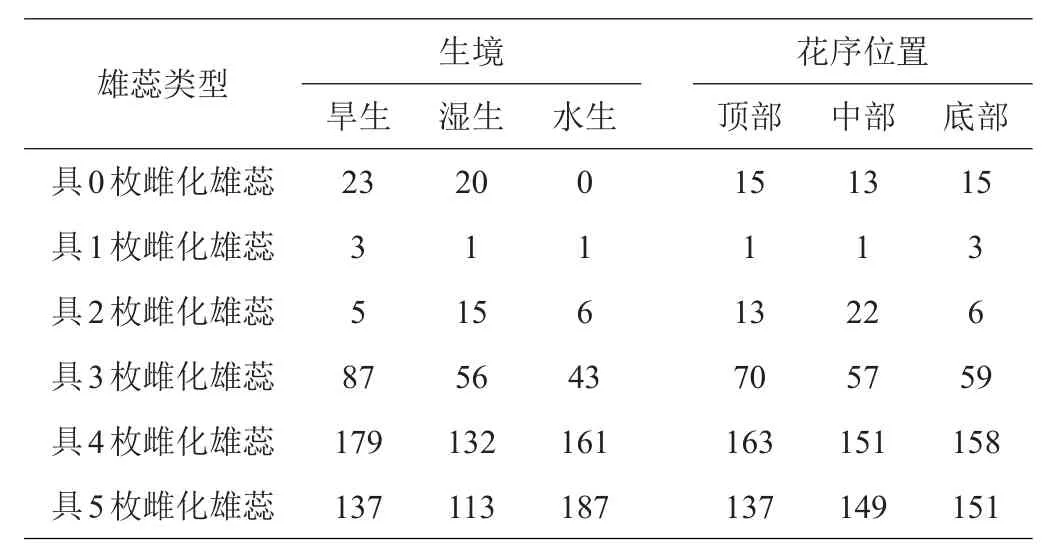
表4 3种生境及花序位置中各种花类型的多度分析
根据一朵花中雌化雄蕊的数量将各种类型花划分为6种类型,分别为具0枚雌化雄蕊(类型1)、具1枚雌化雄蕊(类型2)、具2枚雌化雄蕊(类型3)、具3枚雌化雄蕊(类型4)、具4枚雌化雄蕊(类型5)、具5枚雌化雄蕊(类型6)。统计各种类型花所占比例,即同一生境(或同一位置)中同一类型个体数占该生境(或位置)中各类型个体总数的比例,如图3。
图3 表明,3种生境中的喜旱莲子草花类型6(完全雌化花),水生生境所占比例最高,为46.98%;湿生生境所占比例略高于旱生生境,分别为33.53%和30.51%。另外,类型1(正常两性花)在水生生境中未被发现,而旱生生境和湿生生境中分别占到了5.12%和5.93%。在不同的花序位置中,各类型花在花序的顶部、中部和底部所占比例总体较为均匀,以类型5和类型6居多。
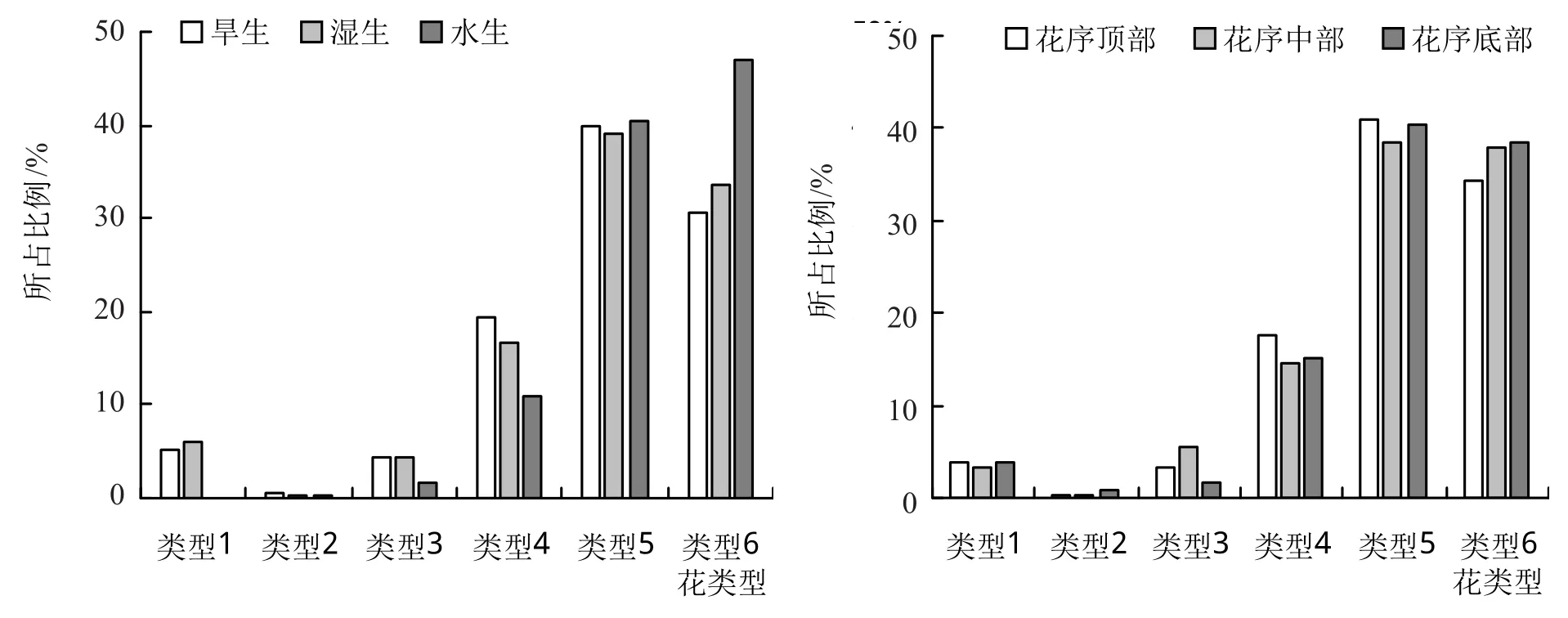
图3 3种生境及花序位置中各种花类型数量对比
表5 表明,3种生境中喜旱莲子草的雄蕊雌化频率差异性显著,其中水生生境中最高,为86.75%;旱生生境中最低,为76.17%。3种生境中喜旱莲子草一朵花的雄蕊雌化频率为水生>湿生>旱生。水生生境中喜旱莲子草一朵花的雄蕊雌化频率显著高于旱生生境和湿生生境;旱生生境与湿生生境间喜旱莲子草一朵花的雄蕊雌化频率虽然差异不显著,但呈上升趋势。不同花序位置间喜旱莲子草一朵花的雄蕊雌化频率差异性不显著,其中花序底部最高(80.96%),花序中部居中(79.52%),花序底部最低(79.56%)。花序中部与花序顶部雄蕊雌化频率相近。

表5 3种生境及花序位置中的雄蕊雌化频率 %
3 结论与讨论
本研究发现喜旱莲子草的雄蕊雌化现象十分普遍,与陈倬[9]的研究一致,且在雄蕊水平和花水平上均表现出较高的雌化程度,而在雄蕊雌化过程中未完全雌化的个体可能主要是未满足雌化所需的生理条件。
前人研究报道,喜旱莲子草的雌化雄蕊虽然在形态上与雌蕊相近,但其子房内仅为一空腔、无胚珠,因此这种转化并非一种完全的转化,造成的雄蕊败育意味着有性生殖能力的衰退[15]。喜旱莲子草的遗传多样性在中国极低,已有研究证实入侵中国的喜旱莲子草基因型来源于同一克隆个体,其大量克隆繁殖可能是造成喜旱莲子草在中国扩散的原因[16-17]。虽然喜旱莲子草无性繁殖较为普遍,但是也有关于其有性繁殖产生种子的报道,有研究表明喜旱莲子草产生种子的比例有6.5%[18]。这种开花多但种子少的现象存在于多种植物中,前人报道不结实的花具有潜在的生殖功能。因此喜旱莲子草两性花可能也具有潜在的生殖功能[19-20]。
本研究中,所取的喜旱莲子草均来源于安徽农业大学校内,尽量避免了除生境类型以外其他因素的干扰。研究结果表明,喜旱莲子草的雄蕊雌化程度及雄蕊雌化频率在水生、湿生、旱生3种生境中有显著差异,且从水生到湿生到旱生生境中,喜旱莲子草的雄蕊雌化程度及雄蕊雌化频率不断下降,说明喜旱莲子草的有性生殖能力的退化,可能与喜旱莲子草在不同生境中对水分的耐受性有关。水生生境较陆生生境喜旱莲子草的形态,其茎秆粗、空腔大、节间长、总叶面积大,因此水生生境中的植株具有更大的个体,已有研究表明,植物采取小的植物个体倾向于雄性,大的个体植物倾向于雌性的性分配策略,与本研究中水生生境更有利于雄蕊雌化现象的发生,促进喜旱莲子草进行无性繁殖,降低其有性生殖能力的结果相符[21-23]。根茎是喜旱莲子草重要的繁殖器官,对适应缺氧且水淹的水生和湿生生境极其重要,因此在这类环境中喜旱莲子草更倾向于选择无性繁殖策略[24-25]。因此,喜旱莲子草的雄蕊雌化现象更趋向于在水分充足的环境中发生。
世界上大多数开花植物是雌雄同体[26],性分配理论通过对有性繁殖中雌雄功能的资源合理分配,选择出最佳的分配方式[27]。花序内性器官数量及质量的变化通常都被认为是性别表达的改变,一种常见的变化模式表明基向开花植物对花序基部的资源投资趋于雄性,花序顶部趋于雌性,而顶向开花植物与之相反,这种性分配模式是由花序内位置效应引起的[28-30]。喜旱莲子草是一种雌雄同体的两性花植物[9],本研究对喜旱莲子草不同花序位置雄蕊雌化现象发生的研究结果表明,喜旱莲子草花序从下至上的雄蕊雌化频率和程度均无差异显著性,即顶部与基部并无性别偏向性,与喜旱莲草主要通过无性繁殖来扩大种群,其虽具有两性器官但有性繁殖现象却极少见的研究结果相一致。张秀艳曾报道该植物的有性繁殖现象,但有性生殖并非其繁殖和扩散的主要方式,故不符合上述变化模式[17,18]。
综上所述,本研究通过开展探究不同生境及不同花序位置上雄蕊雌化现象的发生,揭示了喜旱莲子草的雄蕊雌化现象普遍存在,该现象在雄蕊和花的水平上雄蕊雌化程度均较高。结果表明喜旱莲子草更倾向于在水生生境中发生雄蕊雌化现象,造成有性繁殖的退化,促进其无性繁殖扩大种群,增强其在入侵地的入侵能力。此外,还发现了喜旱莲子草在不同花序位置上雄蕊雌化现象的发生并无显著差异,表明该现象在花序内的发生呈相对均匀的分布模式,不同花序位置上并无性别偏向性,不符合有性繁殖资源分配特征,与其进入中国后主要通过无性繁殖增强其入侵能力有关。本研究补充了喜旱莲子草的入侵理论,为该入侵植物的综合防治提供了理论依据。但本研究所使用的喜旱莲子草取自10月中上旬(花期末),而喜旱莲子草花期为5—10月。喜旱莲子草的雄蕊雌化发生是否会随开花时间分异还有待进一步研究。为深入研究喜旱莲子草雄蕊雌化现象的发生,还需通过室内模拟或野外定期采样等方法研究其雄蕊雌化现象的发生与花期的关系。另外为进一步确定影响喜旱莲子草雄蕊雌化现象发生的环境因子,还需要针对水分等单一因子对该现象发生所产生的影响开展研究,揭示喜旱莲子草雄蕊雌化现象的发生与环境因子的相互关系。
——植物学教材质疑(六)

