结直肠癌肝转移瘤影像特征与病理关系及预后评价
刘媛媛,杨 锐,宋奇科,石 喻
(中国医科大学附属盛京医院放射科,辽宁 沈阳 110004)
结直肠癌(Colorectal cancer,CRC)是仅次于肺癌、胃癌和肝癌的第四大常见癌症死亡原因,肝脏是大约30%患者的最初转移部位[1-4]。组织病理生长方式(Histopathological growth patterns,HGP)表 现 为肝脏肿瘤细胞和邻近正常肝实质之间的独特界面,一般包含3 种类型,即促结缔组织增生型、推挤型和替换型[5-6]。目前国内外尚未明确报道结直肠肝转移瘤(CRCLM)影像特征与HGP 之间联系。本文研究目的为分析CRCLM 影像特征与HGP 关系并评估二者对疾病预后的价值。
1 材料与方法
1.1 一般资料
回顾性收集我院2008 年1 月—2013 年12 月首次肝转移切除术后经病理证实(冰冻活检)为CRCLM 的67 例患者,其中51 例包含1 例转移灶,15 例包含2 例转移灶,1 例包含3 例转移灶,共计84 个病灶。男43 例,年龄32~81 岁,平均(61.5±10.5)岁;女24 例,年龄31~77 岁,平均(61.6±10.2)岁。67 例CRCLM 患者术前均未行新辅助化疗,术后常规推荐辅助化疗。总生存时间(OS)为从肝脏术后到因任何原因死亡或末次随访的时间。
对67 例共计84 个病灶的临床基本信息、影像特征及HGP 进行回顾性分析。纳入标准:①术前接受64 排以上肝脏三期增强CT 扫描检查;②术后肿瘤病理边缘信息完整;③术后病理证实为CRCLM;④临床资料完整。排除标准:①术前未接受肝脏增强CT 扫描检查;②术后病理未包含肿瘤组织;③术后病理证实为CRCLM 以外其他肿瘤;④临床资料不完整。
1.2 仪器与方法
应用Siemens Sensation 64 排多螺旋CT 对CRCLM 患者进行标准肝脏平扫及三期增强扫描,扫描包括3 个时期:对比剂注射前平扫期以及对比剂注射后25~30 s 动脉期、50~60 s 门静脉期、120~180 s延迟期。所有CT 图像采集都具有高分辨率(层厚1.0~3.0 mm)。采用非离子型碘对比剂350 mg/mL,注射速度2.5 mL/s,剂量80~100 mL,从肘静脉由高压注射器注入。
1.3 影像特征分析
由2 名至少具有5 年以上腹部影像阅片经验的影像科医生盲法分析CRCLM 影像特征,两名影像科医生通过协商一致的方式解决评分差异,为每个病变产生一个单一的评分。
1.4 病理结果分析
由2 名至少具有10 年以上病理诊断经验的病理科医生,通过光学显微镜同时盲法分析经HE 染色的CRCLM 病理组织切片,对肿瘤和邻近肝组织之间的整个界面进行HGP 类型的评估,两名病理科医生通过协商一致的方式解决评分差异,为每个病变产生一个单一的评分。
CRCLM 病灶HGP 一般分3 种类型:①促结缔组织增生型(dHGP)表现为肿瘤细胞与正常肝实质之间存在促纤维结缔组织间质。②推挤型(pHGP)表现为肿瘤细胞压迫但未浸润邻近肝实质。③替代型(rHGP)表现为肿瘤细胞浸润邻近肝实质[5]。CRCLM患者一般被分为两组:①dHGP 组为某患者所有病理组织切片均为纯(100%)dHGP;②非dHGP 组为某患者所有病理组织切片包含rHGP 或pHGP 任意一种[8-9]。
1.5 统计学分析
采用IBM SPSS Statistics 25.0 统计软件包进行数据分析。正态分布计量资料用表示;非正态分布计量资料用中位数(上下四分位数)表示;计数资料用频数表示。①CRCLM 影像特征与病灶HGP关系采用Logistics 回归模型进行单因素与多因素分析:通过单因素分析将其中差异具有统计学意义(P<0.05)的自变量纳入Logistics 回归模型中进行多因素分析;②CRCLM 影像特征及病灶HGP 与患者OS 关系采用Cox 风险比例模型进行单因素与多因素分析,通过单因素分析将其中差异具有统计学意义(P<0.05)的自变量纳入Cox 风险比例模型中进行多因素分析。总生存率采用Kaplan-Meier 法分析,P<0.05 具有统计学意义。
2 结果
2.1 患者临床及影像病例特征
本文主要研究结直肠癌首次肝转移瘤患者。将67 例CRCLM 患者按照HGP 类型分为两组,dHGP组(32/67,47.8%)及非dHGP 组(35/67,52.2%)。男43 例,女24 例,年龄31~81 岁,平均(61.5±10.4)岁。肝转移瘤直径(最长径)0.7~5.6 cm;只有1 处肝转移瘤患者51 例,2 处肝转移瘤患者15 例,3 处肝转移瘤患者1 例;环形强化患者37 例;肝转移瘤边缘无强化者31 例,动脉期边缘明显强化者8 例,静脉期边缘明显强化者28 例;脂肪肝6 例;腹水4 例。其中环形强化及强化时期具有统计学意义(P<0.05)。
2.2 患者临床、影像特征与病灶HGP 关系
采用Logistics 回归模型对CRCLM 临床、影像特征与病灶HGP 关系进行单因素与多因素分析,结果显示肿瘤环形强化及强化时期是CRCLM 病灶HGP 的独立影响因素,OR 值分别为(16.38(95%CI:1.022,262.5),P=0.048),(4.345(95%CI:1.087,17.36),P=0.038);而年龄、性别、肿瘤直径及数量无统计学意义(P>0.05)(表1)。
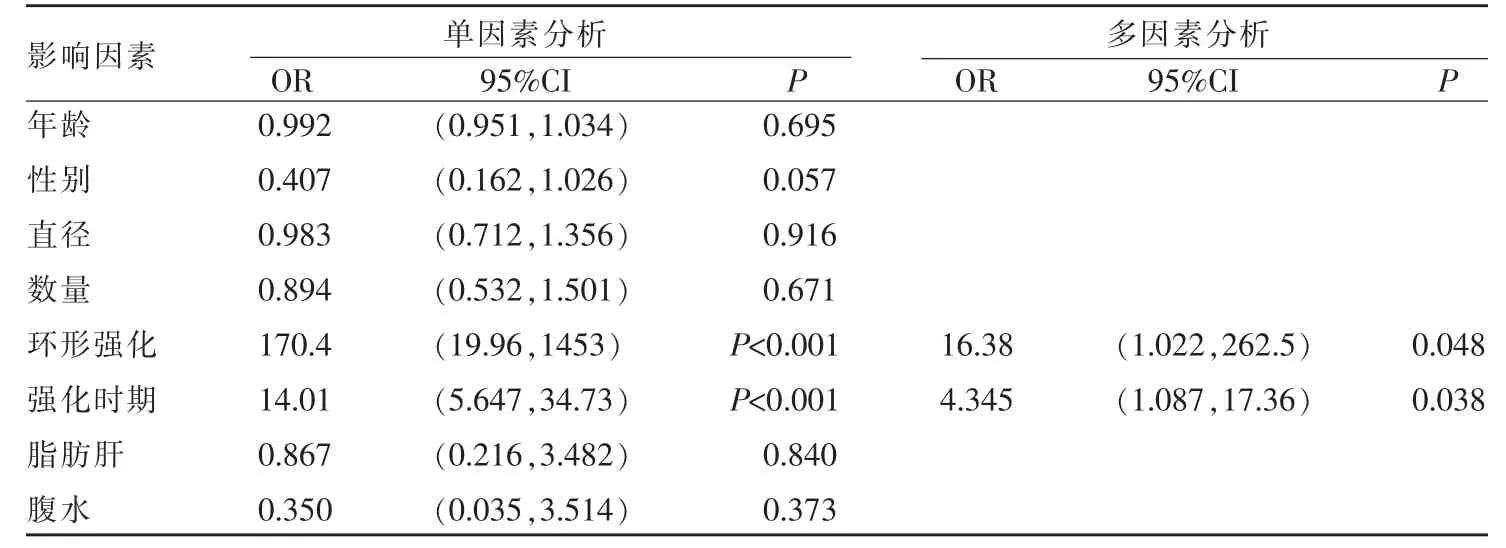
表1 CRCLM 患者影像特征与HGP 的关系单因素与多因素分析结果
CRCLM 病灶HGP 与对应增强CT 强化方式见图1。图1a,1d,1g 为dHGP,肿瘤动脉期及静脉期均为环形强化;图1b,1e,1h 为pHGP,肿瘤动脉期边缘弱强化,静脉期无明显强化;图1c,1f,1i 为rHGP,肿瘤动脉期及静脉期边缘均无强化。
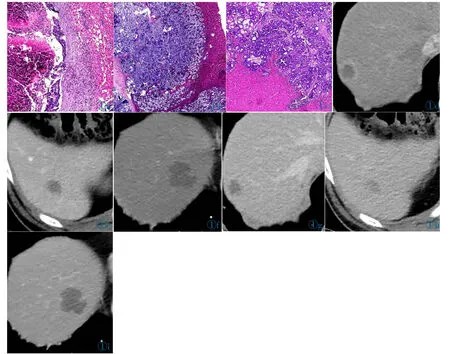
图1 HE 染色法。T 表示肿瘤组织;N 表示正常肝组织;F 表示纤维结缔组织。图1a~1c 分别为dHGP,pHGP,rHGP。图1d,1g:肝转移瘤于动脉期及静脉期均呈环形强化。图1e,1h:肝转移瘤于动脉期边缘呈弱强化,静脉期无明显强化;图1f,1i:肝转移瘤于动脉期及静脉期边缘均无强化。Figure 1.HE staining.T for tumor tissue;N for normal liver tissue;F for fibrous connective tissue.Figure 1a~1c: Desmoplastic HGP;pushing HGP;replacement HGP.Figure 1d,1g: Hepatic metastases show rim enhancement on both arterial phase (AP) and portal venous phase (PVP).Figure 1e,1h: Hepatic metastases show weak rim enhancement on AP,but no obvious enhancement on PVP.Figure 1f,1i: Hepatic metastases show no enhancement at the edge of AP and PVP.
2.3 病灶影像特征、HGP 与总生存时间关系
CRCLM 影像特征、病灶HGP 与患者OS 关系采用Cox 风险比例模型进行单因素与多因素分析,单因素生存分析结果显示环形强化、强化时期和HGP 是CRCLM 患者总生存时间的影响因素(P 均<0.05);将其中具有统计学意义的变量纳入Cox 风险比例模型进行多因素分析,结果显示环形强化和HGP 是CRCLM 患者OS 的独立影响因素,HR 值分别为(1.976(95%CI:0.461,1.178),P=0.013),(0.310(95%CI:0.132,0.725),P=0.007)(表2)。
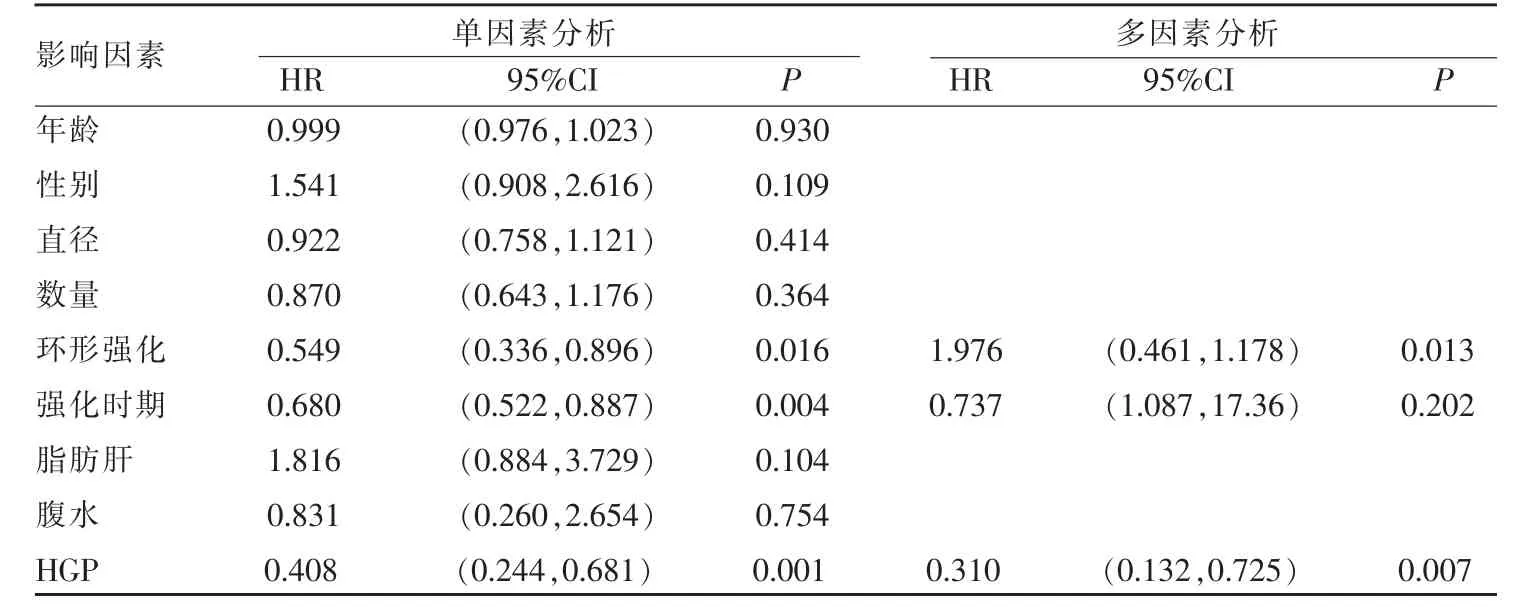
表2 影响CRCLM 患者总生存时间的单因素与多因素分析结果
67 例CRCLM 患者至随访结束时共43 例死亡,总生存时间为59(8~168)月;1 年、3 年及5 年生存率分别为96.4%、73.8%和38.1%。绘制CRCLM 环形强化、HGP 与OS Kaplan-Meier 生存曲线,两变量组间总生存率均具有统计学意义(P<0.05):有环形强化者生存时间明显长于无环形强化者(图2a);dHGP组生存时间明显长于非dHGP 组(图2b)。

图2 CRCLM 患者生存曲线。图2a:以环形强化分组;图2b:以dHGP 分组。Figure 2.Survival curve of CRCLM patients.Fgirue 2a: Group with ring enhancement.Figure 2b: Group with dHGP.
3 讨论
根据本研究结果可以得知:①CRCLM 病灶在肝脏三期增强CT 扫描成像中环形强化、强化时期是HGP 的独立影响因素;②CRCLM 病灶环形强化及HGP 是67 例患者者OS 的独立影响因素,病灶强化方式是环形强化、HGP 类型为dHGP 组患者5 年生存率分别为49.2%,49.6%,OS 明显长于无环形强化及非dHGP 组患者。
三期增强CT 是诊断肝脏疾病的最常见影像诊断方法[10],病灶强化方式与肿瘤周边血供及恶性程度有关。Semelka 等[11]研究显示在肝转移瘤中,至少有瘤内和瘤周两种类型血流动力学改变。肝转移瘤动脉期一过性强化主要原因是肿瘤压迫其周围的肝实质、门静脉及肝静脉,从而相应区域动脉-门静脉交通或动脉-门静脉分流增加所致;而动、静脉期持续性强化与肿瘤周边血管多少有关。Kambadakone等[12]研究表明dHGP 和pHGP 肿瘤边缘的血管是由萌发的新生血管形成的,周围常伴有淋巴细胞浸润;而rHGP 肿瘤则依赖周围正常肝窦血管供血。上述研究为CRCLM 强化方式是HGP 的独立影响因素提供了理论支持。
在CRCLM 影像特征与HGP 关系研究中,国内尚未检索到相关研究,国外仅Semelka 等[11]研究表明在早期增强MR 图像上,病灶周围肝实质强化的厚度与相应病理边缘厚度的增加和边缘细胞改变的增加呈显著正相关。但该研究入组患者仅为7 例,研究结果具有一定的局限性。
在HGP 预测CRCLM 患者预后研究中,van Dam 等[5]的研究表明dHGP 组OS 明显高于rHGP 或pHGP。Latacz 等[6]结果显示对于CRCLM 患者dHGP是良好的预后标志,而rHGP 则是负面的预后因素。张银丽等[13]提出的dHGP 患者的3 年无进展生存期明显优于rHGP 患者,差异具有统计学意义,HGP 是CRCLM 预后的独立影响因素。上述研究结果均与本研究结论基本相近。
Terayama 等[14]的研究表明49%患者以dHGP 为主,47%患者以rHGP 为主,3%患者以pHGP 为主,其中dHGP 占比略低于本研究,主要原因可能是与入组样本量有关,该研究样本量仅29 例,而本研究样本量为84 例,样本量远大于该研究。然而Liang等[15]提出HGP 对于预后的影响可能来自其他原因:首先,dHGP 中厚厚的促结缔组织增生环可能是肿瘤扩张的机械屏障,从而导致相对较好的预后。其次,rHGP 中预先存在的血管系统的共同选择比dHGP 中的血管生成过程更有效,更适合肿瘤的生长,因为这种血供显示出比dHGP 中更少的缺氧和血管渗漏。
本项研究主要的局限性:①本项研究为回顾性研究,样本量较少,需要进一步扩大样本量;②本研究通过具有5 年临床经验的影像科医生及10 年病理科医生对样本进行观察,具有一定的主观性;③由于国内外对本项研究较少,因此缺乏相关研究的文献支持。
综上所述,CRCLM 肝脏三期增强CT 环形强化及强化时期是HGP 的独立影响因素;CRCLM 环形强化、HGP 是患者OS 的独立影响因素。未来通过扩大样本量、邀请更多影像科及病理科医生共同参与,可获得更具指导意义的影像数据,这对于临床合理选择治疗策略以及患者预后具有一定的指导意义。

