亚甲基蓝类似物抗谷氨酸诱导HT22细胞氧化损伤及其机制
陈紫微,陈秋荷,蔡瑜,侯姗姗,刘福和
1.浙江药科职业大学 药学院,浙江 宁波 315000;2.广州中医药大学 中药学院,广东 广州 510006
氧化应激(oxidative stress, OS)是指机体内产生的活性氧(reactive oxygen species, ROS)与机体抗氧化防御功能失衡。机体内过多的ROS通过氧化损伤多种重要的生物分子如脂质、DNA和蛋白质,进一步损害中枢神经系统功能[1]。目前研究认为多数老年相关的慢性疾病,如阿尔茨海默病 (Alzheimer’s disease, AD)、帕金森病(Parkinson’s disease, PD)、亨廷顿病、肌萎缩性侧索硬化症、糖尿病、心血管病等都与机体内氧化应激损伤直接相关[2-3]。
亚甲基蓝(methylene blue, MB)具有广泛的生物活性、良好的药代动力学性质及较低的毒性,被广泛应用于医学领域。目前,MB主要用于高铁血红蛋白血症、疟疾、环磷酰胺神经毒性等疾病的治 疗[4]。MB类似物是一类与MB具有相似化学结构的化合物,基于广泛的研究发现:MB类似物与MB相似,具有广泛的生物活性,包括抗菌作用、抑制单胺氧化酶活性产生抗抑郁作用、抗氧化损伤作用等[4-8]。然而,目前关于MB结构类似物的抗氧化损伤及其机制研究鲜有报道,深入研究MB类似物的作用及其机制,并对其进行结构相关性分析,对该类相关药物的研发、应用具有重要意义。本研究筛选出4种与MB结构类似的化合物:2-氯吩噻嗪(2-chlorophenothiazine,2-C)、天青A(azure A, A-A)、天青B(azure B, A-B)、中性红(neutral red, NR),见图1。通过毒性分析、抗氧化活性分析及机制研究,阐明以上4种化合物抗谷氨酸(glutamate, Glu)诱导的HT22细胞毒性作用及机制,并进一步分析化合物结构与活性的关系。
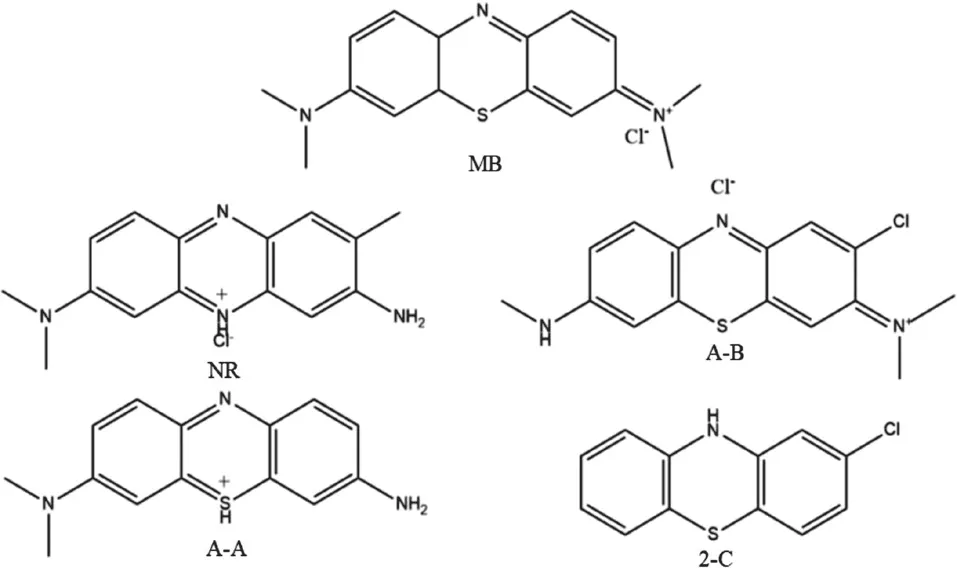
图1 MB、NR、A-B、A-A及2-C的化学结构
肌细胞增强因子2(myocyte enhancer factor 2, MEF2)在机体生理和病理过程中发挥着重要作用。有研究表明,它们还与哺乳动物中枢神经系统的神经元存活、发育、分化和神经元可塑性密切相关[9]。 MEF2D是MEF2转录因子蛋白家族的成员,在调节神经系统的发育和功能方面发挥着关键作用[10]。SALMA等[11]研究发现抑制MEF2D活性可引起胚胎海马神经元的凋亡。此外,研究发现OS可通过破坏MEF2D功能,参与多种神经退行性疾病的发生发 展[12-13],如GAO等[14]研究表明:OS可通过氧化MEF2D使其失活,进一步诱导DA神经元死亡。因此,研究认为MEF2D可能成为抗OS损伤的重要作用靶点。
1 材料和方法
1.1 材料
1.1.1 细胞:本研究所使用的细胞株为HT22细胞,来源于中国科学院典型培养物保藏委员会细胞库。
1.1.2 试剂:MB、2-C、A-B、A-A、NR购买于上海阿拉丁生化科技股份有限公司;胎牛血清,DMEM干粉由购自美国Gibco公司;H2DCF-DA、DMSO、Glu、MTT、胰蛋白酶购自美国Sigma公司;乳酸脱氢酶(lactate dehydrogenase, LDH)检测试剂盒购买于南京建成生物科技有限公司。T-糖原合酶激酶3β(glycogen synthase kinase, GSK3β)、pSer9-GSK3β、pSer473-Akt、NADH脱氢酶6(NADH dehydrogenase, ND6)、TAkt一抗购自美国Santa Cruz公司(稀释:1:500),MEF2D一抗购自美国BD Biosciences公司(稀释:1:5 000),β-actin一抗购自美国Sigma-Aldrich公司(稀释:1:10 000);山羊抗兔二抗购自美国Santa Cruz公司(稀释:1:1 000),兔抗鼠二抗购自美国Promega公司(稀释:1:10 000)。其他生化试剂均为进口分装或国产分析纯。
1.1.3 仪器:恒温震荡箱(SHELLAB,美国),滤器(0.22 μm,Millipore,德国),多功能酶标仪工作站(Floxo,美国),细胞培养箱(Themo-fisher,美国),生物净化工作台(苏州净化设备有限公司),倒置显微镜(重庆光学仪器厂),台式低温高速离心机(Eppendorf,德国),-80 ℃超低温冰箱(Sanyo,日本),光学显微镜(Olympus,日本),酶标仪(BioTek,美国),垂直板蛋白电泳仪、电转移(BioRad,美国),发光分子生物成影仪(Image Quant LAS 4000 mini,美国)。
1.2 方法
1.2.1 HT22细胞培养:从液氮罐中取出HT22细胞,迅速放置于37 ℃水浴锅内复苏,将细胞液转移至15 mL离心管中,并加入3 mL 10%胎牛血清的高糖DMEM培养基,混匀,随后将离心管放入离心机 1 000 r/min离心5 min,离心后用移液枪小心吸去上层培养基,加入3 mL新鲜培养基,混匀,转移至中皿,放置于37 ℃、5% CO2细胞培养箱培养。当细胞密度达到90%时传代。
1.2.2 建立细胞模型:HT22细胞是一种永生化的小鼠海马神经元细胞系,其细胞缺少Glu受体[15],因此该细胞暴露在高浓度Glu下能够产生明显的OS损伤。该模型是研究OS的一种经典模型。通过前期实验研究和相关文献检索,采用2 mmol/L的Glu处理HT22细胞24 h,造成氧化损伤细胞模型。
1.2.3 MTT法检测化合物对HT22细胞毒性:当HT22细胞处于对数生长期时进行实验,使用胰酶将细胞消化,离心,弃去旧培养基,加入适量新培养基,调整细胞密度,吸取100 μL细胞液于96孔板中使细胞密度达到1×104/孔。培养24 h弃去旧培养基加入各浓度化合物100 μL,使各化合物浓度分别为 1 μmol/L、3 μmol/L、10 μmol/L,以加DMSO为对照组(CT组)。24 h后,加入10 μL MTT试剂,置于孵箱中孵育2 h;吸去上清液,每孔加入DMSO 100 μL, 置于孵箱,孵育15 min。在多功能酶标仪测定各个孔在570 nm处的吸光度。细胞存活率计算公式: (OD样品-OD空白)/(OD对照-OD空白)×100%。化合物半数致死量(median lethal dose, LD50)检测时各个化合物浓度分别为0.3 μmol/L、1 μmol/L、 3 μmol/L、10 μmol/L、30 μmol/L、100 μmol/L、300 μmol/L、1 mmol/L;以含相同浓度DMSO为对照组,其余操作与MTT检测相同。
1.2.4 MTT法检测化合物对Glu诱导HT22细胞损伤的保护作用:当HT22细胞处于对数生长期时进行实验,使用胰酶将细胞消化、离心,弃去旧培养基,加入适量新培养基,调整细胞密度,吸取100 μL细胞液于96孔板中使细胞密度达到1×104/孔。培养24 h 弃去旧培养基加入各浓度MB及其类似物100 μL,使各化合物浓度分别为30 nmol/L、100 nmol/L、 300 nmol/L,上述药物孵育30 min后,均加入终浓度为2 mmol/L的Glu。同时设置DMSO对照组(CT组)及Glu组,每组6个复孔,孵育12 h后,每孔加入10 μL 的MTT储备液,于37 ℃避光孵育2 h;吸去上清液,加入DMSO 100 μL,置于孵箱中15 min,在多功能酶标仪测定各个孔在570 nm处的吸光度。细胞存活率计算公式: (OD样品-OD空白)/(OD对照-OD空白)×100%。半数有效量(50% effective dose,ED50)检测时各个化合物浓度分别为10 nmol/L、 20 nmol/L、30 nmol/L、50 nmol/L、100 nmol/L、300 nmol/L;以含相同浓度DMSO为对照组,其余操作与MTT检测相同。
1.2.5 LDH法检测化合物对Glu诱导HT22细胞损伤的保护作用:当HT22细胞处于对数生长期时进行实验,使用胰酶将细胞消化,离心,弃去旧培养基,加入适量新培养基,调整细胞密度,吸取100 μL细胞液于96孔板中使细胞密度达到1×104/孔。24 h后弃旧液,加入各浓度MB及其类似物100 μL,使各化合物浓度为100 nmol/L。细胞分为对照(CT)组、Glu组、药物处理组,测定时以上分组分别测定样品对照OD值(不加辅酶I)和样品测定OD值(加辅酶I),各组LDH释放百分率计算公式为: (样品测定OD值-样品对照OD值)/(正常组测定OD值-正常组对照OD值)×100,实验重复3次。
1.2.6 H2DCF-DA染色法检测细胞内ROS:H2DCF-DA染色用于检测细胞内ROS含量的常用方法。当HT22细胞处于对数生长期时进行实验,使用胰酶将细胞消化,离心,弃去旧培养基,加入适量新培养基,调整细胞密度,吸取500 μL细胞液于24孔板中使细胞密度达到1×104/孔。24 h后弃上清液,加入各浓度MB及其类似物500 μL,使各化合物浓度为 100 nmol/L,化合物预处理30 min后,均加入终浓度为2 mmol/L的Glu,孵育12 h,同时设置DMSO对照组(CT组)和Glu组。细胞处理结束后吸走培养基,用预温PBS轻轻洗细胞2次,吸干PBS,每孔加入500 μL含10 μmol/L H2DCF-DA的无血清DMEM培养基,37 ℃孵育30 min,吸走培养基,用预温PBS轻轻洗细胞两次,以0.25%胰酶消化收集细胞,1 000×g离心5 min,弃上清液,每管加入200 μL无血清DMEM培养基重悬细胞,加入到96孔黑板中,荧光分光光度计测量荧光强度,H2DCF-DA的激发光波长为490 nm,发射光波长为525 nm。
1.2.7 Western blot检测蛋白水平:细胞处理后,弃去培养基,PBS轻洗细胞2次,使用三去污裂解细胞,置于冰上裂解30 min,离心取上清液;使用BCA法检测各组细胞总蛋白量。调整各组细胞浓度到同一浓度。在沸水中煮7 min使蛋白变性。使用8%~10%的SDS-PAGE电泳,电转(60 min,300 mA)。使用脱脂牛奶封闭液孵育PVDF膜,在摇床上使用TBST溶液洗PVDF膜,共3次,每次5 min。在4 ℃冰箱中孵育一抗12 h;在常温下孵育二抗1~2 h,在摇床上使用TBST溶液洗PVDF膜,共3次,每次5 min。显影时在每张膜上滴加发光液,显影成像。
1.2.8 siRNA干扰:细胞接种于35 mm培养板,待细胞密度为40%~60%开始转染。配制转染溶液:A:10 μL siRNA+250 μL Opti-MEM,混匀;B:5 μL lipofectamine 3000+250 μL Opti-MEM,混匀,室温静置5 min;配制A液和B液期间将细胞用PBS洗2次,加入1.5 mL Opti-MEM;20 min后,在细胞培养皿中加入500 μL的A、B混合液,混合混匀;将细胞放回37 ℃培养箱中继续培养4~6 h后将转染液换成完全培养基继续培养,用于Western blot实验和MTT实验。
1.3 统计学处理方法 采用SPSS软件进行数据统计处理。数据用±s表示,多组间比较采用单因素方差分析,组间比较采用LSD-t法。根据数据结果使用Graphpad prism 7.0制作柱状图,使用Adobe Photoshop作Western blot条带图。所有实验均重复3次。P<0.05为差异有统计学意义。
2 结果
2.1 MB及类似物对HT22细胞活力的影响 与CT组相比,Glu组细胞存活率明显降低(P<0.01)。1~10 μmol/L的2-C、A-A、A-B分别处理HT22细胞24 h,均未见明显毒性(P>0.05)。10 μmol/L NR与MB能够明显降低细胞活力(P<0.01)。2-C在10 μmol/L 浓度下能够提高细胞活力(P<0.01)。见图2。LD50计算结果显示,MB:LD50=(50.66±5.87)μmol/L, 2-C:LD50=(175.90±16.53)μmol/L,A-A:LD50=(152.40±18.36)μmol/L,A-B:LD50=(140.40± 12.48)μmol/L,NR:LD50=(73.19±8.49)μmol/L,结果表明化合物2-C、A-A、A-B及NR对HT22细胞的细胞毒性均低于MB。
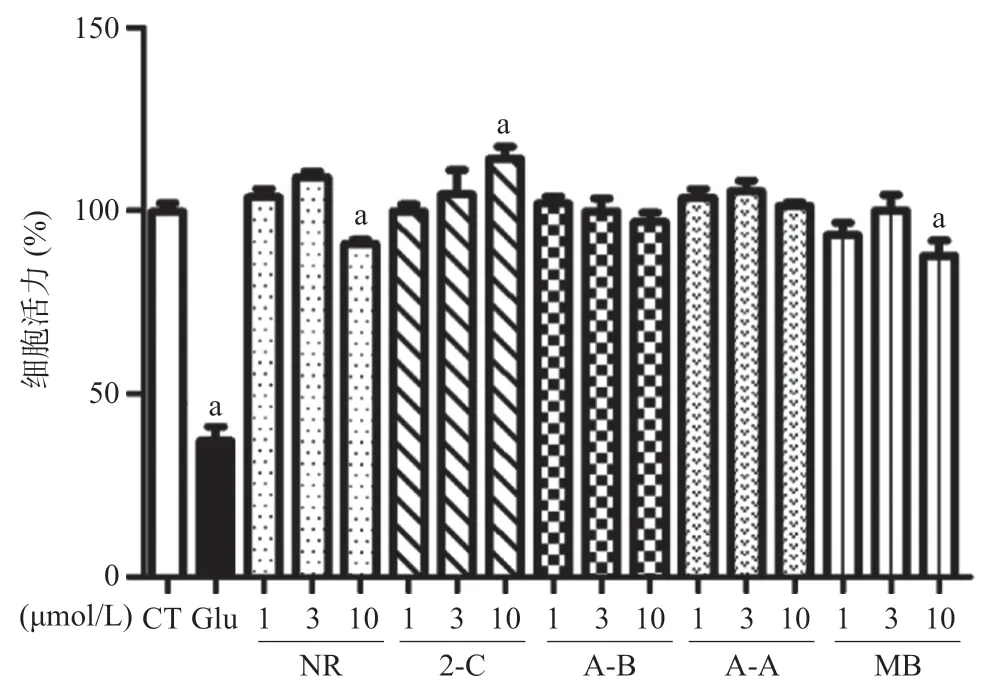
图2 MB及类似物对HT22细胞活力的影响
2.2 MB类似物抗Glu诱导的HT22细胞损伤作用 NR 在30~300 nmol/L浓度范围对Glu诱导的HT22细胞损伤没有明显保护作用(P>0.05);30 nmol/L浓度的2-C、MB、A-B能够明显提高HT22细胞存活率(P<0.01),其保护作用呈剂量依赖性。A-A在30 nmol/L 浓度下未显示明显保护作用,但在100 nmol/L和300 nmol/L浓度时均能明显提高细胞存活率(P< 0.01),见图3。EC50计算结果显示,2-C[EC50=(34.32± 4.93)nmol/L]抗Glu诱导细胞损伤活性高于MB [EC50=(42.13±5.21)nmol/L]。A-A EC50=(48.96± 4.64)nmol/L,A-B EC50=(44.42±2.76)nmol/L。 LDH实验结果与MTT结果一致:2-C、A-B、A-A在 100 nmol/L浓度下均能显著降低Glu诱导的LDH释放(P<0.01),而NR对Glu诱导的LDH释放无明显作用,见图4。
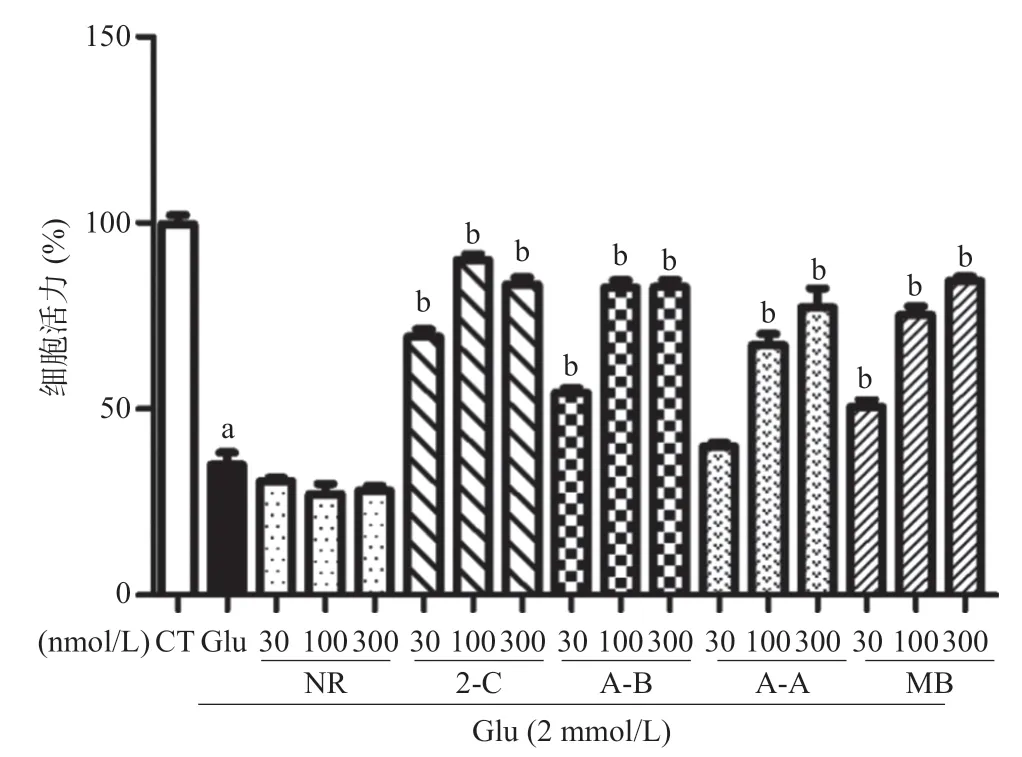
图3 MB类似物对Glu诱导的HT22细胞的保护作用

图4 MB类似物对Glu诱导的HT22细胞中LDH释放的影响
2.3 MB类似物减少Glu诱导的HT22细胞内ROS Glu组细胞内ROS含量明显升高,在100 nmol/L浓度下,NR处理组对Glu诱导产生的ROS没有明显改善;2-C,A-B、A-A均能够明显降低Glu诱导的ROS水平。见图5。
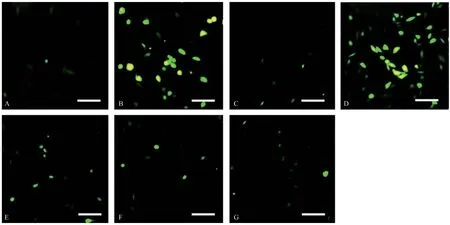
图5 MB及类似物减少HT22细胞中Glu诱导产生的ROS水平
2.4 MB类似物对MEF2D蛋白表达的影响 采用Western blot法检测化合物对HT22细胞内MEF2D 蛋白水平的影响,结果见图6,Glu可显著降低HT22细胞内MEF2D蛋白水平(P<0.05),而化合物2-C、A-B、A-A和MB在100 nmol/L浓度下即能够明显升高HT22细胞内MEF2D水平(P<0.05或P<0.01),NR对HT22细胞中MEF2D蛋白水平没有明显影响(P>0.05)。
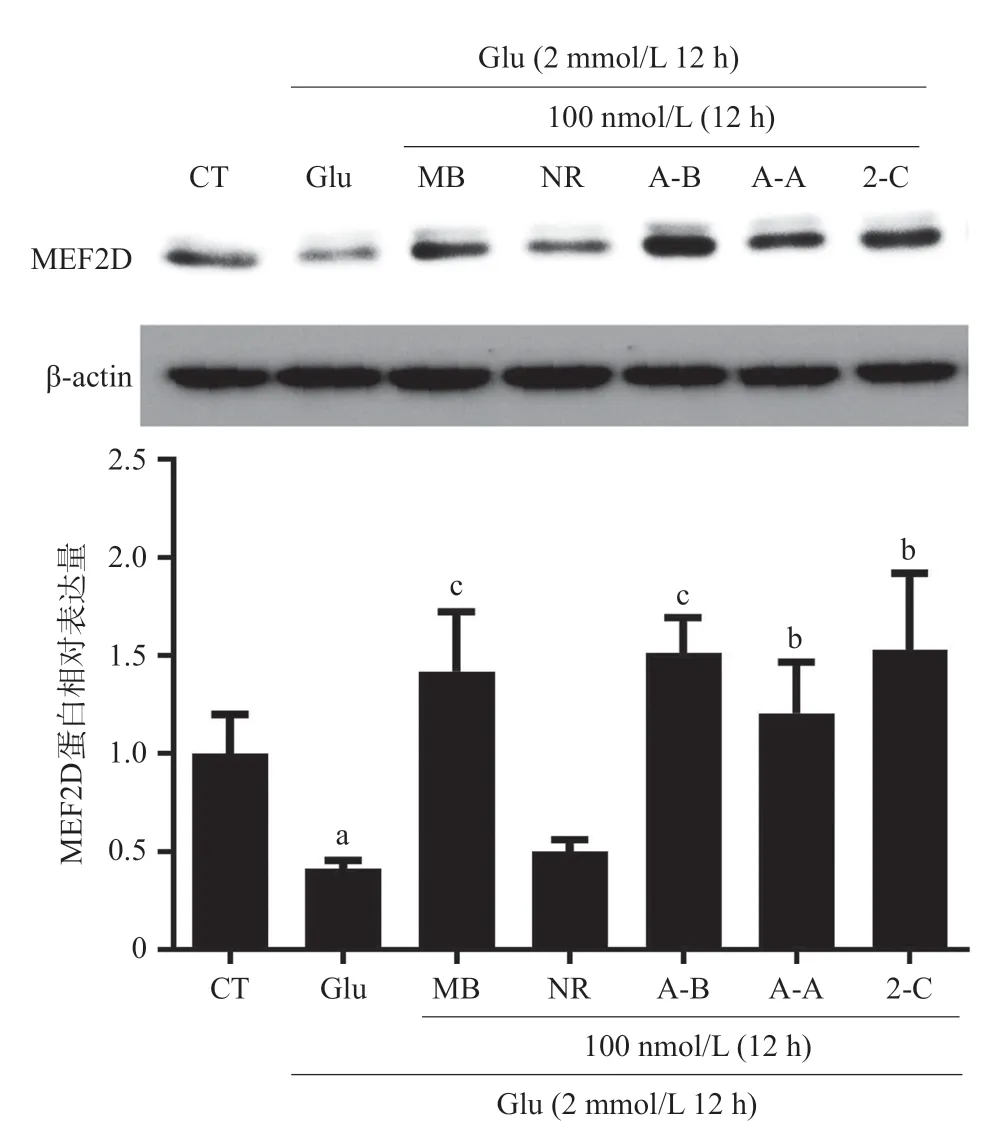
图6 MB类似物提高HT22细胞中的MEF2D蛋白水平
2.5 干扰MEF2D对MB类似物抗Glu诱导HT22细胞损伤作用的影响 采用siRNA干扰序列,抑制细胞中MEF2D表达,进一步检测MB类似物抗Glu诱导HT22细胞损伤作用,结果显示干扰MEF2D后,化合物2-C、A-B、A-A对HT22细胞的保护作用明显降低(P< 0.01),这一结果提示MEF2D至少部分参与了化合物2-C、A-B、A-A抗Glu诱导的HT22细胞损伤作用。见图7。
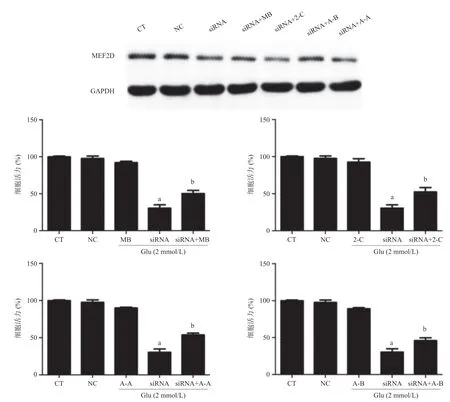
图7 siRNA干扰MEF2D后对MB类似物抗Glu诱导HT22细胞损伤作用的影响
2.6 MB类似物激活Akt/GSK-3β/MED2D通路 采用Western blot法检测MB类似物对T-Akt、p-Akt、T-GSK-3β、p-GSK-3β蛋白水平的影响。100 nmol/L 2-C、A-B、A-A处理细胞24 h后,细胞内p-Akt/T-Akt比值显著提高,p-GSK-3β/T-GSK-3β比值同样明显升高(P<0.05)。见图8。
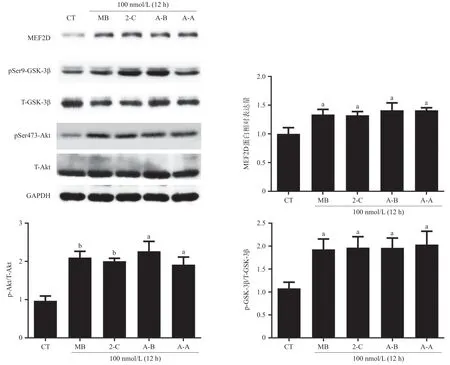
图8 MB类似物激活Akt/GSK-3β通路
2.7 Glu细胞模型中MB类似物激活Akt/GSK-3β/MED2D/ND6通路 在Glu诱导的HT22细胞氧化损伤模型中发现2-C、A-B、A-A能够激活Akt,增加GSK-3β磷酸化来抑制GSK-3β活性,提高MEF2D蛋白水平,同时能够提高线粒体编码蛋白ND6的蛋白水平(P<0.05),见图9。这一结果进一步证明Akt/GSK-3β/MEF2D/ND6可能与2-C、A-B、A-A的抗氧化损伤作用密切相关。
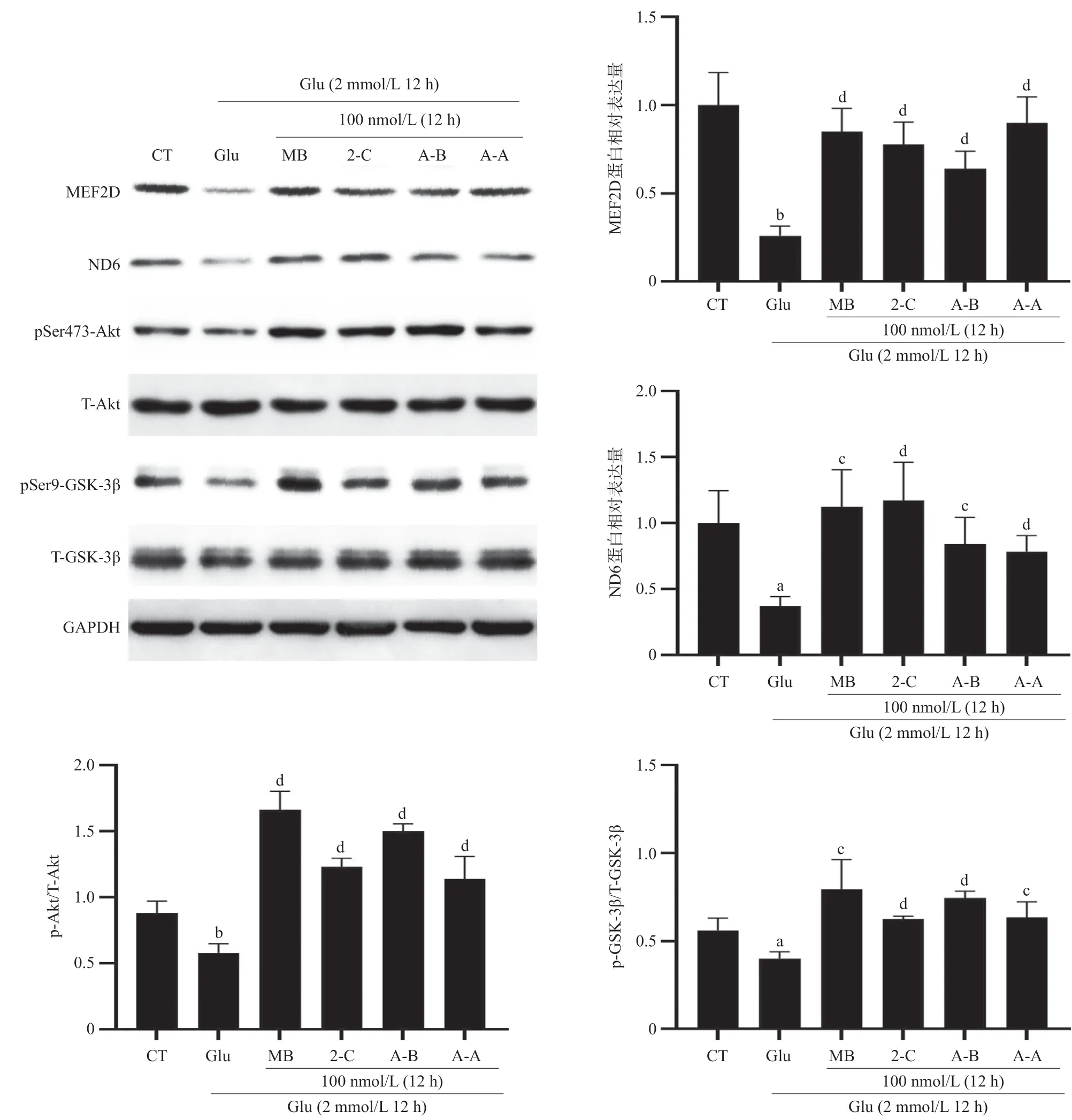
图9 Glu诱导HT22细胞氧化损伤模型中MB类似物激活Akt/GSK-3β/MEF2D/ND6通路
3 讨论
MB是首个全人工合成的吩噻嗪结构药物,具有广泛的生物活性。近年来,相关研究发现MB类似物具有MB相似的生物活性,包括抗菌作用、调控NO/cGMP信号通路、抑制单胺氧化酶活性产生抗抑郁作用、抗氧化损伤作用等[5-8]。然而,目前MB类似物抗氧化作用及其作用机制研究鲜有报道,深入研究MB类似物的抗氧化作用及其机制,将为该类药物的研发、结构改造及临床应用提供重要的实验依据。
本次研究发现具有酚噻嗪结构的化合物2-C、A-B、A-A具有显著的抗Glu诱导的氧化损伤作用,均在nmol/L浓度水平发挥明显的抗氧化作用,而不具有酚噻嗪结构的NR未显示抗氧化损伤作用。此外,MTT实验结果发现:与MB比较,2-C具有更强的抗氧化损伤作用及更低的细胞毒性。
目前,研究证明MEF2D能够参与神经元的分化并促进神经元存活[16]。多项研究发现MEF2D蛋白水平下调与多种神经退行性疾病有关包括PD、 AD[14,17-19]。如:GUO等[20]研究发现羟黄酮抑制神经元凋亡等神经保护作用与其激活MEF2D有关。YAO等[21]研究认为B3C可通过激活MEF2D,产生保护多巴胺能神经元,改善PD运动缺陷。
机制研究发现Akt/GSK-3β参与调节MEF2D表 达[22-23]。研究发现MEF2D受到GSK-3β的磷酸化修饰,MEF2D磷酸化后通过Caspase途径介导降解[18,24]。
近年来研究发现MEF2D不仅在细胞核中作为转录因子调控基因表达,MEF2D也定位于线粒体,并参与调控线粒体基因表达。ND6是线粒体复合体I的重要组成成分。研究发现ND6基因突变或者ND6蛋白水平下降,可引起线粒体复合体I结构改变进而引起线粒体功能障碍[25-26]。前期研究证明MEF2D可促进线粒体编码蛋白ND6的转录翻译,提高线粒体复合物I活性,从而提高线粒体功能,降低细胞内氧化应激水平[27]。此外,研究结果表明:ND6基因中MEF2结合位点突变则会干扰线粒体复合体I的形成,引起细胞氧化应激损伤。
前期研究发现MEF2D参与MB抗Glu诱导HT22细胞损伤作用,且这一作用可能与MB的中枢神经系统保护作用密切相关[28]。因此,本研究在发现2-C、A-B、A-A具有抗氧化作用的基础上进一步探究了MEF2D与其作用的相关性。我们检测了2-C、A-B、A-A对HT22细胞中MEF2D蛋白水平的影响,并检测了敲低MEF2D后对2-C、A-B、A-A抗氧化损伤作用的影响,结果显示siRNA敲低MEF2D后部分取消2-C、A-B、A-A抗氧化损伤作用,以上结果表明MEF2D参与了2-C、A-B、A-A抗氧化损伤作用。此外,我们采用Western blot法检测2-C、A-B、A-A对Akt/GSK-3β/MEF2D/ND6通路的作用,结果显示2-C、A-B、A-A显著激活Akt,促进GSK-3β磷酸化使其失活,这一作用可能与化合物升高HT22细胞内MEF2D、ND6蛋白水平有关。
综上所述:本次研究通过对2-C、A-B、A-A、NR四种MB类似物的抗氧化作用及其机制进行研究结果进行分析得出:①吩噻嗪结构可能对该类化合物的抗氧化损伤活性起到重要作用;具有吩噻嗪结构的化合物2-C、A-B、A-A与MB具有非常显著的抗氧化损伤活性;②2-C与MB相比具有更低的细胞毒性,且其抗Glu诱导细胞损伤作用效价强于MB;③2-C、A-B、A-A的抗氧化损伤作用可能与其调节Akt/GSK-3β通路,提高MEF2D、ND6蛋白水平,促进线粒体功能有关;以上结果为后续进一步开展MB类似物在氧化应激相关疾病中的研究奠定实验基础,并为MB类似物的合成、结构改造等领域研究提供参考。

