剪切波弹性成像在评估2型糖尿病患者正中神经病变中的应用研究
周维风,王佳佳,伍宏兵
(安徽中医药大学第一附属医院超声医学科,安徽 合肥 230031)
0 引言
糖尿病周围神经病变(neuropathy of diabetic Patients, DPN)是2型糖尿病(type 2 diabetes mellitus,T2DM)患者的常见及严重并发症之一,发生率约为30%~50%[1],会显著影响患者肢体感觉或运动功能,是T2DM患者的主要致残原因,其特征是起病隐匿且后果严重,严重影响患者生活质量。目前神经电生理检查目前是诊断DPN的“金标准”,但也具有一定的局限性,如在疾病的早期可能出现假阴性、部分患者难以耐受神经电生理检查时的脉冲电流刺激等。剪切波弹性成像(shear wave elastography,SWE)可以对组织的弹性分布特征进行定性、定量的评价,目前广泛应用于甲状腺、乳腺,肝脏等病变的研究。当神经组织发生病变时会引起弹性的改变[2],因此弹性可反映生物的组织学特性[3],本研究应用剪切波弹性成像评估受检者正中神经硬度,旨在探讨SWE在评估T2DM 患者DPN中的临床价值。
1 资料与方法
1.1 研究对象
收集 2021年01月至2022年4月在安徽中医药大学第一附属医院确诊为T2DM的住院患者50例,其中男27例,年龄43~75岁,中位年龄58岁,女23例;年龄46~74岁,中位年龄58岁。所有患者均符合2020版中国2型糖尿病防治指南[4];并行神经电生理检查。依据是否存在周围神经病变将受检者分为A组(T2DM伴DPN组)25 例、B组(T2DM不伴DPN组)25 例,并选取同期健康体检的志愿者25例为C组(对照组)。排除标准:①1型糖尿病患者及妊娠期女性;②存在类风湿性关节炎、痛风性关节炎等全身性关节病变患者;③酒精性疾病、代谢性疾病等导致的周围神经病变;④无神经电生理检查结果。本研究经安徽中医药大学第一附属医院伦理委员会审查,所有受检者均签署知情同意书。
1.2 仪器与方法
应用迈瑞Resona7彩色多普勒超声诊断仪,探头选用L14-5WU高频线阵探头,将扫查模式设置为肌骨模式。检查时所有受检者采取坐位,掌心向上,上肢平放于检查床上,充分涂匀耦合剂,于前臂追踪扫查正中神经,注意与肌腱区分,至腕横纹上5cm处冻结图像,手动描绘横断面积(cross sectional area, CSA),然后将探头旋转90度,保持探头稳定,待正中神经长轴清晰显示后切换至SWE模式,待弹性图像质量显示为五颗星时冻结图像,测量区域ROI设置为直径2mm的圆形。测量感兴趣区内神经组织的杨氏模量(elasticity Young's modulus,E)及剪切波速度(shear wave velocity, SWV);所有参数均测量3次取平均值,再应用同样的方法扫查对侧正中神经。
1.3 统计学方法
使用 SPSS 21.0软件,应用K-S检验分别对三组受检者E值、SWV及CSA进行正态性检验,计量资料符合正态分布的以()表示,不符合正态分布的以中位数表示,符合正态分布的三组间计量资料方差齐性检验使用levene检验,方差齐时采用单因素方差分析,其中组间两两比较采用LSD-t检验,否则采用非参数检验;计数资料组间比较采用卡方检验。再以神经电生理检查作为“金标准”来绘制ROC曲线,确定曲线下面积及最佳截断值,评价正中神经各参数的诊断效能,P<0.05认为差异有统计学意义。

表1 3组受检者的一般资料比较
2 结果
2.1 组间基本资料比较
3组受检者的性别及年龄比例差异均不显著(P>0.05),A组与B组受检者糖尿病病程无显著差异(P>0.05)(表4)。
2.2 组间各参数比较
A组与B组受检者的横断面积均高于C组(P均<0.05),A组与B组的横断面积比较,差异不显著(P>0.05),A组杨氏模量与剪切波速度均高于B组(P均<0.05),B组杨氏模量与剪切波速度均高于C组(P均<0.05)(表2,典型病例见图1~3)。
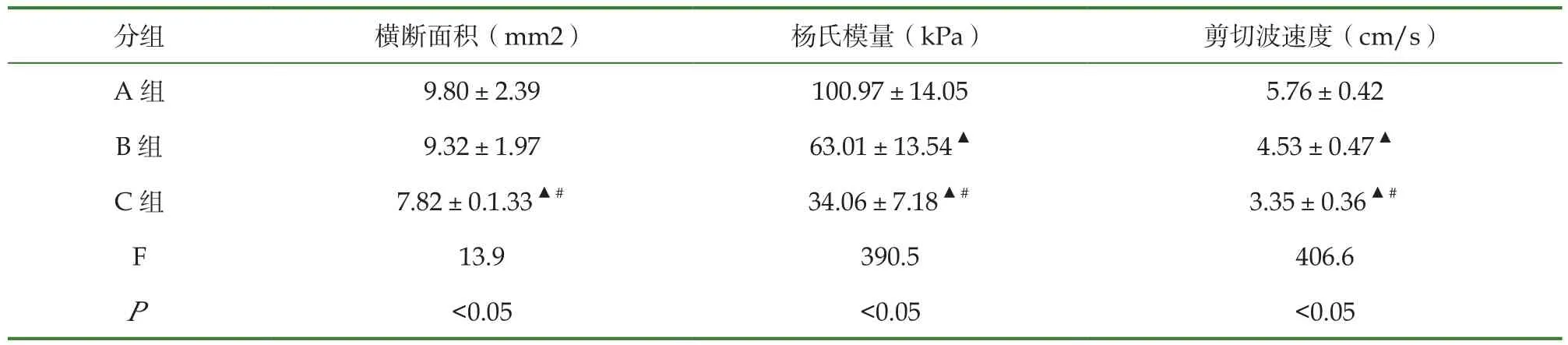
表2 3组研究对象正中神经各参数比较
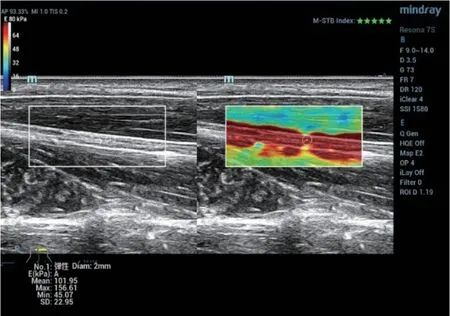
图1 T2DM伴DPN病例,正中神经杨氏模量101.95Kpa
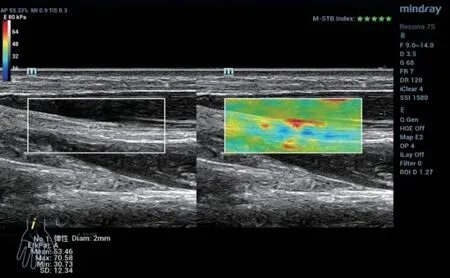
图2 T2DM不伴DPN病例,正中神经杨氏模量53.46Kpa
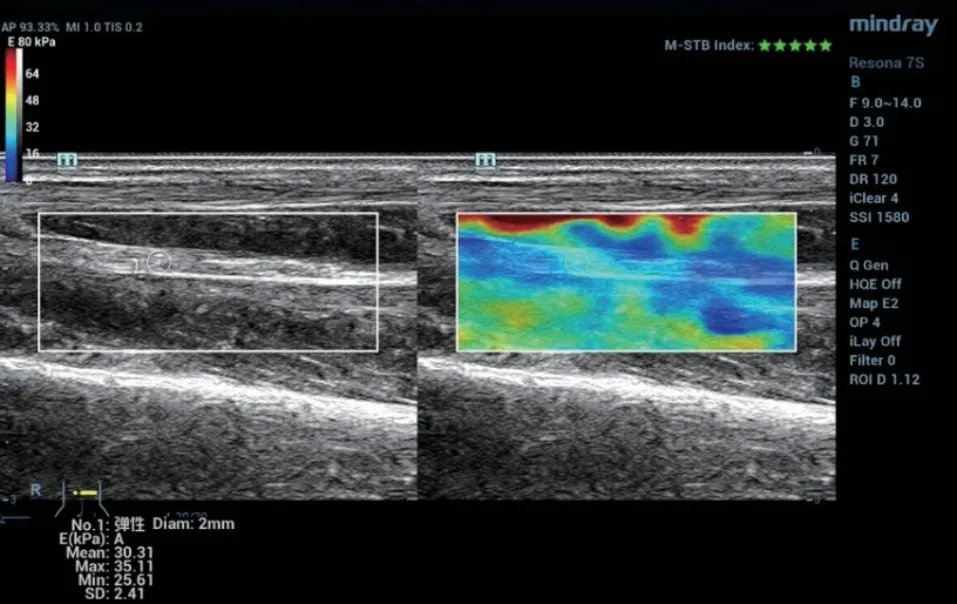
图3 正常志愿者,正中神经杨氏模量30.31Kpa
2.3 ROC曲线分析杨氏模量、剪切波速度及横断面积对应的ROC曲线下面积分别为0.975、0.970、0.564(图4)。其敏感度、特异度及最佳截断值见表3。

图4 T2DM伴DPN组与T2DM不伴DPN组正中神经各参数的ROC曲线
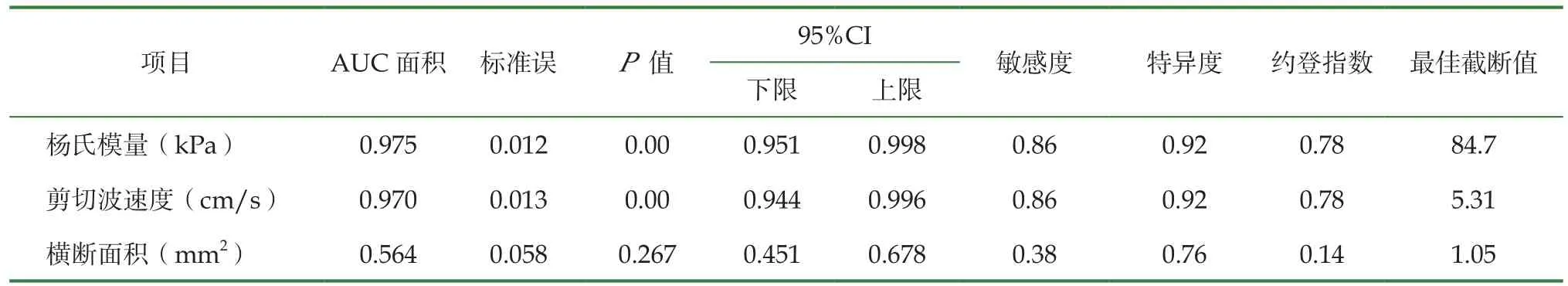
表3 正中神经各参数诊断DPN的 ROC 曲线效率值
3 讨论
T2DM患者出现DPN时,早期主要表现为末端神经对称性四肢麻木和痛觉过敏,进一步发展可能会出现肌肉无力甚至瘫痪,严重影响T2DM患者的生活质量,是T2DM患者致残的重要原因,早期诊断和治疗是控制其发展的重要条件。目前临床诊断DPN的检查方法有磁共振神经成像、神经电生理检查及神经组织活检等,其中磁共振神经成像价格昂贵且耗时长,不便动态随访,神经电生理检查目前是诊断DPN的“金标准”,但属于有创检查,且无法精准定位;神经活检创伤性大,患者难以接受。可见,临床上需要一种精确、安全、便捷的新型技术来帮助诊断DPN。
SWE是一种新型的超声检查技术,利用发射瞬时脉冲在人体组织中产生剪切波得到SWV,然后通过系统计算可以得到反映组织硬度的E值,可定量评估组织硬度,目前在人体肝、肾、甲状腺、肌肉等方面应用广泛[5-7],SWV或E值越大,表示组织越硬。有学者研究显示[8-9],以自然放松状态下沿神经纤维纵切面测值可靠性较横切面更高,因此本研究所有受检者正中神经弹性值测量均在神经纵切面进行。本研究显示,3组间杨氏模量值及SWV差异均有统计学意义,其中志愿者组、T2DM不伴DPN组及T2DM伴 DPN组的杨氏模量及剪切波速度呈增加趋势。T2DM伴DPN组的杨氏模量及剪切波速度最大,提示病变最严重。相关研究表明,与糖尿病相关的代谢紊乱引起的神经束膜和神经周围水肿会增加神经内压力,使神经变硬[10]。随着糖尿病病程的延长,局灶性脱髓鞘和轴突变性伴纤维化反应导致瘢痕组织增生和神经硬度进一步增加[11]。T2DM不伴DPN组患者与志愿者组的杨氏模量及剪切波速度差异有统计学意义,表明神经在早期受到轻度损伤时,其形态学尚未出现明显改变之前,神经内部发生纤维化变使其僵硬度增加,与国内外学者[12]-[14]研究结果类似。本研究中杨氏模量与剪切波速度对DPN的诊断效能相当,是因为杨氏模量是系统依据剪切波速度根据公式E=3ρc²自动计算生产的。T2DM不伴DPN组及T2DM伴 DPN组正中神经CSA均高于志愿者组,这可能与神经束膜水肿有关[15],正常正中神经横切面因神经束膜的存在呈现出蜂窝状类圆形结构,当正中神经病变时神经束膜水肿、回声减低,横切面上神经形态饱满,面积增大。T2DM不伴DPN组与T2DM伴 DPN组比较CSA比较差异不显著,可见CSA对于区分T2DM患者是否合并DPN意义不大。
本研究仍存在局限性:其一,考虑到T2DM伴DPN患者症状首先出现在四肢末梢,因此仅评估患者手腕横韧带上5cm水平正中神经,因此缺乏对周围神经的整体评估。其二,受样本量限制,本研究未进一步探讨T2DM伴DPN患者空腹血糖、糖化血红蛋白水平及糖尿病治疗时间等因素对杨氏模量值的影响,在今后的研究中有待进一步探索。
综上所述,剪切波弹性成像可以定量检测正中神经的硬度,反映正中神经病变情况,为临床诊断T2DM患者是否合并DPN提供重要参考价值。

