Kinesin家族成员C1促进结肠癌细胞增殖及与预后的相关分析
李 冰,陈 靖,于素香,朱凤池,闫江鹤,赵秀娟,冯 璞,陈苗凤,贾金娜
结肠腺癌是结肠癌中最常见的一种亚型,由于缺乏显著的早期症状,多数患者在就诊时已处于进展期[1]。进展期结肠腺癌具有高侵袭性,导致结肠腺癌患者的死亡率升高[2-3]。目前结肠腺癌的治疗手段主要包括手术治疗、放化疗及联合治疗等,尽管取得一定进展,但仍然难以满足多数进展期患者的生存需求。多个针对结肠腺癌的分子靶点如SIRT6、CXCR2等相继被发现[4-5]。Kinesin家族成员C1(kinesin family member C1,KIFC1)也称作HSET,是Kinesin超家族的一个马达蛋白[6]。近年来,KIFC1在肿瘤发生发展过程中的重要作用被越来越多地揭示出来[7-9]。由于KIFC1在癌细胞的多个中心体聚集中发挥关键作用,因此已被认为是一个潜在的化疗靶点。此外,KIFC1也被发现通过稳定一定程度的遗传不稳定性、延迟细胞周期和保护癌细胞存活信号,主动驱动肿瘤的恶性和转移[10-12]。然而,KIFC1是否可影响结肠癌的发展仍然未知。本研究主要探讨KIFC1在结肠癌组织样本中的表达和临床意义,并利用短发夹RNA(shRNA)敲低结肠腺癌细胞系KIFC1的表达,评估KIFC1调控结肠腺癌细胞增殖能力的作用,以期为基于KIFC1的靶向治疗提供临床和实验室依据。
1 材料与方法
1.1 临床资料 选取来自保定市第四中心医院、天津市肿瘤医院和保定第二医院的结肠腺癌手术治疗患者122例,其中男性66例,女性56例;年龄42~78岁,平均53.2岁;临床分期I~II期68例,III~IV期54例;肿瘤病理高分化78例,低分化44例;有淋巴结转移56例,术后均经病理证实为结肠腺癌。排除标准为有病理证实并非结肠腺癌、存在第二原发肿瘤、存在全身广泛转移或存在手术切除禁忌等。
1.2 实验材料 试剂:Anti-KIFC1抗体(ab172620,美国Abcam公司);抗核抗体(1:1000稀释,中国Sanying公司);二氨基苯胺(中国上海Cell Signaling科技公司);胎牛血清(04-100-1ACS,以色列 BI公司);Lipofectamine 2000(11668069,美 国 Invitrogen公 司 );MTT(298931)、DMSO(67685)、结晶紫(548629)均购自美国Sigma公司;Trizol试剂(15596026,美国Invitrogen公司),第一链cDNA合成试剂盒(K1621,美国Thermo公司),FastStart Universal SYBR Green Master(ROX)(瑞士罗氏公司);β-肌动蛋白(ab179467,1:1000,美国Abcam公司)。本试验中涉及的仪器如下:ABI 7900HT QPCR Cycle,微板阅读器(美国Thermo 公司),PVDF膜(北京智杰方远科技有限公司)。细胞系:结肠癌细胞系HCT116和HT29(国家实验细胞资源共享平台,北京)。
1.3 免疫组织化学染色及评分标准 采用免疫组织化学染色实验检测KIFC1在结肠腺癌患者的肿瘤组织及其对应的癌旁组织(距离肿瘤组织3~5 mm的结肠正常组织)中的表达水平。用福尔马林固定肿瘤组织,行石蜡包埋与切片后,于75 ℃加热30 min,用二甲苯脱蜡,并用梯度乙醇(100%、100%、95%、85%、75%)水合。用柠檬酸缓冲液孵育15 min提取抗原,并阻断内源性过氧化物酶5 min,5% BSA封闭切片20 min,随后使用抗KIFC1的抗体(1︰100稀释)孵育2 h,生物素化的二抗(1︰1000稀释)孵育1.5 h,二氨基苯胺作为显色剂底物,洗涤染色5 min后用显微镜采集图像。评分标准如下[8]:阳性细胞:肿瘤细胞阳性率<5%记为0分,肿瘤细胞阳性率5%~25%记为1分,肿瘤细胞阳性率25%~75%记为2分,肿瘤细胞阳性率>75%记为3分。同时对阳性染色的肿瘤细胞膜及胞浆染色强度进行评分:阴性染色记为0分,弱阳性染色记为1分,中度阳性染色记为2分,强阳性染色记为3分。随后将阳性细胞百分比评分和染色强度评分相加,分为高表达(3~6分)和低表达(0~3分)。每个患者的肿瘤组织切片选取5个视野观察。最终结果采用双盲法进行判断。
1.4 细胞系培养并利用shRNA敲低KIFC1 将结肠癌细胞系HCT116和HT29用含有10%胎牛血清的RPMI-1640培养基培养,孵育于二氧化碳浓度为5%,温度为37 ℃的培养箱中。转染前1 d将细胞种植在24孔板上,使用shRNA(序列AAATTACCACATCCCACCCAAGA) 感 染HCT116和HT29细胞,转染试剂为Lipofectamine 2000,将50 μL转染复合物滴加到培养基中,混合均匀,转染后12 h观察细胞形态,继续培养48 h。
1.5 RNA提取和实时定量PCR 根据Trizol试剂从转染KIFC1 shRNA的HCT116细胞和HT29细胞中提取总RNA,用第一链cDNA合成试剂盒合成cDNA,使用ABI 7900HT QPCR Cycle和 FastStart Universal SYBR Green Master(ROX)进行实时定量PCR实验。GAPDH已经被规范化,并使用2-∆∆Ct法计算相对表达量。β-actin引物:5’-CAGCTCACCATGGATGATGATATC-3’和 5’-AAGCCGGCCTTGCACAT-3’,KIFC1 引物:5’-TGAGCAACAAGGAGTCCCAC-3’ 和5’-TCACTTCCTGTTGGCCTGAG-3’。
1.6 Western blotting 用PBS缓冲液洗涤细胞,并用细胞裂解液裂解细胞以提取总蛋白,用BCA蛋白质分析试剂盒(PC0020,中国索莱宝公司)定量。将20 μg蛋白质样品与上样缓冲液混合,进行SDS-PAGE电泳及转膜。之后用溶于TBST缓冲液中的5%脱脂牛奶封闭膜1 h,在4 ℃下与一抗(KIFC1、PCNA、Ki67、β-actin)孵育过夜。然后使用TBST缓冲液洗涤3次,与特异性的HRP结合的二抗孵育,滴加显影液在曝光仪中进行检测。结果用相对表达量进行半定量统计分析。
1.7 MTT实验 对照组和转染后细胞以每孔5000个的密度接种于96孔板中,72 h后添加10 μL浓度为5 mg/mL的MTT培养6 h。抽吸培养基并将MTT溶解于100 μL DMSO中,使用酶标仪在570 nm处读取吸光度。
1.8 克隆形成实验 细胞转染后24 h计数,并以每孔300个细胞的密度分3次接种到6孔板中,然后培养8 d。培养基每4天更换1次,然后用结晶紫染色,计数超过50个细胞的菌落。
1.9 统计学方法 采用GraphPad软件进行统计分析。计数资料以例(%)表示,采用卡方检验比较不同临床病理特征患者KIFC1蛋白表达情况的差异。剂量资料以(均值±标准差)表示,两组比较用t检验。利用Kaplan-Meier方法比较KIFC1低表达与高表达结肠腺癌患者的总生存期和无病生存期。P<0.05为差异有统计学意义。
2 结果
2.1 KIFC1在结肠腺癌组织样本中高表达 KIFC1主要定位在结肠腺癌细胞的细胞核中,相对于癌旁组织,KIFC1在结肠腺癌中呈明显高表达,见图1。

图1 KIFC1在结肠癌组织及癌旁组织中的表达情况比较(免疫组织化学法,上图为×100,下图为×200)
2.2 KIFC1与结肠腺癌患者临床病理特征的关系根据KIFC1的染色强度,将结肠癌患者的肿瘤组织样本分为KIFC1高表达组(60例)和KIFC1低表达组(62例),比较两组结肠腺癌患者的临床特征发现,KIFC1的表达水平与结肠腺癌患者的肿瘤T分期及临床分期紧密相关,高表达组的T3~4期和III~IV期患者比例高于低表达组,差异有统计学意义;而两组其他临床特征差异无统计学意义(表1)。
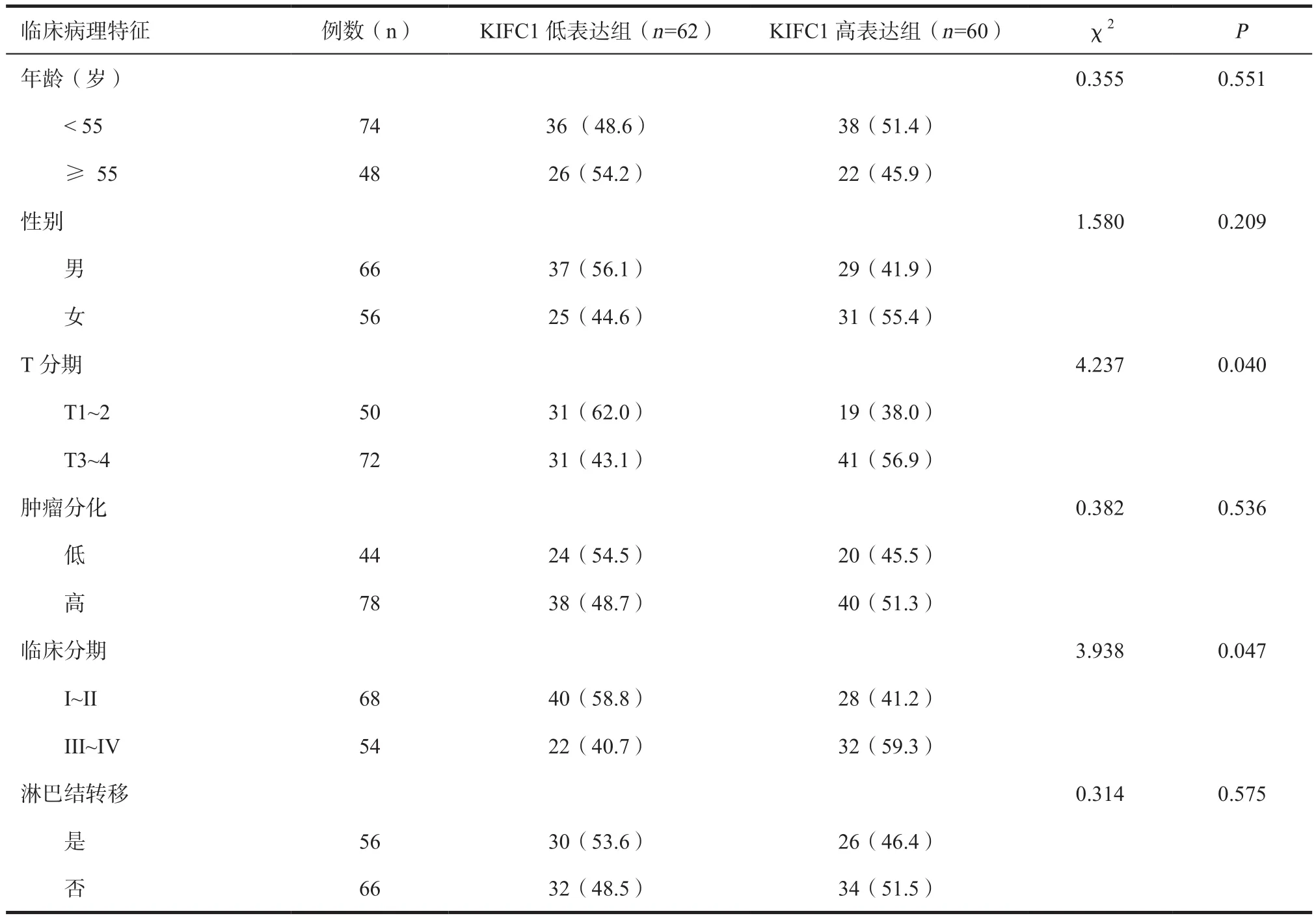
表1 122例结肠癌组织中KIFC1高表达组和低表达组的临床病理特征比较
2.3 KIFC1表达水平与结肠腺癌患者的不良预后显著相关 高表达KIFC1组结肠腺癌患者具有更低的总生存期及无进展生存期(χ2=12.510、21.561,P=0.0007、P<0.0001, 图 2), 表 明KIFC1的表达水平与结肠腺癌患者的不良预后显著相关,提示KIFC1可能在结肠腺癌的发生发展过程中起重要作用。
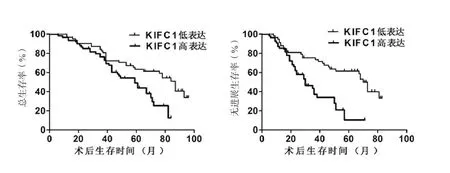
图2 KIFC1的表达水平与结肠腺癌患者总生存期和无进展生存期的相关性
2.4 敲低结肠癌细胞中KIFC1表达水平抑制其增殖能力 使用shKIFC1慢病毒载体感染HCT116和HT29细胞后,通过实时定量PCR和Western blotting验证其在基因和蛋白水平敲低KIFC1的效率,发现实验组细胞HCT116和HT29被shKIFC1慢病毒感染后,KIFC1基因和蛋白表达水平明显降低(图3)。随后,利用MTT实验分析发现,接种细胞72 h后,对比对照组,敲低KIFC1组细胞增殖明显下降。为进一步证明KIFC1能否调控结肠癌细胞的增殖能力,本研究检测了增殖的标志物Ki67和PCNA的表达水平,发现无论是集落形成数还是增殖标志物的表达量,敲低KIFC1后,均明显下降(图4)。

图3 shRNA转染结肠癌细胞后KIFC1基因mRNA(A)和蛋白(B)表达水平降低

图4 在结肠癌细胞系中敲低KIFC1表达抑制细胞的增殖和相关蛋白表达
3 讨论
结肠腺癌是一种高发病率及高死亡率的恶性肿瘤[3]。由于缺乏显著的早期症状及高转移性,现有的治疗手段,如放疗、化疗等均难以起到预期的治疗效果[1]。近年来靶向治疗受到更多关注,多个结肠腺癌靶向治疗药物被发现,少数已处于临床实验阶段[13]。本研究发现KIFC1在结肠腺癌组织中呈高表达,并且与结肠腺癌患者的不良预后紧密相关,提示其在结肠腺癌发展过程中可能具有重要作用。近年来,KIFC1在肿瘤发生发展过程中的重要作用被越来越多地揭示出来:多篇文献证实KIFC1在多种肿瘤组织中高表达,并与其不良预后有关[9-11]。KIFC1影响非小细胞肺癌及肾细胞癌的增殖,影响肝细胞癌的转移及不良预后[11],KIFC1可作为三阴性乳腺癌不良预后的生物标志物[8-10]。有研究报道,KIFC1可沿着微管并朝向负末端移动,从而参与货物转运[6],KIFC1还参与有丝分裂纺锤体的形成及纤毛发生[7],可调控高尔基体的形成、定位及高尔基体相关囊泡的转运[7]。近年来,KIFC1在肿瘤发生发展过程中的重要作用被越来越多地揭示出来:多篇文献证实KIFC1在多种肿瘤组织中高表达,与多中心体的形成有关[12],并与不良预后有关[10-12]:Han等[9]发现KIFC1水平升高与肝细胞癌的不良预后和转移相关。此外,KIFC1在体外和体内都诱导上皮-间质转化(EMT)和肝细胞癌转移;且KIFC1过表达增强了肝癌细胞增殖和病灶形成,而KIFC1敲除抑制了肝癌细胞的生长和病灶形成。本研究发现KIFC1在结肠腺癌组织中的高表达,并且与结肠腺癌患者的不良预后紧密相关,提示其在结肠腺癌发展过程中可能具有重要作用。同时,本研究通过细胞实验发现,成功建立的稳定敲除KIFC1的细胞系,对比对照组,其细胞存活率明显减少,形成的集落数也明显减少,并且增殖标志物Ki67以及PCNA的表达水平也明显降低,暗示其可能在调控结肠癌细胞增殖方面起到至关重要的作用,可以作为结肠腺癌治疗有效的分子靶点,但精细的分子机制仍需进一步研究。
Kinesin可参与中心体复制的调控,KIFC1的过表达会导致肿瘤细胞多级纺锤体的形成[6]。本研究发现敲低KIFC1在体外水平能够明显影响结肠癌细胞的增殖水平,其表达水平也与结肠腺癌的不良预后显著相关。而除了增殖外,KIFC1也通过别的方式调控肿瘤生长:KIFC1可作为微管与高尔基体的桥梁,从而维持高尔基体的定位与形态[7];同时,高尔基体的囊泡运输也受到KIFC1的调控。
这些基于Kinesin家族蛋白对肿瘤影响的研究,结合本研究中已证实KIFC1参与结肠癌细胞的增殖调控的结论,以及临床样本中验证的高表达KIFC1与进展的临床分期以及不良预后相关,证实了Kinesin这一马达蛋白家族在肿瘤发生发展中的重要作用,提示这类蛋白可作为肿瘤治疗的潜在靶点,从而发挥重要的临床价值。

