blaNDM-1 基因敲除对阴沟肠杆菌毒力的影响
代鹏飞, 杨 恺, 杜 艳, 刘淑敏
(昆明医科大学第一附属医院医学检验科 云南省检验医学重点实验室 云南省医学检验临床医学研究中心, 云南 昆明 650032)
blaNDM-1 基因已经被发现存在于众多动物和周围环境中, 其能进行广泛传播的基础是由于blaNDM-1 基因常位于可移动遗传元件上, 介导耐药基因的水平转移, 在阴沟肠杆菌中, blaNDM-1基因常位于IncFⅡA 型质粒中[1-2]。病原性细菌致病能力的强弱程度称为毒力, 通常病原菌毒力越大, 其致病性就越强, 若携带blaNDM-1 基因的可移动遗传元件转移至毒力和适应能力更强的菌株或存在固有耐药性的菌株中, 将会对公共卫生造成严重威胁, 这可能导致携带blaNDM-1 基因的细菌既具有高毒力, 又具有广泛耐药性。有研究[3]显示:blaNDM-1 基因可能与细菌的毒力有关。然而关于blaNDM-1 基因对阴沟肠杆菌毒力的影响目前尚不明确。本研究比较携带blaNDM-1 基因的阴沟肠杆菌T2 及其blaNDM-1 基因敲除菌株ΔT2 毒力的差异, 探讨blaNDM-1 基因对阴沟肠杆菌毒力的影响, 为进一步论证blaNDM-1 基因是否有助于高毒力高耐药菌株的形成提供依据。
1 材料与方法
1.1 菌株、细胞、主要试剂和仪器
携带blaNDM-1 基因的阴沟肠杆菌T2 和blaNDM-1 基因敲除的阴沟肠杆菌ΔT2 均为本实验室前期构建和保存。小鼠巨噬细胞(RAW264.7 细胞)购自中国BNCC 公司。细胞培养相关试剂购自以色列Biological Industries 公司, PCR 相关试剂购自北京博迈德生物科技有限公司。CO2培养箱购自美国Thermo Scientific 公司, IG603 二级生物安全柜购自美国Baker 公司, 恒温摇床和紫外分光光度计购自美国Thermo 公司, 麦康凯平板购自英国OXOID 公司, 细菌比浊仪购自法国梅里埃公司。
1.2 质粒稳定性检测
将前期研究筛选得到的携带耐药基因blaNDM-1 的阴沟肠杆菌T2(T2 组)、阴沟肠杆菌T2 blaNDM-1 基因敲除株(ΔT2 组) 和阴沟肠杆菌ATCC13047(ST 组)传代200 次后, 首先进行抗菌药物敏感实验, 并检测是否携带blaNDM-1 基因, 据此判断传代过程中携带blaNDM-1 基因的质粒是否丢失。
1.3 阴沟肠杆菌的生物学特性检测
1.3.1 耐药和毒力基因的扩增 实验组为T2 和ΔT2 组, 对照组为ST 组。每组取1 株阴沟肠杆菌, PCR 法扩增3 株阴沟肠杆菌携带的常见的碳青霉烯类耐药基因和毒力基因, 引物序列参考文献[4-7], 并测序验证。
1.3.2 运动实验检测各组菌落的运动直径 3 株阴沟肠杆菌在LB 液体培养基中活化后, 吸取1 mL菌液于1 mL 无菌EP 管进行离心, 弃上清, 加入无菌PBS 缓冲液重悬、离心, 之后采用无菌PBS 缓冲液调节浓度至0.5 麦氏浊度。制备0.25% LB 半固体培养基(2.5 g·L-1), 吸取2 μL 阴沟肠杆菌菌液接种于LB 半固体培养基上, 37 °C 培养过夜, 采用游标卡尺测量菌落运动直径, 重复4 次并记录。
1.3.3 生物膜形成能力检测 3 株阴沟肠杆菌在麦康凯平板复苏后, 挑取单个菌落于LB 液体培养基中充分混匀作为阴性对照组(LB 组), 待其生长至对数生长期, 将细菌浓度稀释为1.5×108CFU·mL-1, 取100 μL 菌液加入至96 孔细胞培养板中, 之后每孔加入150 μL LB 液体培养基, 将细胞培养板置于37 ℃培养箱静置24 、48 和72 h。弃去上清液, 并采用无菌PBS 缓冲液清洗细胞培养板, 每孔加入0.2%结晶紫染色液250 μL, 染色30 min, 待完全干燥后每孔加入95%乙醇200 μL, 使其与生物膜结合的结晶紫完全溶解。参照COSMO ANDRADE 等[8]的方法采用酶标仪检测波长600 nm 处的吸光度(A)值, 以生物膜A 值代表生物膜形成能力, 实验重复6 次并记录。
1.4 细胞实验
1.4.1 黏附实验检测各组黏附细菌量 分别选取各组阴沟肠杆菌进行复苏和传代培养后, 分别感染RAW264.7 细 胞, 感 染 复 数 (multiplicity of infection , MOI) 为100, 置 于37 ℃、5% CO2细胞培养箱中孵育3 和24 h, 加入胰酶和细胞裂解液充分裂解细胞和消化细胞。各取100 μL 稀释液均匀涂布于哥伦比亚血平板上, 于37 ℃、5% CO2细胞培养箱中过夜培养。计数细菌量作为黏附细菌量, 重复3 次并记录。
1.4.2 侵袭实验 与上述“1.4.1”中“黏附实验”步骤相同, 分别感染RAW264.7 细胞(MOI=100), 37℃、5% CO2细胞培养箱中孵育3 和24 h。3 h 后直接每孔加入100 mg·L-1庆大霉素溶液, 继续培养2 h 后, 每孔加入200 μL 胰酶消化细胞3~10 min, 吸弃胰酶, 于37 ℃、5% CO2细胞培养箱中培养。计数细菌量作为侵入细胞的菌量, 重复3 次并记录。计算3 和24 h 时黏附率和侵袭黏附比, 反映耐药基因blaNDM-1 对阴沟肠杆菌黏附和侵袭能力的影响。细胞黏附率=(黏附细菌数/感染细菌数)×100%;侵袭黏附比=侵入细胞的细菌数/黏附细胞的细菌数。
1.5 统计学分析
采用SPSS 20.0 统计软件进行统计学分析。各组菌落直径、A 值、细胞黏附率和侵袭黏附比以±s表示, 细胞黏附率组间比较采用χ2检验, 其他指标组间比较Kruskal-WallisU检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 质粒稳定性
传代200 次后, T2 仍携带blaNDM-1 基因, ΔT2 和ATCC13047 不携带blaNDM-1 基因, 表明携带blaNDM-1 基因的质粒未丢失, 稳定存在。见图1。
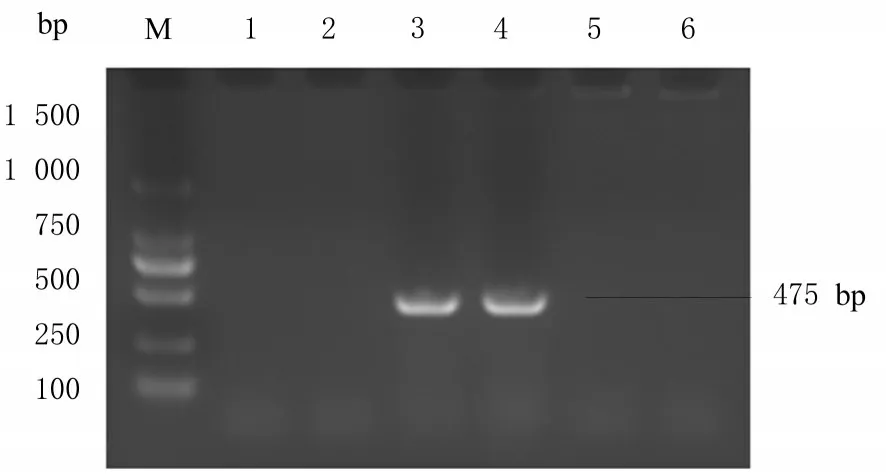
图1 PCR 法鉴定各组阴沟肠杆菌中的耐药基因blaNDM-1 表达Fig.1 Expressions of drug resistance gene blaNDM-1 in Enterobacter cloacae in various groups identified by PCR method
2.2 各组阴沟肠杆菌的生物学特性
2.2.1 各组阴沟肠杆菌的耐药基因和毒力基因
T2 组阴沟肠杆菌仅携带碳青霉烯类耐药基因blaNDM-1, 其他碳青霉烯类耐药基因blaKPC-2、blaIMP-4、 blaVIM-1 和 blaOXA-48 均 为 阴 性, ΔT2 和ST 组所检测的5 种碳青霉烯类耐药基因均为阴性;T2 与ΔT2 组阴沟肠杆菌携带相同的毒力基因clpB、icmf 和acrA, 其他毒力基因VasD/Lip、wcam、fimH、mrkD、mrkB 和csgB 均为阴性, ST 组阴沟肠杆菌中毒力基因clpB、icmf、acrA、VasD/Lip 和wcam 为阳性, 未检测出fimH、mrkD、mrkB 和csgB。
2.2.2 各组菌落的运动直径 T2 组菌落的运动直径为(0.785±0.127) cm, ΔT2 组菌落的运动直径为(1.445±0.255) cm, ATCC13047 组菌落的运动直径为(1.370±0.270) cm, T2 组菌落运动直径小于ΔT2 和ST 组(P<0.05)。
2.2.3 各组阴沟肠杆菌生物膜形成能力 在3 个时间点(24、48 和72 h), T2 与ΔT2 组阴沟肠杆菌生物膜A 值比较差异无统计学意义(P>0.05), 但T2、ΔT2 和ST 组阴沟肠杆菌生物膜A 值均高于LB 组(P<0.05)。见表1。
表1 不同时间点各组阴沟肠杆菌生物膜A 值Tab. 1 A values of biofilm of Enterobacter cloacae in various groups at different time points (n=6,±s)
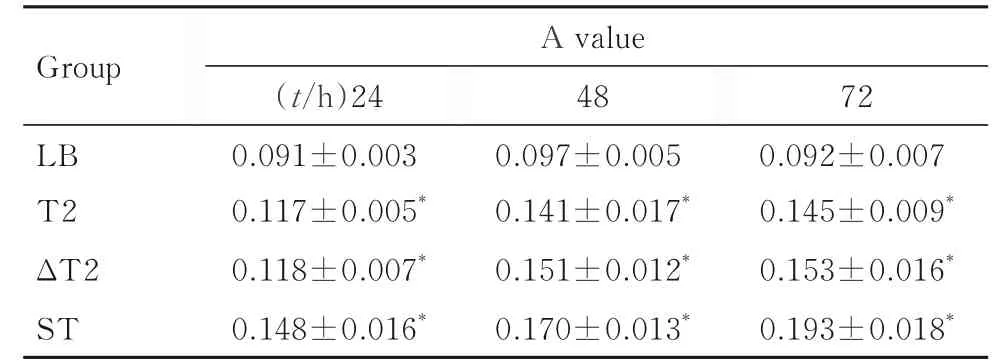
表1 不同时间点各组阴沟肠杆菌生物膜A 值Tab. 1 A values of biofilm of Enterobacter cloacae in various groups at different time points (n=6,±s)
*P<0.05 vs LB group.
Group A value 72 0.092±0.007 0.145±0.009*0.153±0.016*0.193±0.018*48 0.097±0.005 0.141±0.017*0.151±0.012*0.170±0.013*(t/h)24 0.091±0.003 0.117±0.005*0.118±0.007*0.148±0.016*LB T2 ΔT2 ST
2.3 各组黏附细菌量
在阴沟肠杆菌与巨噬细胞共培养3 h 后, ΔT2组 黏 附 细 菌 量 分 别 为21×104、34×104和26×104CFU, 黏附比平均值为0.003;T2 组黏附细菌量分别为37×104、25×104和32×104CFU, 黏附比平均值为0.003;ST 组黏附细菌量分别为46×104、38×104和41×104CFU, 黏 附 比 平 均 值 为0.004。统计学分析结果显示:ΔT2 组与ST 组黏附细菌量比较差异有统计学意义(P=0.019), 但其他各组黏附细菌量比较差异均无统计学意义(P>0.05)。在阴沟肠杆菌与巨噬细胞共培养3 h后, ΔT2 组侵袭RAW264.7 细胞的细菌量分别为150、 250 和350 CFU, 侵 袭 黏 附 比 平 均 值 为0.001;T2 组侵袭RAW264.7 细胞的细菌量分别为300、350 和350 CFU, 侵袭黏附比平均值为0.001;ΔT2 组RAW264.7 细胞的侵袭黏附比高于ST 组(P<0.05);共培养24 h 后, T2 组和ΔT2 组RAW264.7 细胞的黏附率和侵袭黏附比低于ST 组(P<0.05)。见表2。
表2 不同时间点各组RAW264.7 细胞黏附率和侵袭黏附比Tab.2 Adhesion rates and invasion adhesion ratios of RAW264.7 cells in various groups at different time points(n=6,±s)

表2 不同时间点各组RAW264.7 细胞黏附率和侵袭黏附比Tab.2 Adhesion rates and invasion adhesion ratios of RAW264.7 cells in various groups at different time points(n=6,±s)
*P<0.05 vs ST group.
Group Adhesion rate (η/%)(t/h)3 0.004 0±0.000 0 0.003 0±0.001 0 0.027 0±0.001 0*24 1.770 0±0.010 0 1.490 0±0.110 0*1.420 0±0.020 0*ST T2 ΔT2 Invasion adhesion ratio(t/h)3 0.000 9±0.005 0 0.001 1±0.003 0 0.000 9±0.004 0 24-2.900 0±0.170 0-2.350 0±0.330 0*-2.250 0±0.050 0*
3 讨 论
阴沟肠杆菌是一种革兰阴性杆菌, 广泛存在于自然界中, 在人和动物的粪便水、泥土和植物中可检出, 是肠道正常菌种之一, 可引起多种感染, 并常导致新生儿院内感染的暴发流行[9]。碳青霉烯类耐药阴沟肠杆菌逐渐增多[10], 随着头孢菌素的广泛使用, 阴沟肠杆菌已成为医院感染越来越重要的病原菌, 其引起的细菌感染性疾病常累及多个器官, 包括皮肤软组织感染、泌尿道感染、呼吸道感染和败血症等。由于阴沟肠杆菌的β-内酰胺酶和头孢菌素酶耐药情况严重, 给临床治疗带来了新的挑战。有研究[11-12]显示:在国内碳青霉烯类耐药阴沟肠杆菌以产NDM-1 为主, 其载体质粒一般为IncX3、 IncFⅡ和IncC 型, 因此迫切需要寻找除替加环素、多黏菌素和磷霉素以外的能治疗产NDM-1 细菌引起感染的新型药物。与碳青霉烯类敏感肠杆菌目细菌感染引起的低死亡率比较, 由产NDM-1 的肠杆菌目细菌引起感染的死亡率通常更高[13-15]。另外, 有研究[17]显示:blaNDM-1 基因不仅会赋予细菌相应的耐药性, 还能增加细菌的毒力, 这可能其与六型分泌系统(type Ⅵsecretion system, T6SS)有关。这可能促使高毒力高耐药菌株的形成, 因此本研究旨在细胞水平探讨blaNDM-1 基因对阴沟肠杆菌毒力的影响, 有望助力临床感染防控。
碳青霉烯类耐药基因检测结果表明:T2 组阴沟肠杆菌仅携带blaNDM-1 基因, ΔT2 组和ST 组所检测的5 种碳青霉烯类耐药基因均为阴性, 说明blaNDM-1 基因敲除株构建成功, 同时排除了其他耐药基因对毒力表型的影响。毒力基因检测结果表明:T2 与ΔT2 组阴沟肠杆菌携带相同的毒力基因clpB、icmf 和acrA, 其他检测的毒力基因均为阴性, 表明blaNDM-1 基因可能并不影响阴沟肠杆菌毒力基因的表达。
本研究中菌落运动直径检测结果显示:携带blaNDM-1 基因会减弱阴沟肠杆菌的运动能力, 这与HUANG 等[18]的研究结果一致, 即blaNDM-1基因会影响细菌的运动能力, 其作用机制可能是携带blaNDM-1 基因的质粒IncX3 所携带的HNS 基因可以影响细菌的运动[19]。生物膜形成实验结果表明:blaNDM-1 不影响阴沟肠杆菌生物膜的形成, 且T2 和ΔT2 的生物膜形成能力均弱于ST 组, 这与LEE 等[20]和CUSUMANO 等[21]的 结 论 一 致, 可能是由于生物膜形成和抗菌药物耐药性之间存在负相关关系。余艳[22]研究显示:blaNDM-1 对生物的形成无影响。因此blaNDM-1 基因对生物学特性的影响为减弱阴沟肠杆菌的运动直径, 但不影响生物膜的形成。
本研究结果表明:blaNDM-1 基因不影响阴沟肠杆菌对巨噬细胞RAW264.7 的毒力作用, ΔT2与ST 组检出毒力基因差异可能是由于ST 株携带的其他毒力基因(clpB、icmf、acrA、VasD/Lip 和wcam) 引起的, 表明blaNDM-1 基因不影响其在巨噬细胞中的生存。这与GÖTTIG 等[23]的研究结果一致, 表明耐药基因blaNDM-1 并不影响阴沟肠杆菌的毒力。
综上所述, blaNDM-1 基因可减弱阴沟肠杆菌的运动能力, 但对其生物膜形成能力及小鼠巨噬细胞RAW264.7 的黏附和侵袭能力无影响, 表明blaNDM-1 基因对阴沟肠杆菌的毒力无影响, 为blaNDM-1 基因是否增加或减弱细菌毒力的研究提供了依据。

