丝胶对高糖所致足细胞损伤和JNK 信号通路的影响
刘东慧, 张明溪, 付文亮, 付秀美, 宋成军, 陈志宏
(承德医学院人体解剖学教研室, 河北 承德 067000)
糖尿病肾病(diabetic nephropathy, DN)是一种以持续蛋白尿和肾小球滤过率进行性下降为主要特征的临床综合征, 目前已成为糖尿病最常见和最严重的慢性并发症之一[1-2]。足细胞属于高分化上皮细胞, 是位于肾小球滤过屏障最外层的关键组成部分, 其结构或功能损伤均会导致蛋白尿的产生, 进而影响DN 的发生发展[3-5]。因此, 探讨足细胞的损伤机制已成为防治DN 的新方向。研究[6]显示:足细胞被高糖刺激后, 其c-Jun 氨基末端激酶(c-Jun N-terminal kinase, JNK) 信号通路可被激活, 激活后的JNK 信号通路可进一步加速诱导足细胞的损伤和凋亡, 进而参与DN 的进展。
祖国传统医学认为“消肾”是由“消渴”发展而来, 治疗时当虚实兼顾, 并有蚕茧汤方治疗消渴的记载[7], 蚕茧汤方即蚕茧煮水, 其主要成分为丝胶。丝胶是蚕茧中提取的一种含丰富亲水基团的天然水溶性蛋白, 主要由丝氨酸、谷氨酸和天冬氨酸等18 种氨基酸组成, 具有抗炎、抗氧化、低免疫原性和可生物降解等特点[8-9]。本课题组[10-11]前期仅观察了丝胶的降血糖及对糖尿病肾损伤的保护作用, 为深入探讨其具体作用机制, 本研究建立高糖诱导足细胞损伤模型, 以丝胶作为干预药物, 通过观察足细胞的形态表现, 检测丝裂原活化蛋白激酶激 酶1 (mitogen-activated protein kinase kinase 1, MEKK1)、丝裂原活化蛋白激酶激酶4(mitogenactivated protein kinase kinase 4, MEKK4)、c-Jun氨基末端激酶1(c-Jun N-terminal kinase 1, JNK1)和c-Jun 的表达及足细胞的凋亡率, 探讨丝胶对高糖所致的足细胞损伤的保护作用是否通过调控JNK信号通路中上述因子的表达来实现, 为进一步探讨丝胶在糖尿病肾损伤中的作用机制并为开发防治DN 的靶向药物提供参考。
1 材料与方法
1.1 细胞、主要试剂和仪器条件永生化小鼠足细胞MPC5 (上海中乔新舟生物科技有限公司)。RPMI-1640 无糖培养基(武汉普诺赛科技有限公司), 丝胶(美国Sigma 公司), 兔抗β-actin 单克隆抗体(美国ABclonal 公司), 兔抗GAPDH 单克隆抗体(美国BD 公司), 兔抗裂孔膜蛋白(Nephrin)、MEKK1、MKK4、JNK1 和c-Jun 单克隆抗体(美国Abcam 公司), PCR 引物(广州复能基因有限公司), mRNA 提取试剂盒(百代生物科技有限公司), cDNA 第一链合成试剂盒和荧光定量扩增试剂盒(北京天根生化科技有限公司), 凋亡试剂盒(江苏凯基生物技术有限公司)。倒置显微镜(德国Leica 公司), DYY-6B 型稳压稳流转移电泳仪(北京市六一仪器厂), Mx3000P 实时荧光定量PCR(real-time fluorescent quantitative PCR, RT-qPCR)仪(上海吉泰生物科技有限公司), 流式细胞仪(美国BD FACSCalibur 公司)。
1.2 细胞培养将条件永生化小鼠足细胞置于33 ℃、5%CO2培养箱中, 采用含γ-干扰素的RPMI-1640 无糖培养基培养使其增殖, 传代后将足细胞在37 ℃、5% CO2培养箱中采用去除γ-干扰素的上述培养基继续培养7~14 d, 诱导其分化, 取成熟的足细胞用于后续实验。
1.3 细胞分组和处理方式将分化成熟处于对数生长期的足细胞同步化处理12 h 后随机分为正常对照组、高渗对照组、高糖组、低浓度丝胶组、中浓度丝胶组和高浓度丝胶组。各组培养基中葡萄糖浓度 分 别 为5.5、 5.5、 30.0、 30.0、 30.0 和30.0 mmol·L-1, 其中高渗对照组、低浓度丝胶组、中浓度丝胶组和高浓度丝胶组培养基在上述基础上分别加入24.5 mmol·L-1甘露醇、150.0 mg·L-1丝胶、300.0 mg·L-1丝 胶 及600.0 mg·L-1丝 胶, 各组足细胞均在相应培养基中培养48 h。
1.4 光学倒置显微镜观察各组足细胞形态表现
各组足细胞在相应培养基中培养后, 采用PBS缓冲液洗涤, 将放有足细胞的6 孔细胞培养板置于光学倒置显微镜下观察各组足细胞形态表现。
1.5 RT-qPCR 法检测各组细胞中Nephrin、MEKK1、MKK4、JNK1 和c-Jun mRNA 表 达 水 平
采用预冷的PBS 缓冲液清洗足细胞后提取总RNA, 测定纯度和浓度并去除基因组DNA 后反转录成cDNA, 置于-20 ℃保存备用。以各组足细胞cDNA 为模板, 采用RT-qPCR 法扩增Nephrin、MEKK1、MKK4、JNK1、c-Jun 和GAPDH 片 段, 实验重复3 次。以GAPDH 为内参对照, 采用2-△△Ct法计算各目的基因mRNA 表达水平。
1.6 Western blotting 法检测各组足细胞中Nephrin、MEKK1、MKK4、JNK1 和c-Jun 蛋白表达水平采用预冷的PBS 缓冲液洗涤足细胞后, 加入蛋白裂解液, 采用反复冻融法提取总蛋白, BCA 法进行定量后取30 μg 总蛋白上样, 10%凝胶电泳、转膜(丽春红染膜验证转膜是否成功)、封闭过夜、加入Nephrin、MEKK1、MKK4、JNK1、c-Jun、β-actin 和GAPDH 一抗(稀释比例分别为1∶1 000、1∶5 000、1∶1 000、1∶6 000、1∶6 000、1∶10 000 和1∶10 000) 室温摇床孵育2 h、加入二抗(稀释比例均为1∶10 000) 室温摇床孵育1.5 h、洗膜、显影, 实验重复3 次。采用Quantity One-v 4.6.2 软件分析蛋白条带灰度值, 以目的蛋白条带灰度值与相应内参条带灰度值的比值作为目的蛋白表达水平。
1.7 Annexin Ⅴ/PI 双染法检测各组足细胞凋亡率采用预冷的PBS 缓冲液清洗足细胞后, 加入不含EDTA 的胰酶消化完全并制备细胞混悬液, 过滤、计数后将足细胞置于流式管中, 室温离心(1 000 r·min-1、5 min)2 次后加入Binding Buffer、Annexin V-FITC 和PI, 轻柔混匀, 室温避光孵育15 min。采用流式细胞术检测各组足细胞凋亡率。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.8 统计学分析采用SPSS 21.0 统计软件进行统计学分析。各组足细胞中Nephrin、MEKK1、MKK4、JNK1 和c-Jun mRNA 及蛋白的表达水平以及足细胞凋亡率均符合正态分布, 以±s表示, 多组间样本均数比较采用单因素方差分析, 组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组足细胞形态表现正常对照组足细胞胞体较大, 并延伸生出树枝状突起;与正常对照组比较, 高糖组足细胞胞体回缩变小, 细胞间隔增大, 脱落和悬浮的足细胞数增多;与高糖组比较, 不同浓度丝胶组足细胞形态更逐渐趋于正常对照组。光学倒置显微镜下观察各组足细胞形态表现见图1。
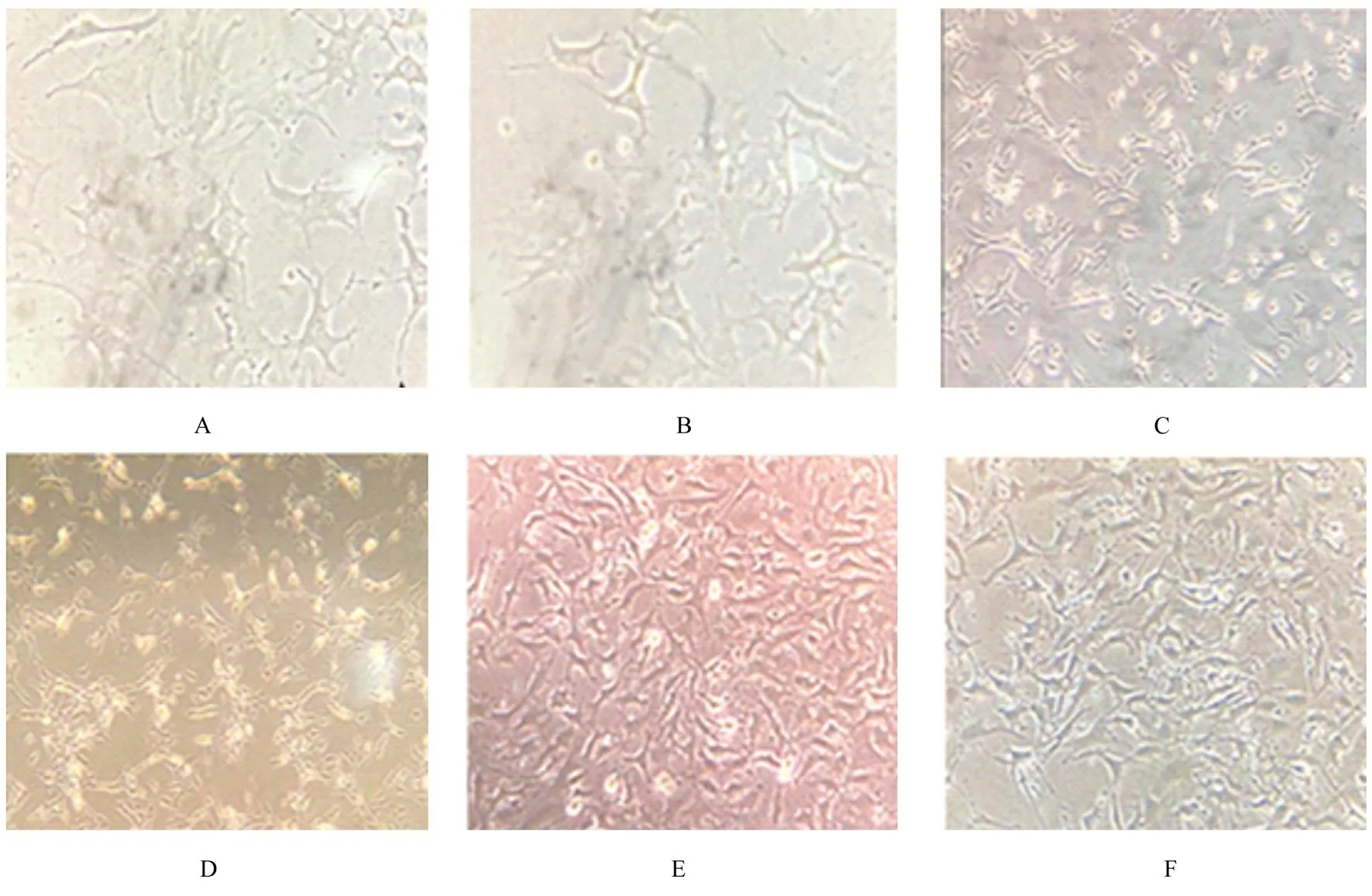
图1 各组足细胞形态表现(×400)Fig.1 Morphology of podocytes in various groups(×400)
2.2 各组足细胞中Nephrin、MEKK1、MKK4、JNK1 和c-Jun mRNA 及蛋白表达水平高糖组足细胞中Nephrin mRNA 和蛋白表达水平较正常对照组均明显降低(P<0.05), 表明成功建立高糖致足细胞损伤模型;不同浓度丝胶组足细胞中Nephrin mRNA 和蛋白表达水平较高糖组均明显升高(P<0.05), 且不同浓度丝胶组足细胞中Nephrin mRNA 和蛋白表达水平两两比较差异均有统计学意义(P<0.05)。与正常对照组比较, 高糖组足细胞中MEKK1、MKK4、JNK1 和c-Jun mRNA 及蛋白表达水平均明显升高(P<0.05);与高糖组比较, 不同浓度丝胶组足细胞中MEKK1、MKK4、JNK1 和c-Jun mRNA 及蛋白表达水平均明显降低(P<0.05), 且不同浓度丝胶组足细胞中Nephrin mRNA 和蛋白表达水平两两比较差异均有统计学意义(P<0.05)。见图2、图3 和表1。
表1 各组足细胞中Nephrin、MEKK1、MKK4、JNK1 和c-Jun mRNA 及蛋白表达水平Tab.1 Expression levels of Nephrin, MEKK1, MKK4, JNK1, and c-Jun mRNA and proteins in podocytes in various groups(n=3,±s)
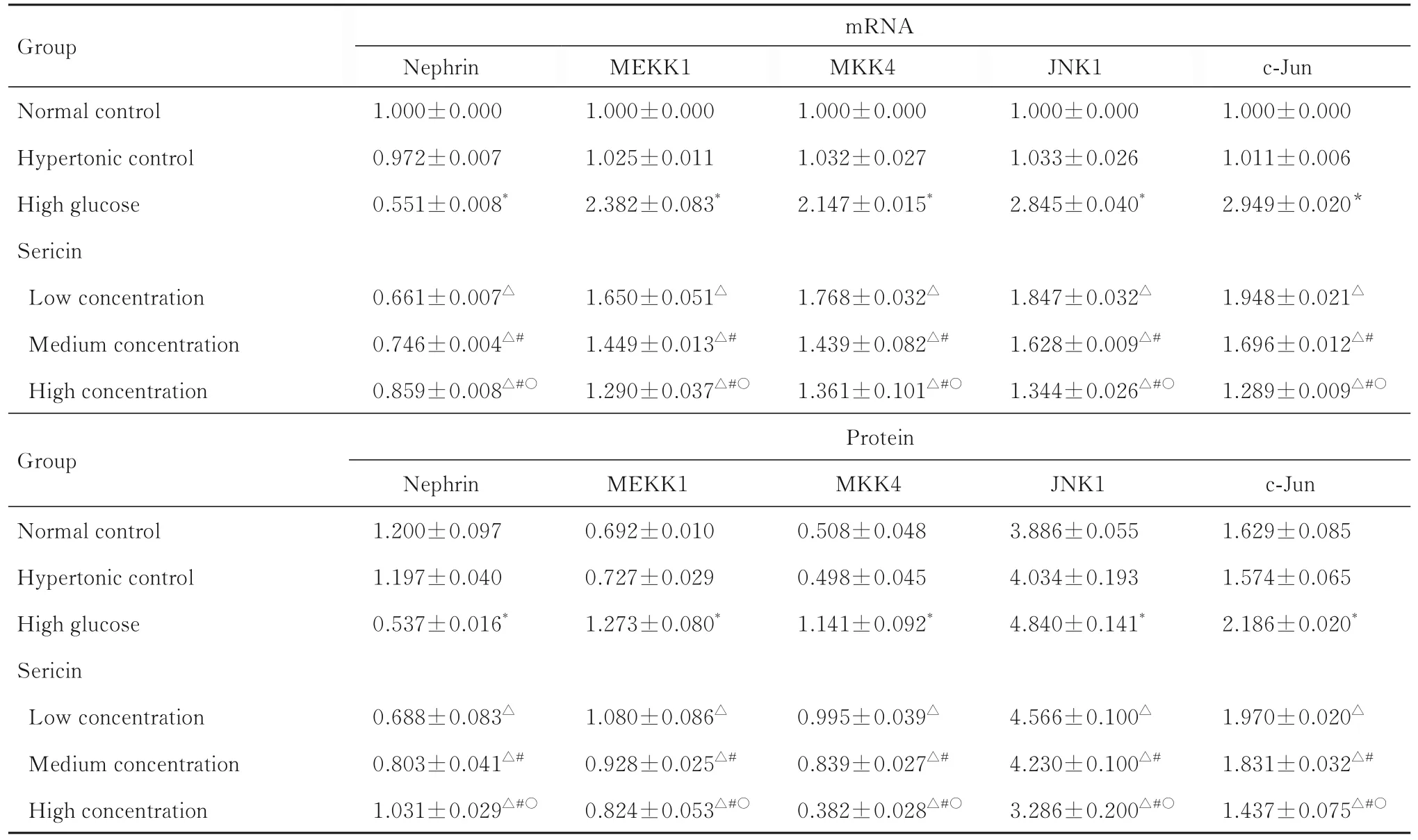
表1 各组足细胞中Nephrin、MEKK1、MKK4、JNK1 和c-Jun mRNA 及蛋白表达水平Tab.1 Expression levels of Nephrin, MEKK1, MKK4, JNK1, and c-Jun mRNA and proteins in podocytes in various groups(n=3,±s)
*P<0.05 compared with normal control group;△P<0.05 compared with high glucose group;#P<0.05 compared with low concentration of sericin group;○P<0.05 compared with medium concentration of sericin group.
Group Normal control Hypertonic control High glucose Sericin Low concentration Medium concentration High concentration Group Normal control Hypertonic control High glucose Sericin Low concentration Medium concentration High concentration mRNA Nephrin 1.000±0.000 0.972±0.007 0.551±0.008*0.661±0.007△0.746±0.004△#0.859±0.008△#○Protein Nephrin 1.200±0.097 1.197±0.040 0.537±0.016*0.688±0.083△0.803±0.041△#1.031±0.029△#○MEKK1 1.000±0.000 1.025±0.011 2.382±0.083*1.650±0.051△1.449±0.013△#1.290±0.037△#○MEKK1 0.692±0.010 0.727±0.029 1.273±0.080*1.080±0.086△0.928±0.025△#0.824±0.053△#○MKK4 1.000±0.000 1.032±0.027 2.147±0.015*1.768±0.032△1.439±0.082△#1.361±0.101△#○MKK4 0.508±0.048 0.498±0.045 1.141±0.092*0.995±0.039△0.839±0.027△#0.382±0.028△#○JNK1 1.000±0.000 1.033±0.026 2.845±0.040*1.847±0.032△1.628±0.009△#1.344±0.026△#○JNK1 3.886±0.055 4.034±0.193 4.840±0.141*4.566±0.100△4.230±0.100△#3.286±0.200△#○c-Jun 1.000±0.000 1.011±0.006 2.949±0.020*1.948±0.021△1.696±0.012△#1.289±0.009△#○c-Jun 1.629±0.085 1.574±0.065 2.186±0.020*1.970±0.020△1.831±0.032△#1.437±0.075△#○
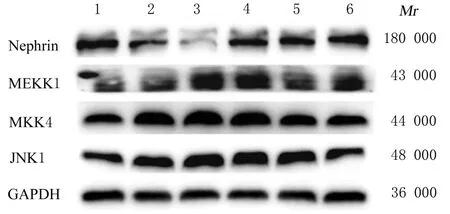
图2 Western blotting 法检测各组足细胞中Nephrin、MEKK1、MKK4 和JNK1 蛋白表达电泳图Fig.2 Electrophoregram of Nephrin, MEKK1, MKK4,and JNK1 proteins in podocytes in various groups detected by Western blotting method
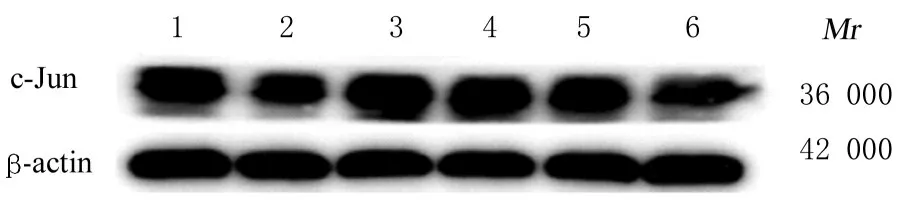
图3 Western blotting 法检测各组足细胞中c-Jun 蛋白表达电泳图Fig.3 Electrophoregram of c-Jun protein in podocytes in various groups detected by Western blotting method
2.3 各组足细胞凋亡率与正常对照组比较, 高糖组和高渗对照组足细胞凋亡率明显升高(P<0.05);与高糖组比较, 不同浓度丝胶组足细胞凋亡率明显降低(P<0.05)。见图4 和表2。
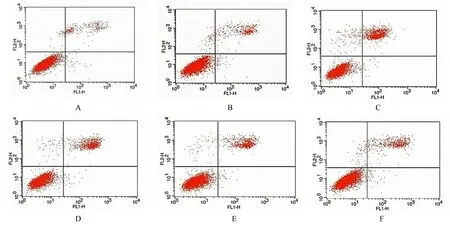
图4 AnnexinⅤ/PI 双染法检测各组足细胞凋亡率Fig.4 Apoptotic rates of podocytes in various groups detected by Annexin Ⅴ/PI double staining method
表2 各组足细胞凋亡率Tab.2 Apoptotic rates of podocytes in various groups(n=3, ±s, η/%)
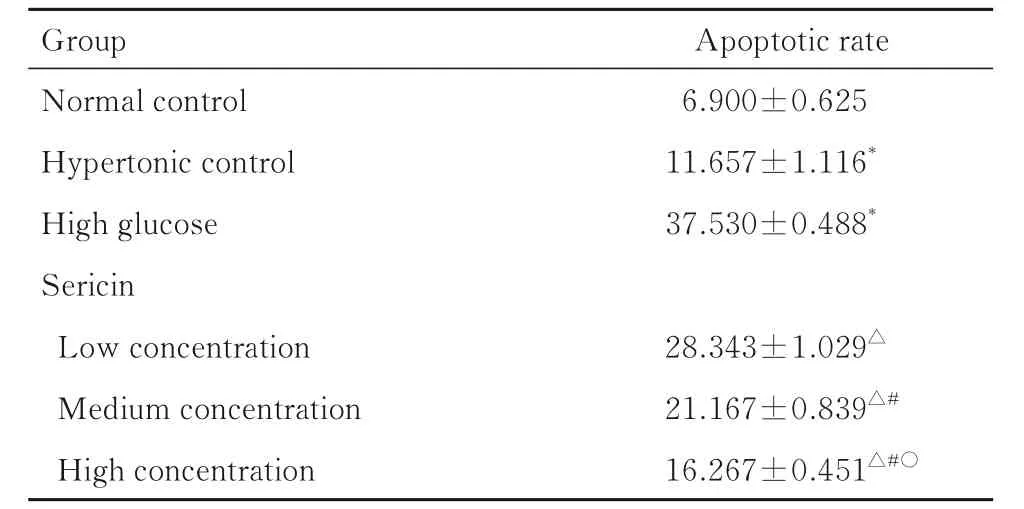
表2 各组足细胞凋亡率Tab.2 Apoptotic rates of podocytes in various groups(n=3, ±s, η/%)
*P<0.05 compared with normal control group;△P<0.05 compared with high glucose group;#P<0.05 compared with low concentration of sericin group;○P<0.05 compared with medium concentration of sericin group.
Group Normal control Hypertonic control High glucose Sericin Low concentration Medium concentration High concentration Apoptotic rate 6.900±0.625 11.657±1.116*37.530±0.488*28.343±1.029△21.167±0.839△#16.267±0.451△#○
3 讨 论
肾小球滤过屏障由足细胞、肾小球基底膜和内皮细胞共同构成, 其中足细胞作为屏障的最后一道防线, 在对蛋白质等大分子物质的滤过过程中发挥重要作用[12-13]。足细胞属于高分化细胞, 因其有限的再生能力, 一旦受损将会导致肾小球滤过屏障的功能受到不可逆的损伤[14], 因此其结构或功能的破坏将成为影响DN 发生发展的关键因素之一。研究[15]显示:在高糖刺激下, 足细胞会出现数量减少和足突融合蛋白表达降低等病理变化。本研究采用高浓度葡萄糖培养足细胞, 结果显示:高糖组足细胞中Nephrin mRNA 和蛋白表达水平较正常对照组均明显降低, 表明高糖致足细胞损伤模型建立成功。
JNK 信号通路是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 通路的重要分支之一, 具有调控多种细胞增殖、分化和凋亡等作用, 其活化过程具有3 级激酶级联反应的特点:即MAPK 激酶激酶(MAPKKK 或MEKK)→MAPK 激酶 (MAPKK、 MEK 或 MKK) →MAPK。在高糖环境刺激下, 具有丝氨酸/苏氨酸激酶活性的MEKK1 活化后可直接激活MKK, MKK 家族中作为下游JNK 的特异性激酶的MKK4、MKK7 可分别通过磷酸化JNK 的第185 和183 位酪氨酸残基而激活JNK[16]。本研究选取JNK信号通路3 级激酶中的MEKK1、MKK4 和JNK1 作为观察指标, 研究结果显示:高糖组足细胞中MEKK1、MKK4 和JNK1 mRNA及蛋白表达水平变化一致, 均较正常对照组明显升高, 说明在高糖刺激下, 足细胞中JNK 信号通路的激酶级联反应被依次激活。JNK 活化后通过调控其结构域而产生1 个新的功能性活性位点, 并由胞浆转移至胞核继续作用于其下游底物c-Jun[17]。c-Jun 是激活蛋白1复合体的重要组成部分之一, 激活的JNK 与c-Jun的氨基末端区域结合使其第63 和73 位丝氨酸残基磷酸化后, 进一步提高了激活蛋白1 复合体的转录活性, 继而通过活化促凋亡因子、抑制抗凋亡因子的表达而发挥促凋亡作用[18-20]。本研究结果显示:高糖组足细胞中c-Jun mRNA 和蛋白的表达水平及足细胞凋亡率均较正常对照组明显升高, 且光学倒置显微镜下观察到高糖组足细胞脱落、悬浮明显增多的现象, 说明在高糖作用下足细胞中JNK 信号通路中激酶级联反应发生后可进一步通过c-Jun 发挥促凋亡作用。
DN 是一种致死性的糖尿病慢性并发症, 一旦发展到终末期肾病阶段, 常出现严重且复杂的代谢紊乱现象, 导致临床治疗效果较差。目前, 尽管临床对DN 的治疗采用降糖、降压、降脂和抗炎等综合型治疗措施, 但仍有部分DN 患者会最终发展到终末期肾病状态[21-23]。因此, 寻找可保护肾脏且能有效降糖的药物显得尤为迫切。结合祖国传统医学有关蚕茧汤方治疗消渴的记载和本课题组前期研究成果, 本研究采用丝胶作为高糖致足细胞损伤模型的干预药物, 对丝胶降血糖和保护肾脏的作用机制进行深入研究的结果显示:丝胶能抑制高糖致损伤的 足 细 胞 中MEKK1、 MKK4、 JNK1 和c-Jun mRNA 及蛋白的表达, 并降低足细胞凋亡率, 进而减轻高糖所致的足细胞损伤程度, 且减轻程度随丝胶浓度的增加而增大, 最终使得足细胞形态逐渐趋于正常。
综上所述, 丝胶对高糖所致的足细胞损伤具有保护作用, 其机制可能与其抑制JNK 信号通路中MEKK1、MKK4、JNK1 和c-Jun 的表达及降低足细胞凋亡率有关。

