小鼠肝缺血再灌注后STIM1表达与肝损伤的关系
李艳阳,王玉杰
(河南大学淮河医院 儿科,河南 开封 475000)
在创伤、择期肝切除、休克或肝移植过程中,肝缺血再灌注(ischemia reperfusion,IR)损伤是不可避免的,不利于患者治疗及预后[1-2]。IR包括局部缺血损伤和炎症调节的再灌注损伤2个相互关联的阶段[3]。肝IR损伤涉及冷、热缺血。冷缺血发生在移植后的肝保存过程中[4]。当机体经历休克、创伤以及选择性肝切除术时,就会发生热缺血[5]。为了提高肝IR损伤患者的治疗效果,改善预后,研究IR潜在机制并找到有效治疗策略是非常必要的。
肝IR损伤是一个复杂的多因素病理生理过程,涉及炎症细胞因子、活性氧(reactive oxygen species,ROS)和细胞凋亡[2-5]。ROS诱导Kupffer细胞活化,产生大量的炎症细胞因子和氧自由基,进一步加重肝损伤[6]。Ca2+作为一种普遍存在的第二信使,参与多种细胞功能,例如氧化应激、炎症、能量代谢和细胞凋亡[7]。氧化剂和Ca2+是病理生理环境中血管信号传导的重要调节剂,包括自身免疫性炎症[8]。STIM蛋白是Ca2+存储传感器,介导多种应激条件下的细胞应答,包括ROS升高和低氧[9]。然而,基质相互作用分子1(stromal interaction molecule 1,STIM1)是否可以作为参与肝IR损伤的调节剂仍有待讨论。因此,本研究对STIM1-/-小鼠建立IR损伤模型,以研究其是否可以作为改善肝IR损伤的治疗靶点。
1 材料与方法
1.1 动物实验实验对象为8~10周龄成年雄性C57/BL6小鼠,分为野生型(wild type, WT)和STIM1缺陷型(STIM1-/-)。每组8只小鼠,所有小鼠在温度为(25±2)℃、湿度为(50±5)%的环境中成长,给予12 h/12 h照明/黑暗循环并允许自由进食和饮水。热缺血1 h后,在再灌注0、3、6、12和24 h处死小鼠,建立小鼠部分(70%)热IR损伤模型[4]。所有动物程序按照1996年美国国立卫生研究院发布并经河南大学淮河医院动物护理和使用委员会批准的《实验动物护理和使用指南》进行。
1.2 细胞与培养参考文献分离出小鼠Kupffer细胞[10]。用氯胺酮(100 mg·kg-1)和甲苯噻嗪(10 mg·kg-1)麻醉小鼠,使用胶原酶灌注肝。体外37 ℃下,使用胶原酶消化20 min后使用250 μm细胞过滤器过滤。4 ℃下进行25%和50% Percoll梯度离心,以800×g离心1 h后,收集非实质肝细胞并在含有体积分数10%胎牛血清的DMEM中培养。清洗非黏附部分,保留黏附的Kupffer细胞。使用Lipo2000转染试剂(美国英杰生物公司)将siRNA(由上海捷瑞生物工程有限公司合成)转染到Kupffer细胞中。
1.3 RT-qPCR分析使用TRIzol Reagent试剂盒(日本Takara公司)提取肝和细胞中的总RNA。使用SYBRPremix Ex Taq试剂盒(中国宝日医生物工程有限公司)将总RNA逆转录为cDNA,SYBR Green定量RT-PCR检测靶基因的表达。
1.4 蛋白质印迹分析加入含有蛋白酶抑制剂的裂解液后从肝组织和细胞中提取蛋白质。定量后将蛋白质在金属浴中加热(95 ℃,5 min)以充分变性。蛋白质样品通过10%~12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,并转移到聚偏二氟乙烯膜(美国密理博公司)。用50 g·L-1的脱脂牛奶室温封闭聚偏二氟乙烯膜2 h后,4 ℃过夜孵育一抗:兔抗STIM1(ab1089945)、p-NF-κB(ab222494)、NF-κB(ab16502)、HO1(ab52947)、Nrf2(ab137550)、NFAT1(ab150330)、Orai1(ab59330)、Caspase-3(ab13586)和GAPDH(ab8245)。室温孵育二抗1 h后对膜进行显色。所有抗体均以1∶1 000稀释。
1.5 病理组织切片制作及免疫组化分析切除小鼠肝样本,采用体积分数为4%的甲醛溶液固定,常规脱水浸蜡、石蜡包埋、切片(4 μm),脱蜡透明后进行常规HE染色。切片用体积分数10%的山羊血清阻断非特异性抗原后在4 ℃下与STIM1抗体孵育过夜,对半胱天冬酶-3(1∶100)进行裂解。然后将载玻片与偶联有辣根过氧化物酶二抗在37 ℃下孵育30 min,用二氨基联苯胺试剂盒(北京中杉金桥生物技术有限公司)进行显色,并使用苏木精对细胞核进行复染。通过Suzuki评分法评估HE切片是否显示肝细胞坏死、小叶中心水肿肝窦充血、淤血等。
1.6 生化指标的测量使用建成生物科技有限公司的标准诊断试剂盒检测谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和ROS水平。采用ELISA试剂盒(美国安迪生物公司)检测血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)的水平。
1.7 流式细胞仪分析使用流式细胞术计算荧光钙指示剂呋喃-3-乙酰氧基甲基酯(fura3-acetoxy methyl ester,Fura3-AM)。孵育前,将等量的Fura3-AM(5 μmol·L-1)和pluronic F127添加到HBSS中。用siSTIM1转染24 h后,将细胞再暴露于低氧环境。在37 ℃加湿、黑暗培养箱中加载Fura3-AM培养45 min,PBS洗涤、胰蛋白酶消化后收集细胞,离心沉淀后重悬于HBSS,并引入美国BD公司口径流式细胞仪进行分析。
1.8 体外ROS测量使用荧光探针2’,7’-二氯二氢荧光素二乙酸酯对细胞中的总ROS进行定量。

2 结果
2.1 IR后小鼠肝组织中STIM1的表达增加热缺血1 h后,再灌注0、3、6、12和24 h处死小鼠。在6、12和24 hSTIM1mRNA和蛋白表达水平显著增加(图1A和1B)。IHC结果显示再灌注6、12和24 h后,与Con组对比,STIM1在小鼠肝中高度表达(图1C和1D)。
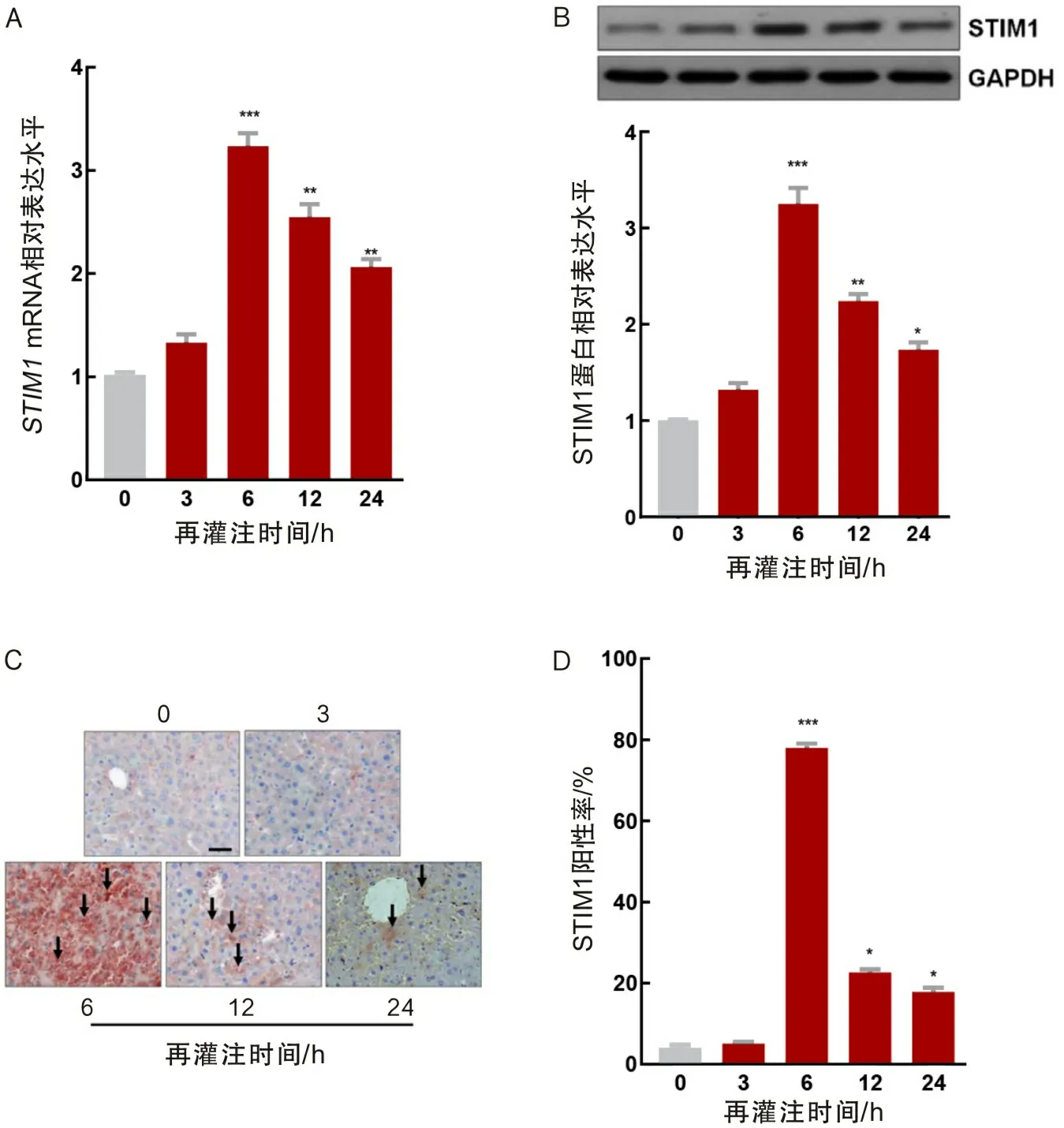
A为RT-qPCR检测;B为免疫蛋白印迹检测;C为IHC分析(SP法,×200);D为IHC分析后量化STIM1阳性水平;*P<0.05,**P<0.01,***P<0.001。图1 小鼠经历IR后肝组织中的STIM1表达
2.2 STIM1缺失减轻肝IR损伤小鼠缺血1 h并再灌注6 h后,经HE染色小鼠肝病理改变(图2A)。再灌注6 h后STIM1敲除小鼠的肝病理改变减轻。与WT/IR组小鼠相比,再灌注6 h后,STIM1-/-小鼠的血清ALT和AST水平显著降低(图2B)。ELISA结果显示在STIM1-/-小鼠肝IR损伤组与WT/IR组小鼠相比,血清促炎细胞因子TNF-α、IL-6和IL-1β水平显著降低(图2C)。RT-qPCR分析显示,与WT/Con组小鼠相比,TNF-α、IL-6、IL-1β、iNOS和COX2mRNA表达增强,而在STIM1-/-小鼠中得到改善(图2F),在p-NF-κB检测中亦得到类似结果(图2H)。图2D、E、G数据表明,WT组小鼠SOD活性降低,MDA和总ROS水平增加,而在STIM1-/-小鼠中得到改善。同时免疫蛋白印迹分析表明,WT/IR小鼠肝中的HO1和Nrf2水平降低,而在STIM1-/-小鼠中显著改善(图2I)。
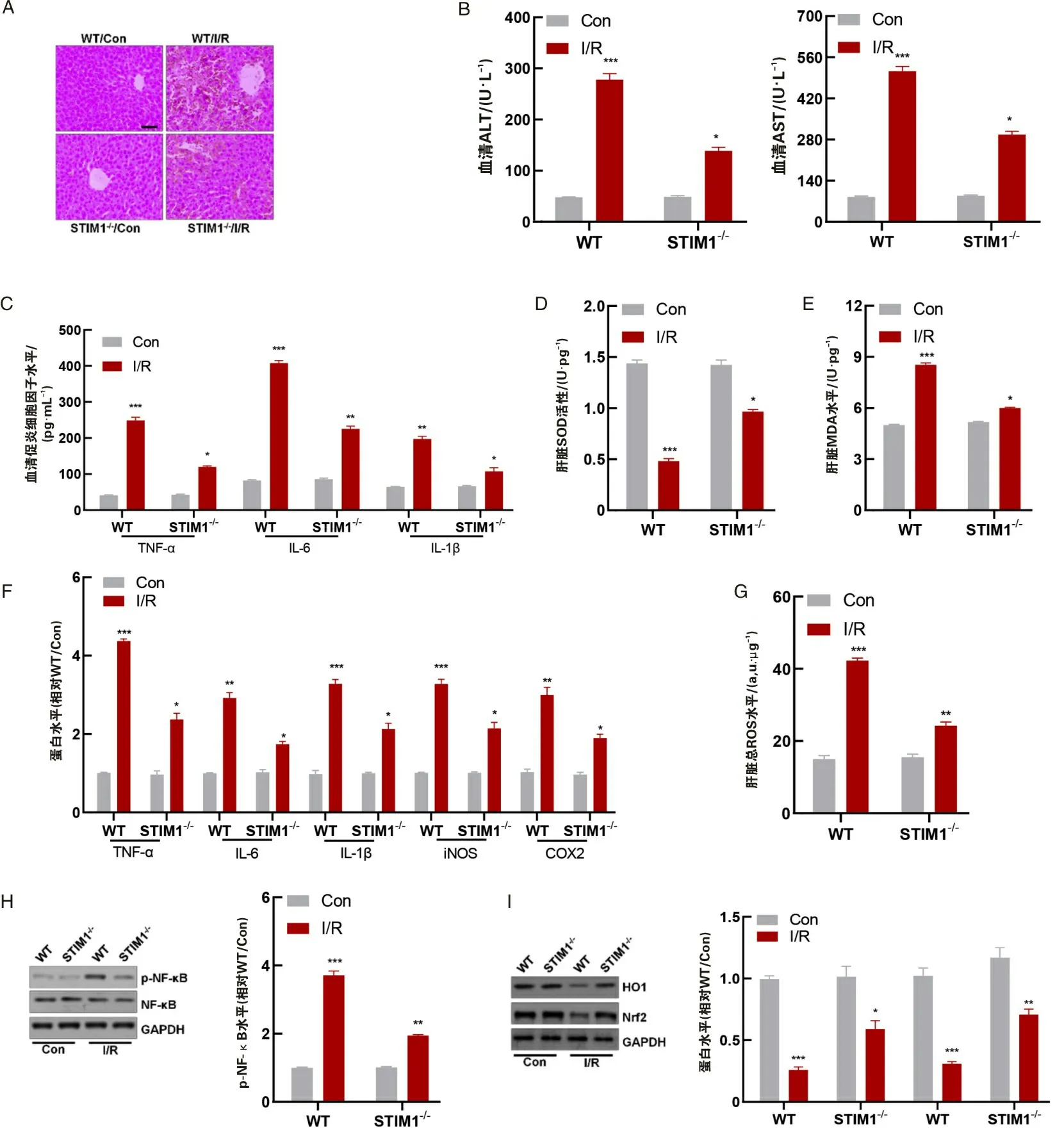
A为小鼠肝HE切片(HE,×200);B为小鼠血清ALT和AST水平;C为?ELISA法检测小鼠血清促炎细胞因子(TNF-α、IL-6和?IL-1β)水平;D为肝SOD活性;E为肝MDA?水平;F为RT-qPCR检测小鼠肝促炎细胞因子;G为总ROS水平;H为小鼠肝中p-NF-κB的免疫蛋白印迹分析;I为小鼠肝中HO1和Nrf2表达水平的免疫蛋白印迹分析。*P<0.05,**P<0.01,***P<0.001。图2 小鼠经历1?h缺血和6?h再灌注
2.3 STIM1-/-IR后的肝细胞凋亡小鼠经历1 h缺血和6 h再灌注表现出更高水平的NFAT1、Orai1和Cleaved-Caspase-3(图3A)。与WT/Con组相比,WT/IR组肝细胞凋亡水平更高;STIM-/-IR组与WT/IR组相比,凋亡比例显著降低(图3B)。图3C示,WT/IR组活性的Caspase-3水平更高,其在STIM1-/-/IR小鼠中下调(图3C)。
2.4 抑制STIM1表达可改善Kupffer细胞缺氧后的炎症反应、减少ROS生成和凋亡如图4A和4E所示,在体外Kupffer细胞暴露于低氧导致STIM1在mRNA和蛋白质水平上呈时间依赖性上调。图4H示低氧暴露后STIM1在Kupffer细胞中成功沉默。图4B显示HO暴露显著诱导了Kupffer细胞中的细胞质游离Ca2+浓度,而STIM1 siRNA序列的预转染显著降低了Ca2+浓度。图4C RT-qPCR分析显示与Con组比较,HO诱导了更高的TNF-α、IL-6、IL-1β、iNOS和COX2的mRNA水平,而HO/siSTIM1组,上述因子的mRNA表达水平降低。这与上述结果一致,由HO引起的p-NF-κB也被STIM1敲除下调(图4D)。DCF分析显示,与Con组相比,HO暴露后ROS产生增多,STIM1沉默后ROS产生减少(图4G)。图4F显示STIM1敲除抑制了HO诱导的HO1和Nrf2表达。图4I表明HO暴露导致NFAT1、Orai1和活性Caspase-3的过度表达,但在STIM1-/-组被阻断。图4J显示STIM1沉默减少了暴露于HO的TUNEL阳性细胞,表明细胞凋亡受阻。
3 讨论
IR常在肝移植、肝肿瘤切除手术、大出血、休克时发生,可能导致患者肝功能障碍,降低围手术期存活率[2-3]。目前,已知多种因素参与了肝IR损伤[11],潜在的分子机制尚不完全清楚。因此,需要进一步探索减轻肝IR损伤的新靶点。据报道,STIM1参与了中性粒细胞调节的IR损伤[12]。STIM1是一种Ⅰ型跨膜蛋白,其N端位于内质网,N端向C端的EF手型结构为内质网钙浓度感受器,通过调节钙池调控Ca2+内流通道的开放,影响细胞内外Ca2+浓度[13-14]。Ca2+释放和内流使Ca2+持续振荡,影响受转录因子如NF-κB调节的细胞应答[8,15]。NF-κB通过促进促炎细胞因子释放在介导炎症反应中发挥重要作用[16]。本研究结果显示,小鼠肝IR损伤后STIM1mRNA和蛋白表达水平增加。STIM1敲除后血清AST、ALT水平及促炎细胞因子的表达水平降低,减轻了IR损伤引起的肝损害。据此认为STIM1在肝IR损伤中发挥重要作用。
本研究结果显示肝IR损伤后小鼠SOD活性、HO1和Nrf2表达显著下调,MDA和ROS水平上调,STIM1-/-通过逆转上述指标减氧化应。ROS可以调节细胞间质Ca2+信号[14]。因此,STIM1和ROS可能存在相互关系,但仍需要进一步研究以揭示其潜在的分子机制。
肝IR损伤是一个以肝细胞坏死和凋亡为代表的复杂过程[17]。在肝IR损伤中,抗凋亡蛋白减少,酶复合物的氧化损伤引发细胞凋亡。本研究结果显示肝IR损伤使裂解的Caspase-3和凋亡细胞数增多,而敲除STIM1后Kupffer细胞凋亡受到抑制。推测敲除STIM1在肝IR损伤中的保护作用与抑制细胞凋亡有关。这与相关文献报告一致,即STIM1敲除通过抑制细胞凋亡相关信号防止细胞死亡[18]。但未来需要进一步深入研究以更好地揭示氧化应激与STIM1调节的细胞凋亡之间的相关性。
本研究证实STIM1缺乏通过减轻炎症、氧化应激和细胞凋亡来保护肝免受IR损伤,STIM1可被视为改善IR损伤的潜在治疗靶点。

