UGT1A1基因多态性与伊立替康安全性和有效性的临床研究
单星星
(泗阳县中医院有限公司,江苏 泗阳 223707)
0 引言
伊立替康为临床常用化疗药物,可有效延长患者预计生命时长,作用于机体后可快速被羧酸脂酶水解,修复断裂后的细胞周期S期DNA单链,抑制DNA复制及转录[1]。临床学者研究发现,伊立替康化疗效果呈明显剂量依赖性,化疗不良反应与剂量具有高度关联,严重影响化疗效果,呈明显个体差异性,考虑与个体基因多态性相关[2]。近年随着人们生活环境恶化,直肠癌发生率呈现逐年递增趋势,成为危害人们机体健康的重要恶性肿瘤,伊立替康于直肠癌治疗不良反应频发,严重阻碍治疗工作的开展,受到临床学者高度关注[3,4]。本研究笔者现就UGT1A1基因多态性对伊立替康化疗效果及安全性相关性进行分析,旨在为临床治疗提供经验借鉴。
1 资料与方法
1.1 一般资料
观察对象均为本院肿瘤科收治的直肠癌患者,共计100例,病例筛查时间2019年10月至2021年10月,其中涉及男性患者54例,女性患者46例,年龄区间30-74岁,均龄(51.04±2.38)岁,最短病程3个月,最长病程14个月,均值(7.83±0.71)个月。
纳入标准:(1)100例观察对象均满足《肿瘤医学鉴别诊断指南》中针对直肠癌的诊断依据,患者入院后经临床症状、肠镜、穿刺活检、手术病理检查等综合手段确诊为直肠癌[5];(2)所选患者均接受伊立替康化疗治疗;(3)所选患者均具有良好认知功能,可独立配合相关研究;(4)研究开展征求伦理委员会批准实施,所选患者均具有完整病历资料。
排除标准:(1)合并心肝肾等严重器质性功能病变患者;(2)合并急慢性感染患者;(3)预计生命时长不满足支持本研究患者;(4)合并免疫缺陷性疾病患者;(5)合并精神障碍性疾病患者,严重认知功能不全患者。
1.2 方法
100例患者均予以伊立替康化疗方案,依据患者临床症状开展对症治疗,包括维生素、叶酸、纠正水电解质、维持酸碱平衡;取60mg/m2伊立替康混合100ml氯化钠注射液每间隔1周于静脉输注一次,联合60mg/m2顺铂于化疗前3d联合静脉滴注,以28d为一疗程,持续治疗3个疗程[6-8]。
于伊立替康化疗前采集患者外周血2ml为样本,置于抗凝试剂内保存,送至专业基因检测机构,主要采用上海源奇生物医药科技有限公司提供Qiagen试剂盒,按照试剂说明书进行相关操作,经PCR扩增后,混入标准分子量,实施毛细血管电泳,借助荧光染料标记DNA片段,设计 PCR 扩增引物序列正向引物:5’-TCCCTGCTACCTTT GTGGAC-3’;反 向 引 物:5’-ATGGCACAGGGTACGT CTTC-3’,测序结果借助Vector NTI系统分析。
1.3 评价标准
借助世卫组织实体瘤缓解评价标准对伊立替康化疗效果进行评估,若实体瘤基本消失、临床症状消失,持续3个月无复发,则为完全缓解(complete remission,CR),若实体瘤直径缩小30%以上,则为部分缓解(partial remission,PR),若实体瘤直径缩小不足30%,且无新发病灶,则为稳定(stable disease,SD),若实体瘤直径增大20%,或出现新发病灶,则为进展(progressive disease,PD)。RR=CR+PR[9,10]。观察患者化疗期间迟发性腹泻、白细胞减少发生情况[11,12]。
1.4 统计学分析
使用统计学软件SPSS24.0进行假设校验,计数资料分布用(%)表达,卡方假设校验,采用Logistic非线性回归因素分析直肠癌预后相关性,P<0.05设为统计学差异基础表达。
2 结果
2.1 UGT1A1基因多态性与伊立替康化疗效果分析
100例 患 者 中UGT1A1*28分 布TA6/6、TA6/7、TA7/7基因类型,分别为77例、18例、5例,UGT1A1*6分布A/G、G/G、A/A基因类型,分别为22例、70例、8例,依据实体瘤缓解有效性分析显示,UGT1A1*28、UGT1A1*6基因RR指标具有同质性,差异无统计学意义(P>0.05),见表1。

表1 UGT1A1基因多态性与伊立替康化疗效果分析
2.2 UGT1A1基因多态性与伊立替康化疗不良反应分析
UGT1A1*28基因型TA6/7迟发性腹泻、白细胞减少3-4级发生率显著高于其他基因型,差异有统计学意义(P<0.05);UGT1A1*6基因型迟发性腹泻、白细胞减少发生率无统计学意义(P>0.05),见表2。
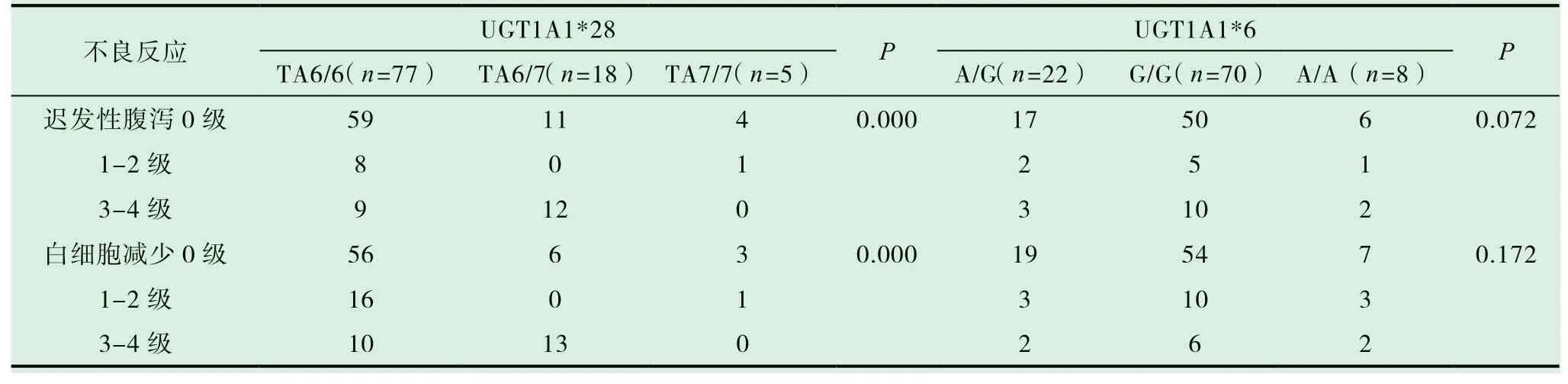
表2 UGT1A1基因多态性与伊立替康化疗不良反应分析(n)
2.3 肿瘤预后Logistic多因素分析
经Logistic非线性回归因素分析显示,直肠癌预后与肿瘤分期、UGT1A1*28基因型TA6/7具有关联性,差异有统计学意义(P<0.05),见表3。

表3 肿瘤预后Logistic多因素分析
3 讨论
伊立替康为直肠癌常用化疗药物,属拓扑异构酶Ⅰ抑制剂,主要药理机制失抑制癌细胞复制及转录,以起到杀灭肿瘤组织活性,延长患者预计生命时长[13,14];经临床药理分析显示[15,16],伊立替康以肝脏代谢为主要途径,于肝脏内转换为活性代谢产物SN-38,经UGTIA1代谢酶将SN-38灭活为无毒性SN-38G;经临床研究证实,UGTIA1活性越高,SN-38G代谢速度越快,则伊立替康毒副反应越低,药物疗效与安全性与UGT1A1基因多态性具有高度关联,为近年直肠癌药物研究探讨热点课题[17-19]。
本研究选取100例直肠癌患者经检查UGT1A1*28分 布TA6/6、TA6/7、TA7/7基 因 类型,分别为77例、18例、5例,UGT1A1*6分布A/G、G/G、A/A基因类型,分别为22例、70例、8例,依据实体瘤缓解有效性分析显示,UGT1A1*28、UGT1A1*6基因RR指 标 具有同 质 性(P>0.05),样本疗效无差异,与样本量少相关;经不良反应相关性分析显示,UGT1A1*28基因型TA6/7迟发性腹泻、白细胞减少3-4级发生率显著高于其他基因型(P<0.05);UGT1A1*6基因型迟发性腹泻、白细胞减少发生率差异无统计学意义(P>0.05),于直肠癌以伊立替康治疗期间可加强UGT1A1基因检测,了解药物应用安全性[20-22],经Logistic非线性回归因素分析可证实直肠癌预后与肿瘤分期、UGT1A1*28基因型TA6/7具有关联性(P<0.05),可作为药物治疗及预后评估主要参数,具有临床借鉴价值[23-25]。
综上,UGT1A1*28基因型TA6/7与伊立替康安全性和有效性具有高度关联,可作为疾病预后重要参照指标。

