散茶曲小罐发酵在普洱熟茶中的应用研究
田海霞,孙婷婷,李 颂,马 跃,刘海新,戴 申,翁慧琼
1. 中茶科技(北京)有限公司,北京 102209;2. 云南中茶茶业有限公司,云南 昆明 650000
普洱熟茶是利用云南大叶种晒青毛茶经潮水、渥堆发酵、晾干、精制后得到的后发酵茶[1]。普洱熟茶渥堆发酵过程本质上是晒青毛茶在一定的温湿度和含氧量的环境条件下,伴随菌群的更替和代谢[2-3],形成丰富的外源胞外酶并诱导激活茶叶内源酶,进而发生物质和能量的转化,期间伴随微生物对叶片的侵染作用[4]、各种酶促反应及美拉德反应,最终形成普洱熟茶的典型特征。渥堆发酵是普洱熟茶的特征性核心工序[5],目前对普洱熟茶渥堆发酵工序的研究集中在茶青初始及过程中水分变化、渥堆高度、发酵进程的堆温变化、人工翻堆次数及渥堆发酵进程中微生物菌群的变化分析与优势菌株研究[6-9]。但优势菌株通过人工干预来推动发酵进程进而影响发酵底物的香气和滋味的研究较少,与自动化固态发酵装备结合进行规模化产业应用推广的研究仍处于空白[10-12]。本试验研究将前期大量工艺应用研究中筛选的普洱传统发酵优势菌株进行重新组合,制备成散茶曲,引入小罐标准化发酵工艺,研究散茶曲对普洱熟茶发酵的影响。
1 材料与方法
1.1 材料与试剂
菌株来源:新黑曲霉(Aspergillus neoniger),保藏编号为CGMCC No.15883,从勐海地区传统大堆发酵一翻料中分离筛选得到;琉球曲霉(Aspergillus luchuensis),保藏编号为CGMCC No.15663,从勐海地区传统大堆发酵三翻料中分离筛选得到;鲁氏酵母(Zygosaccharomyces rouxii),保藏编号为CICC 1379,购于中国工业微生物菌种保藏中心;枯草芽孢杆菌(Bacillus subtilis),保藏编号为CGMCC No.15959,从传统发酵的开沟起堆料及老茶中分离筛选得到。
试剂耗材:云南布朗产区大叶种晒青毛茶,购于中茶云南公司;马铃薯葡萄糖琼脂培养基(PDA)和马铃薯葡萄糖肉汤培养基(PDB),购于北京陆桥技术有限责任公司;超纯水由实验室自制,ThermoFisher F3型单道移液器;一次性培养皿、接种环等。
1.2 仪器与设备
苏净SW-CJ-2FD型超净工作台;上海一恒GRX-9013A型恒温恒湿培养箱;ZEALWAY GR650R型高压灭菌锅;2834型水浴锅;Mettler Toledo ME104型万分之一天平;上海恒一DHG-9240A型电热恒温干燥箱;蔡司GR85DA型显微镜;Kylin-Bell VORTEX QL-902 型涡旋混合器;IKA RCT B S025 型加热磁力搅拌器等。发酵小罐采用自主研发茶叶发酵专用罐,为食品级HP450J材质制作,发酵罐容积为4 L,湿茶填装量为 1 ~ 1.5 kg,发酵小罐装置见图 1。
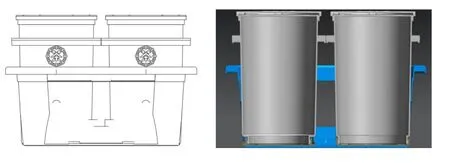
图1 发酵小罐装置图Figure 1 fermentation small tank device diagram
1.3 试验方法
1.3.1 散茶曲制备
以云南大叶种条茶为培养基质,将其灭菌后接入普洱茶分离筛选的优势菌株[13-17],分别为琉球曲霉(Aspergillus luchuensis)、新黑曲霉(Aspergillus neoniger)、鲁氏酵母(Zygosaccharomyces rouxii)和枯草芽孢杆菌(Bacillus subtilis)的液体种子,经固态纯种培养后形成散茶纯种,按一定比例拼配后形成发酵用散茶曲,散茶曲活菌数≥108CFU/g。发酵用散茶曲拼配见表1。
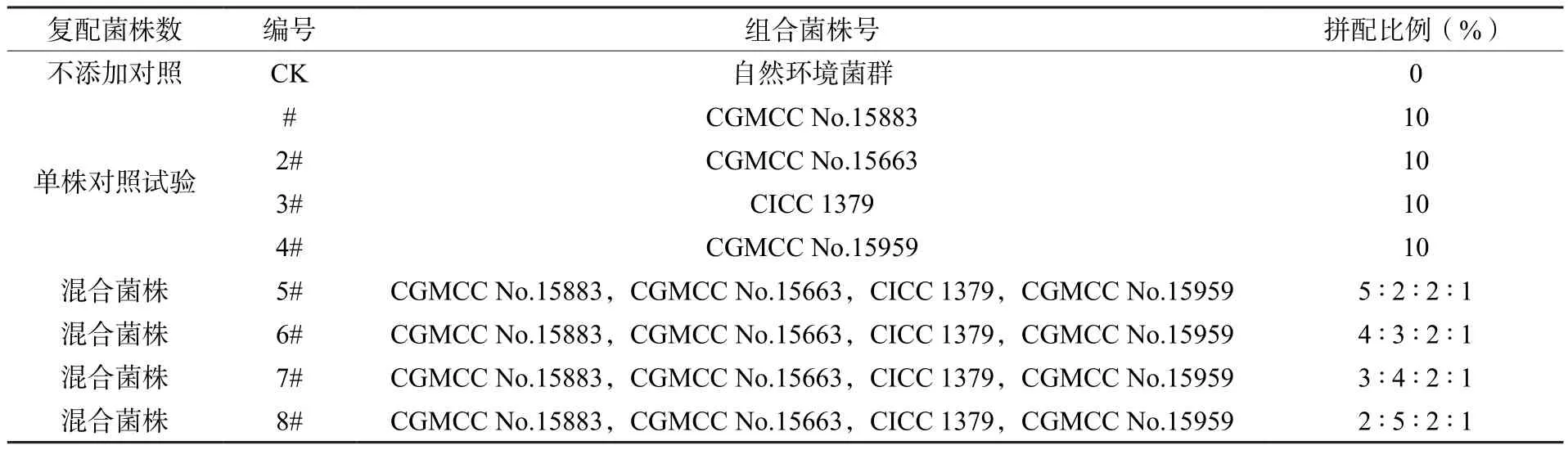
表1 散茶曲种混合配方表Table 1 Mixed formula table of Loose tea
1.3.2 散茶曲发酵普洱熟茶方法
按照图2的工艺流程,取五级晒青毛茶共9份,每份100 kg,各加水42 kg,充分拌匀后静置20 min,取其中8份分别按表1播撒编号1#、2#、3#、4#、5#、6#、7#和8#的散茶曲,最后1份不播撒散茶曲作为对照(CK)样;每份播撒量为干茶的10%即10 kg,充分拌匀后静置20 min,取样测水分并做记录,使茶叶的含水量控制在33% ~ 35%;复水后的处理样用小罐封装,每罐装量为1.2 kg湿茶,每个处理装130罐,独立码放形成两个堆垛。将发酵堆垛按顺序码放在发酵室进行发酵,按表2的要求设置培养室的环境参数,发酵全程不补水、不出料、不翻动,一次性培养35 d后结束发酵;结束发酵的堆垛按处理标记,将物料从小罐中倒出并解散后进入干燥房干燥处理。
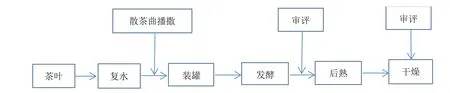
图2 散茶曲小罐发酵普洱熟茶工艺流程Figure 2 Process flow of loose tea koji fermenting Pu'er ripe tea
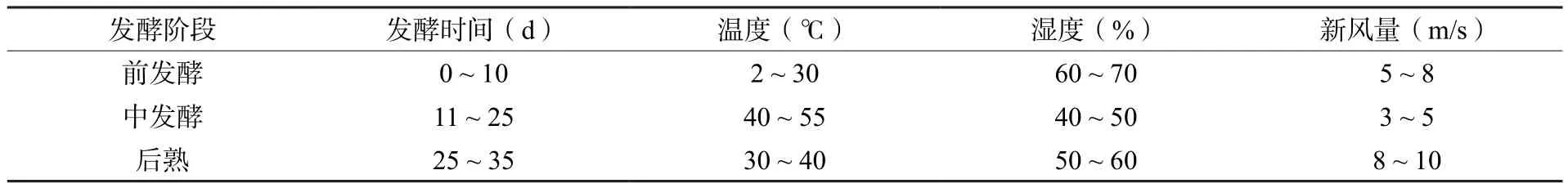
表2 发酵室环境条件Table 2 Fermentation conditions
1.3.3 茶样感官评定
发酵过程需要进行两次取样审评,一次在发酵结束后,取样开汤,主要评价汤色和叶底状态是否达到熟茶标准;第二次是干燥后,按茶叶审评标准进行外形和内质审评,综合打分评价发酵效果。
1.3.4 茶样理化检测
发酵结束后的各处理样分别抽取2 kg进行干燥,将水分统一调整至15%,分别进行茶汤固形物、茶多酚、茶色素、pH值、氨基酸态氮和菌落总数测定。
水分测定方法参照 GB 5009.3—2016《食品安全国家标准 食品中水分的测定》测定;感官审评参照GB/T 23776—2018《茶叶感官审评方法》进行;茶汤固形物检测方法参照GB/T 12143—2008《饮料通用分析方法》中可溶性固形物测定方法(折光计法);茶多酚检测方法参照GB/T 8313—2018《茶叶中茶多酚和儿茶素含量的检测方法》;茶褐素含量测定参照《茶学综合实验》[18];pH值检测方法参照《不同茶类茶汤pH值的研究》[19];氨基酸态氮检测方法参照GB 5009.235—2016第一种;菌落总数参照GB4789.2—2016《食品微生物菌落总数的测定》。
2 结果与分析
2.1 不同处理茶样感官评价结果
添加散茶曲的不同处理综合评分排名为:7#、8#、6#、5#、1#、2#、3#、4# 和 CK#( 表3)。其中,接入散茶曲处理的发酵效果均优于不添加散茶曲,接入混合散茶曲的茶样感官品质优于接入单菌株散茶曲的茶样。在接入混合散茶曲处理的审评结果中,5#处理的发酵料稍有结块,香气中稍带霉味和水汽感;6#处理的发酵料外形松散,焦甜香高扬,汤色明亮,滋味略带苦,叶底稍硬(发酵稍过);7#处理的发酵料外形松散,干茶红润度好,香气高扬,滋味醇厚,叶底柔软有弹性;8#处理的发酵料外形松散,干茶红润度好,香气高扬,滋味浓醇,汤色稍浑浊。综合审评结果可看出:随着琉球曲霉添加比例的上升,茶叶外形的松散度和干茶的红润度明显变好,香气高扬,但汤色逐步变浑浊;随着新黑曲霉添加比例的上升,新黑曲霉对茶汤的透亮度有明显的改善作用,但发酵料容易结块(图3)。因此,新黑曲霉和琉球曲霉对发酵料感官审评影响明显,推断其在发酵进程中起主导作用,酵母菌和枯草芽孢杆菌对发酵料的感官品质影响表现不突出,推断其在发酵进程中起辅助作用。

图3 不同处理的干茶Figure 3 Dried tea under different treatments

表3 不同处理发酵茶样感官评价结果Table 3 Sensory evaluation different experimental fermented tea samples
2.2 不同处理茶样发酵成熟度变化
从图4可看出:1#处理和5#处理在相同发酵时间内发酵成熟度最高,可达8成熟;6#处理和7#处理的成熟度为7成熟,其它接散茶曲的处理和CK对照样的成熟度为6成熟。结合审评结果来看:成熟度达到8成时,叶底稍硬略有腐烂,发酵稍过;成熟度达到7成时,感官品质更佳;而成熟度为6成时,苦底稍重,汤色的透亮度下降。从成熟度表现来看,新黑曲霉可明显加速发酵进程,随着新黑曲霉散茶曲种添加比例的下降,发酵的成熟度也随之下降。
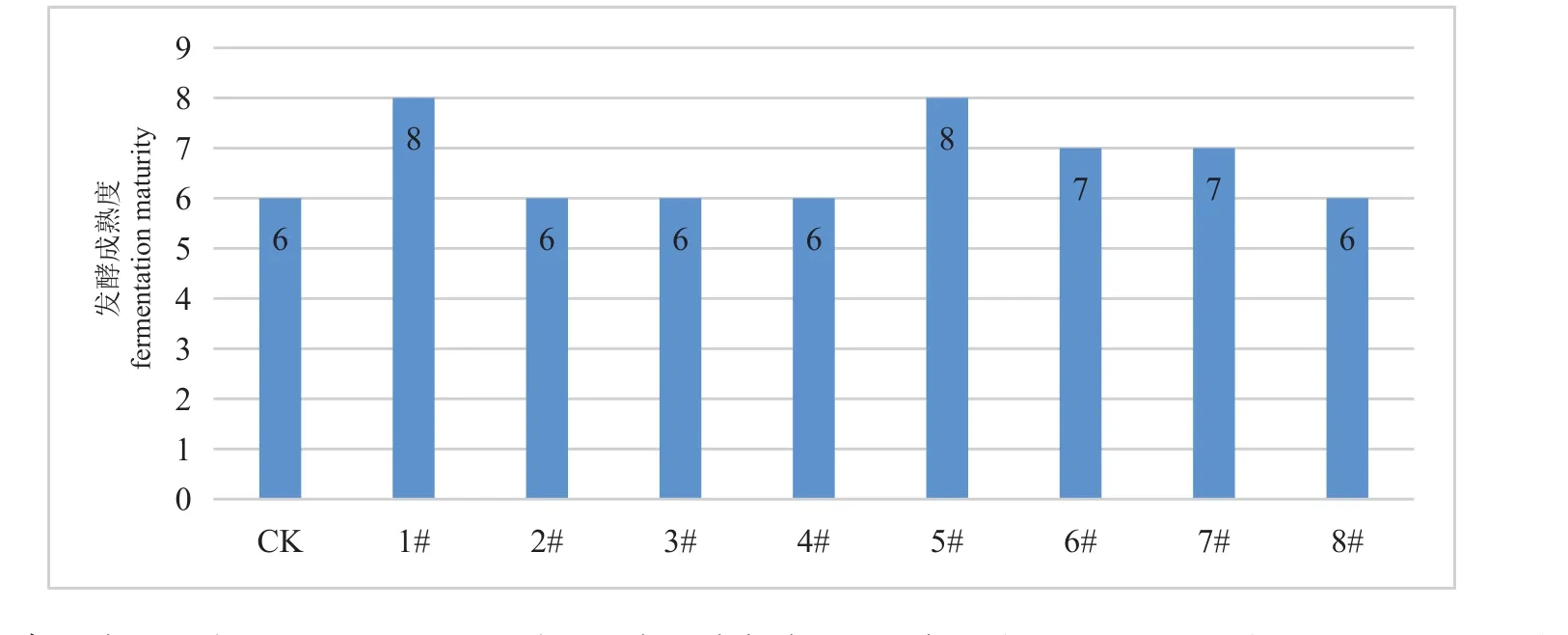
图4 不同处理样发酵料发酵度Figure 4 Different processing sample fermentation material fermentation degree
2.3 不同处理茶样理化指标变化
从表4可看出,不添加散茶曲种的对照CK样茶色素、pH值、氨基酸态氮和固形物的含量均明显低于同发酵条件下的添加散茶曲的处理样。混合散茶曲处理样中,随着新黑曲霉添加比例的降低,茶多酚含量逐步升高,茶色素、pH值、氨基态氮和固形物含量变化不大。鉴于熟茶后期存储转化空间的考虑,兼顾感官审评结果,优选茶多酚保留大的处理,因此以7#处理最佳。

表4 不同处理发酵茶样理化指标检测结果Table 4 Different experimental fermented tea sample physical and chemical indicators testing table
2.4 不同处理茶样发酵过程中微生物菌落的变化
从表5可看出,CK、2#、3#、4#和8#等五个处理的霉菌菌落数量过少,第一阶段结束后菌丝涨势弱,作用不充分,致使第二阶段湿热作用时发酵罐内部水分散失过快,接入的酵母菌和芽孢杆菌活菌数急速下降,导致发酵不充分,使发酵结束后的物料汤色浑浊,成熟度稍低。1#和5#处理,第一阶段霉菌生长过多,微生物呼吸产生大量水分迅速累计至发酵罐底部,出现底部积水,致使第二阶段湿热发酵过快,底部出现轻微碳化,导致发酵后的物料结块严重,白色菌丝过多,汤色浓度不够,叶底碳化严重,茶汤苦底重,香气沉闷水汽大。6#和7#处理,第一发酵阶段菌落数量适中,发酵菌丝满布且均匀,成团但不腐烂,底部无积水;第二阶段的湿热发酵均匀充分,干茶红润,发酵成熟度适中;第三阶段养瓶期间出现甜醇感和梅子香,叶底柔软不腐烂,香气高扬。综上微生物菌落数的表现看,发酵前期的霉菌菌落数需要快速达到108数量级以上,菌丝要充分侵染茶叶,使茶叶液泡中的多酚氧化酶充分释放,同时各类微生物要充分释放胞外酶,为后续湿热作用提供酶活动力[20]。可见,本试验中5#、6#和7#处理的添加量和配比可达到上述效果。
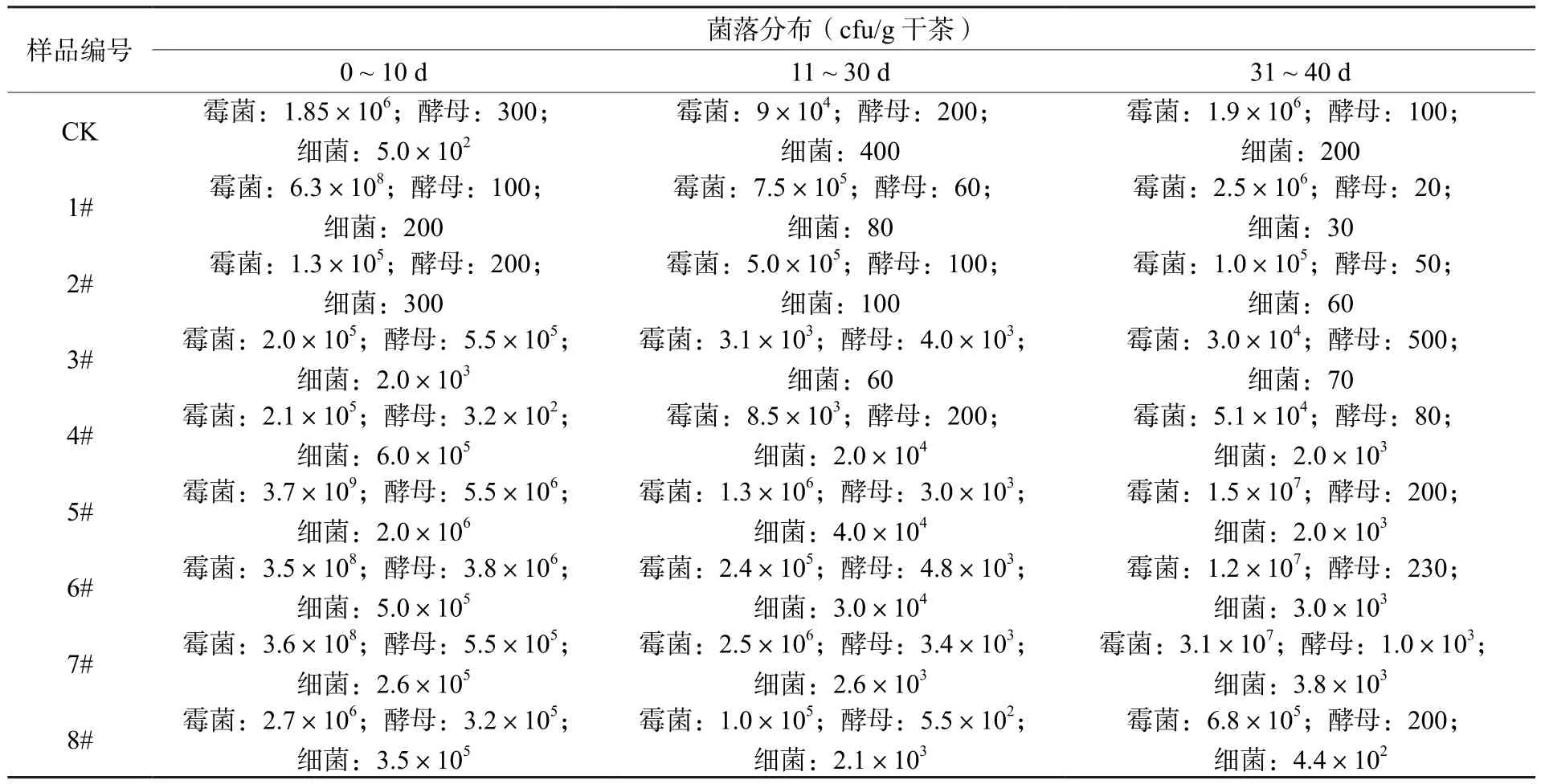
表5 不同处理发酵过程中微生物菌落变化表Table 5 Changes of microbial colonies in different experimental groups during fermentation
3 讨论与结论
通过接种不同配比的散茶曲进行小罐普洱熟茶发酵实验,综合分析了不同处理发酵料感官品质特征、理化指标变化趋势及发酵进程中微生物菌落数量的变化情况。从不同处理样的感官审评结果可知:当鲁氏酵母菌和枯草芽孢杆菌的添加比例固定时,新黑曲霉和琉球曲霉的添加比例在3∶4时发酵的状态最佳,可兼顾滋味、香气、汤色和外形,有效降低茶叶发酵过程结块现象,降低新堆的霉味和水闷气,提升茶叶品质,出现特征性的梅子香气。从不同处理样的理化检测数据可看出:按比例添加散茶曲种发酵普洱熟茶,茶色素含量明显提升,茶色素对调节人体肠道菌群有很好的辅助作用[21-23];茶汤pH值明显升高,达到人体液体[24]的弱碱性水平;茶汤固形物含量明显增加,提升茶汤的醇厚度;茶汤中氨基态氮含量提升,使茶汤的鲜甜感更突显。从不同微生物的发酵表现来看:新黑曲霉对普洱熟茶发酵作用力最强,可加速发酵进程,但新黑曲霉发酵使茶多酚消耗过大,影响熟茶后期存放转化空间,且发酵料容易积水结块,使最终产品霉味和水闷气重。琉球曲霉作用过于温和,对茶叶的侵染力较弱,致使后期发酵不充分导致茶汤浑浊,但发酵料香气高扬,外形完整,干茶红润不结块。鲁氏酵母菌和枯草芽孢杆菌在第一阶段扩增繁殖期很容易被环境及茶叶自带的微生物菌群压制,对发酵进程和发酵效果的表现并不明显。
综上所述,接入散茶曲可明显加快普洱熟茶的发酵进程。其中,新黑曲霉对发酵速度和汤色的亮度贡献最大,琉球曲霉对外形的红润度和松散度影响明显,鲁氏酵母菌和枯草芽孢杆菌对后熟过程中风味的醇化和滋味的丰富度有辅助作用。通过四种微生物配比的优化实验发现,当新黑曲霉:琉球曲霉:鲁氏酵母:枯草芽孢杆菌配比为3∶4∶2∶1时发酵的效果最佳,其发酵成熟度为7成,茶汤中的茶多酚和茶色素的比例适中,更有利于后期陈化转化,此时的茶汤pH值、氨基酸态氮和水溶性固形物的含量也较高,茶汤滋味更饱满丰富。因此,适当的散茶曲添加比例可加速发酵进程,优化发酵料感官品质,提升发酵料的功能性理化成分含量。本试验对小罐标准化熟茶的推广和应用具有指导作用,可通过微生物优势菌株的干预和发酵控制条件改变[24],从而控制发酵成熟度和产品风味特色,优化功能性理化成分指标,进一步推动普洱熟茶发酵的工业化水平,提升产品的健康属性,打造产品的差异化特性。
微生物发酵可使晒青毛茶重塑,不同的微生物配比配合发酵工艺的适当调整可在一定程度上实现差异化发酵。本试验引入的小罐发酵技术是人工散茶曲干预研究普洱熟茶发酵的新载体,每个发酵小罐可实现内部微环境的相对独立,同一培养室可同时尝试多种微生物的组合搭配,而相互间不受影响,工业化操作的便利性也更好。
小罐发酵技术是传统熟茶发酵工艺技术的升级,小罐发酵的本质是把大堆料进行分割,变成若干个独立单元,通过外置自动化装备,实现发酵过程的自动化和连续化作业,每个发酵罐单独控制,独立完成发酵,每个培养房可看作一个发酵大堆,可容纳 10 ~ 20 t的发酵小罐料,发酵过程中通过调整培养房的环境条件,满足发酵小罐的温湿度要求,小罐罐心温度和环境温度可控制在2℃ ~ 3℃的温差范围,因此发酵全程不倒罐、不出罐,一次性完成发酵,实现每个小罐罐体内部的环境相对封闭,且能充分保障发酵的均匀度和底物茶叶条索的完整性。
本实验在小罐发酵工艺的基础上引入散茶曲,研究了散茶曲的制备方法,最优发酵组合及散茶曲对发酵料品质的影响。但散茶曲在发酵进程中如何对底物茶叶发挥作用的研究还不够深入,后续研究中,可重点关注小罐发酵过程中曲霉类对底物的影响,发酵环境和微生物之间的对应关系及发酵过程中微生物、底物和环境三者相互作用的动态变化过程,实现小罐发酵过程的精准控制和差异化产品开发。这对普洱熟茶发酵技术的进一步提升和品质把控有着深远的影响,也对整个普洱熟茶发酵行业进一步工业化转型升级提供理论基础。

