肝病代谢物脂多糖检测的研究进展
李以婷,明灯明,杨雅琼
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京师范大学 食品与制药工程学院,江苏 南京 210023)
肝癌发病率位居全球恶性肿瘤发病率第6位,致死率位居第3位,全球每年约有超80万人死于肝癌[1]。全世界50%以上的新发和死亡肝癌患者出现在中国[2],然而早期肝癌的临床症状并不明显,具有隐蔽性,有超过60%的肝癌患者被发现时已进入中晚期[3]。在中国,肝癌的年龄标准化五年相对存活率仅为12.1%,死亡率仅次于胰腺癌[4]。因此,肝病的早期诊断和治疗[5]尤为重要。
研究表明,肝癌的发生与肠道菌群存在密切联系,涉及的原因有由菌群失调引起的胆汁酸代谢改变、肝星状细胞(HSC)衰老、内毒素代谢紊乱等[1,3,6-7]。天然的免疫系统是能够区分病原和非病原的,而且能够在宿主复杂的机体中快速检测到与病原相关的生物标志物。利用这种对病原的识别作用,可以得到一种识别能力强的生物检测方法,这其中最重要的一种生物标志物为与病原相关的分子表型(PAMPs)[8]。PAMPs可以与宿主内识别受体结合,并激活先天的免疫反应。在生物化学上,PAMPs是各类的蛋白、脂肽、脂多糖、肽聚糖、壁酸以及核酸等[9];然而很多的检测方法大多用于检测蛋白[10-13]和核酸[14-17],而无法检测其他种类的PAMPs,这些PAMPs很难被检测到的原因是由于其尺寸小,在宿主内浓度很低以及其特殊的生物化学性质。
脂多糖(LPS)作为一种PAMPs,在1956年作为抗原被人们发现,此后对于脂多糖的研究一直较少,多是停留在对细菌及脂多糖免疫学性质的研究阶段,直到20世纪80年代,Mutharia等[9]根据抗原和抗体的相互作用,发展了酶联免疫吸附分析法(ELISA)用于LPS检测,此后LPS再次成为研究热点。据统计,1978—1988年,发表的关于LPS 的论文数量有225篇,而1989—1999年,发表的相关文献数量达到了1 084篇,相比十年前增长了4.82倍,同时人们对LPS的研究也不再局限于LPS本身,也开始关注LPS与疾病之间的联系,探索LPS在生命代谢过程中的作用机制(图1)。

图1 脂多糖检测技术的发展
20世纪以后,随着人们对LPS认识的发展,开发LPS的检测方法开始成为新的研究热点。由图1(b)可以看出:近30年来,酶联免疫吸附分析法(ELISA)一直是LPS的主要检测方法,然而酶对环境的稳定性差,该方法不可避免地存在检测灵敏度低、结果重现性差、环境依赖性强等问题。因此,人们更趋向于发展无酶的LPS检测方法。近十年来,研究者开发了各种新型的LPS检测方法,如气质联用法、生物传感器法等。本文从脂多糖在生命代谢过程中的作用机制、脂多糖的结构和性质以及目前脂多糖常用的检测方法进行综述,为寻求脂多糖的快速、灵敏、准确定量分析提供理论支撑。
1 脂多糖在生命代谢过程中的作用机制
LPS是革兰氏阴性细菌细胞壁外膜的结构成分[18]。当LPS从细菌中释放后会引发一系列靶器官毒性和全身毒性。肝脏是摄取和代谢LPS的主要器官,少量LPS进入肝脏,可通过激活库普弗细胞(Kupffer cell)等直接吞噬或释放细胞因子等炎症介质来清除,从而起到增强机体免疫力的作用;若LPS剂量较大,炎症应答过于剧烈,会造成肝损伤[19-20],甚至肝衰竭[21],诱发败血症和败血症休克。当LPS通过肺进入人体免疫系统,会导致感染性休克,而感染性休克是重症监护病房死亡的重要原因。Nolan等[22]发现肝硬化病人中会出现门静脉和机体中高水平的LPS累积。另外,Riordan等[23]证明高水平的内毒素可能是肝硬化慢性炎症产生的原因。
2010年,Yu等[6]首次阐明肝病的发生与LPS含量有关,结果表明:内源性LPS的积累会导致抑制细胞凋亡的癌前上皮细胞中核转录因子(NF-κB)活性升高,促进了癌细胞存活,并提高了形成肿瘤的可能性[24]。此外,LPS比对应的蛋白更稳定,并且可在感染的早期释放[24-26]。因此,LPS含量可以作为肝癌早期诊断和检测的理想标志物。LPS的准确检测对肝病早期预防、诊断和治疗具有重要意义。
2 脂多糖的结构和性质
LPS是一种典型的带负电的多糖,革兰氏阴性细菌细胞膜几乎全部是由LPS组成的,每一个大肠杆菌表面大约有106个脂质A和107个甘油磷脂分子,占整个细胞膜的3/4,因此每个细胞表面相当于含有62×10-12g LPS[27-29]。LPS具有两亲性的三维结构,是由脂质A、核心多糖链和O-抗原多糖3部分组成(图2)[30]。脂质A是由6~7条脂肪酸尾巴组成,属于LPS分子中的疏水部分。脂质A也被称为内毒素,是与致病密切相关的毒性成分,该部分能够吸附哺乳动物的先天免疫受体——人托尔样受体4(TLR-4)[31]。从结构上看,脂质A与核多糖共价结合,核多糖可以进一步分为内核多糖和外核多糖,外核在糖基结构和糖苷键位置上的保守性较差。

图2 脂多糖的结构[30]
LPS有两种类型,分别是S和R型。S型LPS的远端可以延伸到生物体中O-抗原多糖(O-ag)的长链端,从而产生毒性。R型LPS虽然不含有O-ag,但是仍然能够诱导免疫抗原反应。O-ag由重复的亚基组成,每个亚基含1~7个糖基残基。据报道,已有180个O-ag被证明属于大肠杆菌类型[32],例如大肠杆菌O111:B4具有多达40个大小不一的亚基O-ag,O-ag独特的糖类型(脱氧岩藻糖、泊雷糖、甘露糖以及阿比可糖)使得其具有一定的特殊性,生物体中几乎没有与其相似的物质。脂多糖的其他变化是通过引入非碳水化合物基团实现的,如乙酰基或者甲基,这些变化使得肠道中细菌的鉴别和检测成为可能。所以,LPS是早期发现和鉴定革兰氏阴性病原体的理想标志物。
在水溶液中,两亲性的分子LPS会以胶束的形式存在。在不同环境条件下,当浓度大于或者等于临界胶束浓度(CMC)时,单体、胶束或者超分子团聚物存在动态平衡,这会引起两亲性分子生物化学性质和结构的变化,脂质A中脂肪酸链的数量以及饱和程度都会很大程度影响LPS的形状,所以S型LPS确切分子量检测很困难。LPS的浓度一般是以单位体积的质量或者内毒素单位(EU)来表示的,常用1×10-10g=1 EU进行单位转化。脂质A主要由氨基葡萄糖和长链脂肪酸构成,脂质A中2个磷酸化的葡萄糖胺和核心寡糖中2个2-酮-3-脱氧辛酸单元使LPS带负电,使LPS能与带正电的分子结合。脂质A是目前LPS检测中最常用的识别位点。
3 常规测定方法
人们一直致力于开发能够用于临床样品以及药品中LPS的定量检测方法,这些方法可以分为家兔热源法[33]和内毒素鲎试剂(LAL)测定法[34-36]、气质联用法[37]、酶联免疫吸附分析法[38]、基于荧光[39-42]/电化学[32, 43-46]生物传感器法。
3.1 家兔热源法和内毒素鲎试剂测定法
家兔热源法是美国食品及药品管理局(FDA)最早批准用于LPS检测的方法[33,47],其可通过家兔的发热情况来简单地衡量脂多糖的含量[33]。家兔热源法检测简单,但是检测中任何发热反应都会被认为有LPS存在,所以非特异性低且检测成本高,因而很快被内毒素鲎试剂测定法取代。迄今为止,在肠外置装置[48]和乙肝疫苗生产[47]中,家兔热源法仍然是检测内毒素污染的标准方法。
1956年,Bang[34]首次发现,当加入内毒素后鲎变形细胞由于存在蛋白酶级联反应而产生胶黏物,Bang[34]和文献[35-36]根据这一现象发明了内毒素鲎试剂测定法,其中变形细胞的溶解物被称为鲎试剂,它是检测脂质A的黄金标准[49]。LAL测定法是最经典且应用最广泛的LPS检测法,其可使用浊度、发色团、黏度测量获得检测结果;然而,LAL测定法需要经过繁琐的酶反应,耗时长[46, 50],对温度和pH的变化非常敏感[51],且LAL测定法对除LPS以外的糖衍生物(如β-葡聚糖)也会产生响应,从而导致测定结果出现假阳性[39],尽管存在这些问题,LAL测定法仍被用于脂多糖检测,例如,Nachum等[52]用LAL测定法检测了324例病人尿液中内毒素含量,实验用时为2~4 h。美国食品及药品管理局和我国现行药典(2015版)都是采用LAL测定法来判断供试品中细菌内毒素限量是否符合规定。时至今日,该方法依然广泛应用于临床样品中内毒素含量的检测。
Muta等[53]发现了一种对内毒素敏感的细胞丝氨酸蛋白酶酶原因子C,可引发鲎试剂淋巴中的凝血级联反应,使鲎试剂浊度、胶凝或颜色产生变化,从而可以用于LPS检测。此后人们开始对LAL测定法进行优化,Barnett等[54]将酶原因子C重组得到重组因子C,然后使用人工非荧光基板开发了基于重组因子C的荧光检测法[55],其中LPS可激活重组因子C,导致人工基质的解离和荧光物质的释放,从而实现了冰川样品中LPS的检测,该方法的灵敏度与LAL测定法相当,操作简单,更适用于LPS的现场检测。
3.2 酶联免疫吸附检测法
酶联免疫吸附(ELSIA)检测法是基于抗原与抗体的免疫反应而发展的一种检测LPS的方法。ELSIA检测法可以分为两种,第一种方法一般是在板平面接枝一级抗体,当LPS抗原吸附后,进行酶标记或者二级抗体标记,然后通过比色分析来检测LPS[38,56];第二种方法是通过检测LPS抗体滴度,从而筛查革兰氏阴性细菌感染,这种方法一般在板式平面修饰抗原,然后加入人血清抗体(如免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)),通过测定抗体滴度来实现LPS的检测。由于此种方法是建立在适应性免疫的基础上,在接触病原体和增加抗体滴度之间存在时间差,从而使检测变得十分困难。虽然此种方式特异性不强,但是也被用于人体健康监测以及传染病流行病学研究。Suthienkul等[57]使用间接ELISA检测法,将LPS被动吸附在聚苯乙烯板上,并测量了霍乱患者的相关IgG和IgM滴度,结果表明IgG和IgM的滴度在年轻和老年患者中存在差异,这可能与LPS涂层的不一致或者存在交叉反应有关;另外,在板式平面实现两亲性LPS的修饰也很困难。Grallert等[38]开发了一种LPS检测试剂盒(EndoLISA),该试剂盒是以靶向LPS保守核心区域的噬菌体受体蛋白来提供LPS的选择性,利用LPS激活细胞因子C,通过底物的转换产生荧光信号来实现LPS检测,可检测范围为2.86×10-10~2.86×10-6mol/L,该试剂盒耐高盐、耐尿素,并且能有效降低由β-葡聚糖、蛋白酶或磷脂等产生假阳性的概率。
此外,在ELISA检测中,由于LPS抗原不能够实现有效分离,ELISA试剂板常用全死细菌培养单克隆抗体,限制了特异性抗体的制备。总之,ELISA检测法灵敏度较低,结果重现性较差。因此,人们更倾向于发展无酶的LPS检测法,以期实现对LPS的快速、灵敏、特异性检测。
3.3 气质联用法
气质联用法被广泛用于复杂组分的分离与鉴定,其利用了气相色谱的高分离能力和质谱的高灵敏度,是生物样品中药物及代谢物定性和定量分析的有效工具[58]。脂多糖作为由聚糖和脂肪酸组成的结构[30],紫外吸收系数较小,很难用紫外光谱、液相色谱(紫外检测器)检测,气质联用法具有灵敏度高、检测限低、特异性高等优点,可以用于脂多糖的定量分析,例如,de Santana等[37]将LPS先进行乙酰化处理,去除羟基对气相色谱的干扰,再用于LPS的定量检测,检出限为5.714×10-14mol/L。
3.4 生物传感器法
近年来,研究者为了实现LPS的灵敏检测,发展了生物传感器法,主要包括荧光/电化学生物传感器法。此种检测方法主要由两部分组成[32,39-42,44-46,50,59]:一是识别元件,一般采用能够捕获样品中LPS的特定小分子或者蛋白;二是用来感受信号变化的传感元件。下文将从脂多糖的识别方式、检测机制及其应用情况对脂多糖生物传感器法进行分类和总结。
目前报道的脂多糖识别元件主要有TLR-4[60]、多粘菌素B(PMB)[61]、重组内毒素中和蛋白(ENP)[32]、适配体[62-64]、LPS结合肽[65-66]、金属离子[67-68]、阳离子复合物[69]。LPS进入机体后会与脂多糖结合蛋白结合,激活机体免疫反应,诱导巨噬细胞活化,巨噬细胞表面含有大量针对不同微生物的模式识别受体。在这些受体中,托尔样受体(TLR)是外域中富含亮氨酸的跨膜蛋白,可选择性识别LPS[70]。TLR-4主要在吞噬细胞中表达,它与来自淋巴细胞抗原的适配器蛋白(MD-2)共表达形成二聚体,随后LPS与MD-2正电区结合[71]。LPS的6条脂类链中的5条与MD-2结合,其余的1条链与MD-2-TLR-4复合物的TLR-4相互作用,诱导TLR-4-MD-2-LPS二聚体的形成[72-74](图3)。表1为不同识别元件的对比结果。

注:箭头表示与TLR-4相互作用,从而形成TLR-4-MD-2-LPS二聚体的脂质链。
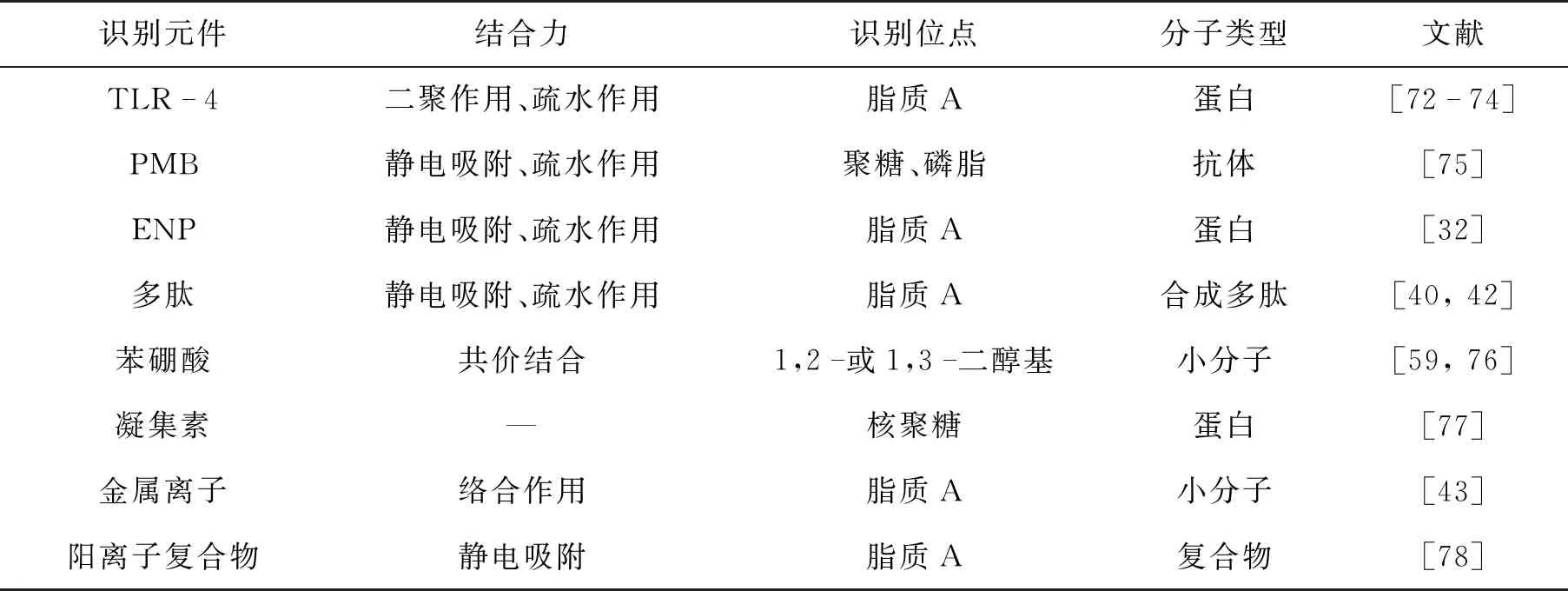
表1 不同识别元件的对比
细菌也能产生具有LPS识别和结合能力的抗生素类结构,PMB是其中的典型代表。PMB是一种阳离子环脂肽抗生素,由疏水和亲水结构域组成,能与LPS的聚糖和磷脂结合,结合常数高达 108mol-1·s-1[50,79]。无脊椎动物具有一种天生的免疫系统,可以识别潜在病原体的微小表面成分。鲎(马蹄蟹)的血细胞中能产生鲎因子C,它能选择性识别脂多糖,并激活丝氨酸蛋白酶级联反应,最终导致鲎的血淋巴凝固[80]。从鲎中分离出来的重组内毒素中和蛋白(ENP),能通过阴阳离子相互作用和疏水作用与LPS结合。适配体是短寡核苷酸的片段(DNA或RNA),由指数富集(SELEX)法产生[81],通过氢键和疏水作用与LPS结合。LPS结合肽是通过噬菌体展示技术筛选得到的[82],通过静电相互作用和疏水作用与LPS结合。小分子物质也能参与LPS的识别,硼酸基团能与1,2-或1,3-二醇形成稳定的五元或六元环酯,从而与LPS的核心多糖链结合[83-86]。凝集素是一种结构多样的蛋白质或糖蛋白,可选择性、可逆地与LPS核心多糖结构中的单聚物和寡聚物结合[77]。金属离子能与LPS的O-抗原结合,常作为LPS的辅助识别分子。此外,由于LPS带高度负电,阳离子复合物能通过非特异的静电相互作用识别LPS。
3.4.1 电化学传感器法
LPS电化学传感器法是在电极表面修饰一层活性物质,用于特异性捕获LPS,LPS的捕获会影响离子在电极表面发生电化学反应,通过脂多糖捕获前后电化学信号的变化,从而实现对LPS进行定性和定量分析。目前,应用于LPS检测的电化学传感器法包括库仑分析法、循环伏安法、电化学阻抗谱法(EIS)、脉冲伏安法等[32,43-46,50,87]。电化学传感器法具有灵敏度高、选择性好、响应速度快,成本低以及能够在线连续监测等特点,目前已大量应用于大肠杆菌、药物、人血清中LPS检测。表2为不同电化学传感器法的对比结果。
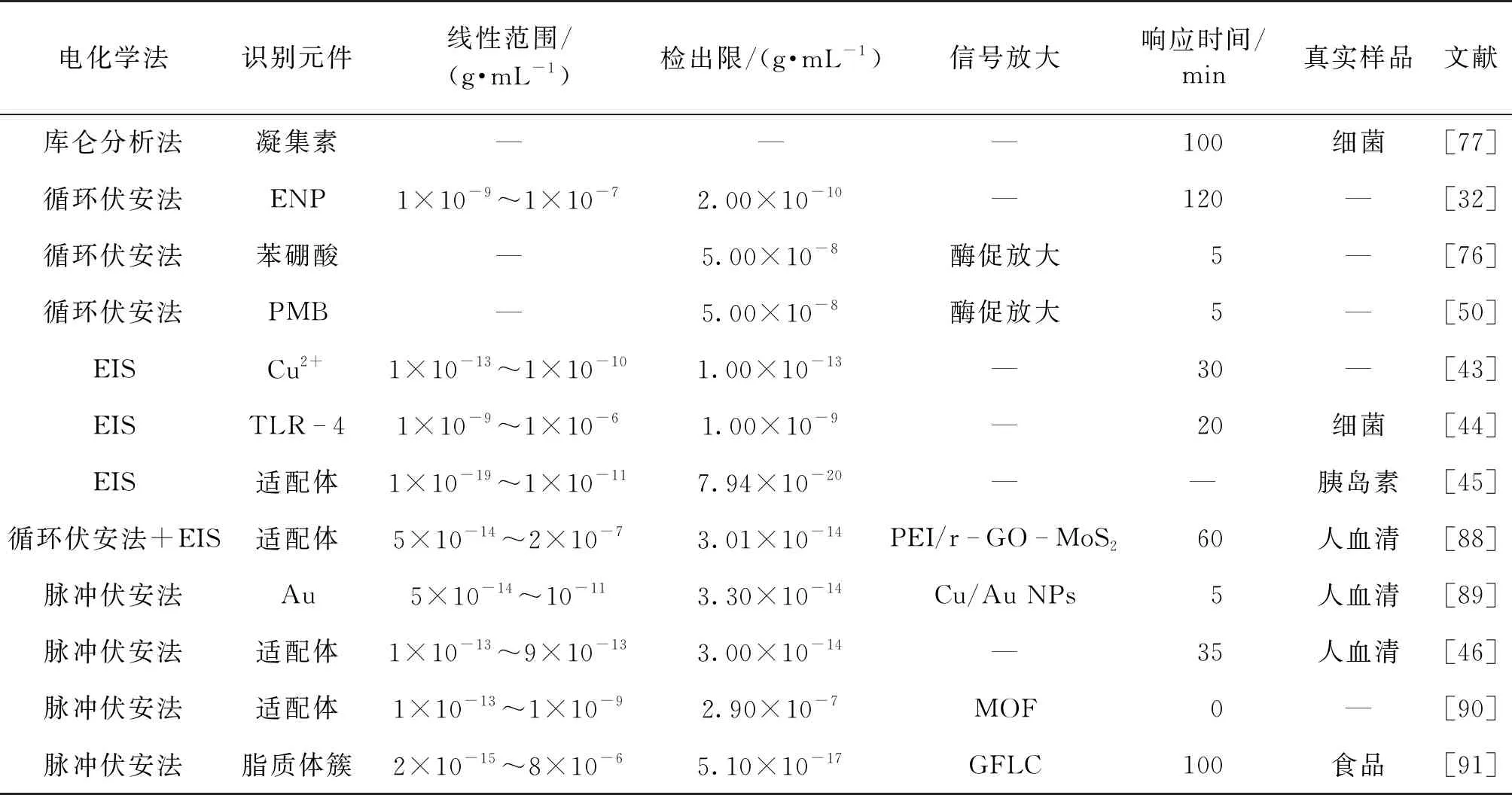
表2 不同电化学传感器法的对比
辣根过氧化物酶(HRP)能够催化过氧化物在电极表面发生氧化还原反应。Stromberg等[32]采用竞争电化学检测法,以ENP为识别元件,辣根过氧化物酶修饰的脂多糖(LPS-HRP)和LPS在电极表面发生竞争吸附,抑制了辣根过氧化物酶对过氧化物的催化作用,根据电化学信号的变化,用循环伏安法检测LPS。
Kato等[76]在金电极表面修饰一层含有心肌黄酶的牛血清白蛋白(BSA)膜,二茂铁基硼酸衍生物在电极上会被氧化,而在还原性辅酶Ⅰ(NADH)存在下,会由底酶催化而再生。当二茂铁基硼酸衍生物与LPS上的糖基结合后,电流信号发生变化,二茂铁基硼酸衍生物的消耗/再生周期中电流信号的变化可用于LPS的检测,同时酶催化反应起到信号放大的作用,检出限为5×10-8g/mL,然而二茂铁基硼酸的识别系统与菌株和血清型的LPS结构有关,并且易受到其他具有二醇结构化合物的干扰。Iijima等[50]采用二茂铁结合的多粘菌素B(PMB-Fc)为识别元件,用含有葡萄糖氧化酶(GOD)的BSA膜修饰玻碳电极,结果表明:PMB-Fc的二茂铁单元在电极表面被氧化,而在葡萄糖存在下,又被葡萄糖氧化酶还原为电中性。当LPS与PMB-Fc形成复合物时,电流减小,同时通过酶催化过程实现了信号放大,避免了高浓度单糖或聚二醇的干扰,可在5 min内实现LPS的快速检测,检出限为5×10-8g/mL(图4)。
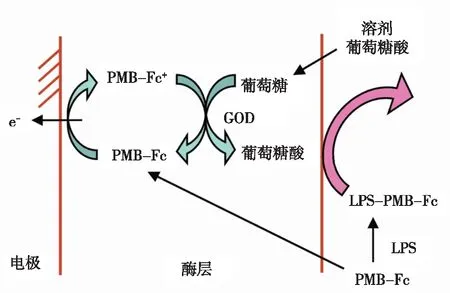
图4 二茂铁结合的多粘菌素B(PMB-Fc)和葡萄糖氧化酶(GOD)修饰的电极检测LPS示意图[50]

尽管电化学传感器法已经具有较高的灵敏度,但仍然远不如LAL测定法,且不能应用于实际样品中的LPS检测。最近研究者们开始将适配体作为识别元件,用于LPS的识别检测,例如,Posha等[45]以LPS适配体为识别元件,将适配体修饰的金纳米团簇修饰在金电极(Apt/Au AC/Au)表面,采用脉冲伏安法和EIS法选择性定量检测LPS,检出限为7.94×10-21mol/L,线性范围为1×10-20~ 1×10-12mol/L,可用于检测胰岛素样品中的LPS污染。Yuan等[88]采用聚乙烯亚胺(PEI)功能化的还原氧化石墨烯(rGO)和MoS2复合物(PEI-rGO-MoS2)修饰玻碳电极(GCE),提高了电荷传导能力和电极表面积,有利于三甲苯胺蓝(TB)的电子转移。金纳米粒子(Au NPs)用于LPS适配体(LBA)的修饰,同时能够提高电极的生物相容性,增强电化学信号,该适配体传感器线性范围为5×10-14~2×10-7g/mL,检出限为3.01×10-14g/mL。Wang等[89]采用适配体修饰电极表面,然后将LPS结合在适配体上,通过铜离子的络合作用诱导L-半胱氨酸修饰的金纳米粒子复合物(Cu/Au NPs)聚集, LPS的O-抗原通过与铜离子络合,捕获聚集的金纳米粒子,实现信号放大,采用脉冲伏安法检测LPS,检出限为3.3×10-14g/mL(图5),该方法能在5 min内快速检测人血清样品中的LPS。Pourmadadi等[46]首先通过氧化还原石墨烯和金纳米粒子(RGO/Au NPs),将适配体链固定在GCE表面,铁氰化物作为还原系统,Ag/AgCl作为参比电极,采用循环伏安法检测LPS,检出限为3×10-14g/mL,该方法能用于区分健康人群与脓毒症患者血清样本。Duan等[90]将羧基功能化的聚吡咯纳米线(PPy NWs)电化学聚合在电极表面,然后通过共价键将氨基功能化的适配体修饰在电极表面用于捕获LPS,LPS的O-抗原能固定铜有机金属骨架(Cu-MOF),用脉冲伏安法检测LPS,线性范围为1×10-12~1×10-9g/mL。
综上所述,设计LPS电化学传感器的通用策略如下:一是先在裸金电极表面修饰一层衬底,以减缓氧化还原探针离子在电极表面的氧化还原反应速度;二是在衬底上耦联LPS的识别元件,用于LPS的捕获;三是利用LPS的空间位阻效应,限制氧化还原探针离子自由地穿过衬底到达电极表面,产生电化学阻抗谱以实现对LPS的定量分析。目前开发的各类电化学传感器虽具有与LAL测定法相当的灵敏度,但其只能测定特定pH下的样品,极大地限制了临床应用[92-95]。不仅如此,由表2还可知:大部分的电化学传感器法均具有较窄的线性范围,尽管已经有少数方法能拓展线性范围,但普遍是以延长响应时间为代价的。此外,应用于真实样品分析的电化学传感器法的检测策略复杂,合成过程繁琐。因此,开发线性范围宽、响应时间短、对检测介质环境要求低、可再生的电化学传感器仍然具有挑战性。
3.4.2 比色传感器法
比色传感器法是通过测量特定波长的紫外可见吸收光来进行定量分析的方法,具有价格低廉、简单快速、可视化分析等优点。2001年,美国布朗大学Basu课题组[96]首次报道了LPS比色传感器,该传感器使用1,3-丁二炔脂质聚合生成脂质体聚合物作为信号响应元件和识别元件,交联的脂质体呈深蓝色,当LPS与其结合后,溶液颜色随着LPS浓度的增大逐渐从深蓝色转变为玫瑰红色,同时其吸收光谱发生了蓝移,该传感器实现了LPS的可视化检测,实际样品的分析结果表明:该传感器能够区分5种不同的革兰氏阴性细菌;然而,这种颜色变化需要相当高浓度的LPS(约1×10-4mol/L)。
可视化分析一直是分析领域渴望达到的检测效果。金纳米粒子(Au NPs)通常以交替态存在于水溶液中,Au NPs具有距离依赖性的表面等离子共振吸收性质,这一性质使得Au NPs随着离子间距离的变化呈现不同的颜色,从而可广泛应用于比色视觉检测[97-101];同时,金纳米具有很好的生物相容性,能够在不破坏生物分子活性的基础上实现与多种生物分子的结合,其优异的理化性质使得金纳米粒子标记法成了现在常用的标记技术之一。基于此,Sun等[102]制备了半胱氨酸修饰的金纳米粒子(CSH-Au NPs),利用CSH-Au NPs与LPS电负性部分的静电相互作用检测识别LPS。当LPS加入CSH-Au NPs溶液后,Au NPs发生聚集,溶液颜色由红色变成蓝色(图6),这种颜色变化对极低浓度的LPS(3.3×10-10mol/L)仍然敏感,Au NPs的加入大大提高了检测方法的灵敏度。

图6 CSH-Au NPs用于LPS比色分析法[102]
除了检测灵敏度外,能否用于实际样品分析也是评价LPS检测方法的又一指标。2012年,Lan等[39]合成了以3-苯基噻吩为基底的水溶性聚噻吩(CPT1)传感器,该传感器利用CPT1与LPS之间的静电和疏水协同作用诱导共轭主链构象发生变化[103-105],导致传感器的吸收光谱和荧光光谱均出现显著红移,肉眼可观察到其颜色由黄色变为红色,该传感器具有高稳定性和高水溶性,在其他负电分析物存在下仍显示出对LPS的高选择性,且检测灵敏度为10-12mol/L;同时,该传感器可以区分革兰氏阴性细菌和革兰氏阳性细菌。
传感器在制备过程中,信号标记过程往往会引起识别元件(例如适配体)的亲和力下降,为了克服上述问题,Xu等[106]巧妙设计了灯状三重开关(BTTS)的可切换适配体作为传感器,该传感器以链霉亲和素辣根过氧化物酶(SA-HRP)修饰的杂交链反应(HCR-HRP)作为信号放大元件和信号报告元件,适配体可与LPS结合形成复合物,而BTTS解离释放DNA探针离子(BP),该DNA探针离子与捕获探针离子(CP)结合引发杂交链反应(HCR),之后反应产物通过链霉亲和素与生物素的相互作用,将辣根过氧化物酶(HRP)引入反应系统中。HRP能够有效催化H2O2介导的四甲基联苯胺(TMB)的氧化,通过紫外可见吸收光谱检测HRP催化氧化引起的溶液吸光度的变化,从而实现LPS的比色检测,检出限为2.86×10-15mol/L,该传感器的灵敏度与LAL测定法相当,但其合成过程繁琐,检测耗时(约4 h)。Li等[59]研制了一种苯硼酸修饰的磁性纳米球(APBA/AMNSs),用于酸性条件下LPS的定量分析。在酸性条件下,Fe2+能从磁性纳米球中释放,并进入水溶液中[107-110],从而在H2O2存在下催化过氧化物酶底物2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)氧化生成绿色物质。当APBA/AMNSs 表面的苯硼酸捕获LPS后,LPS上的疏水性脂链和亲水性基团在其表面形成脂质双分子层,抑制了Fe2+的释放[59],导致绿色物质的生成受限。随着LPS浓度的增大,溶液吸光度逐渐降低,溶液颜色由深绿色变为浅绿色,从而实现了LPS的可视化检测。此外,磁分离可以消除复杂样品基体中其他物质的干扰,可用于食品中LPS的测定,检出限为5.714×10-12mol/L。
综上所述,比色传感器法具有检测操作方便、快速、简单、价格低廉,且不需要大量样品的优点,但是由于肉眼对颜色辨别存在较大差异,该方法仍然难以应用于临床。
3.4.3 荧光传感器法
分子吸收能量(电能、热能、化学能或光能)后被激发到激发态,由单重激发态的最低振动能级发射光子返回基态的过程中发射的光称为荧光。荧光传感器用于LPS检测分析,主要由两个部分组成,一部分用于识别LPS,另一部分为信号元件——荧光分子,根据LPS结合前后荧光信号的变化实现对LPS的定量分析。
Wu等[111]以PMB修饰的聚二乙炔脂质体(PDA)为识别元件发展了荧光增强型传感器,该传感器设计方式如下:首先,在紫外灯下,二乙炔基团发生光聚合形成交联的PDA;然后,将萘甲酸荧光标记的五聚赖氨酸和组氨酸以摩尔比1∶9接枝到PDA上,此时由于PDA与萘甲酸基团发生荧光共振能量转移,导致萘甲酸荧光猝灭;最后,当LPS与PDA结合后,荧光恢复,这种增强的荧光对LPS具有良好的选择性,不受其他负电荷分析物(如核苷酸、叶绿体、DNA)干扰,在6.0×10-7~3.6×10-6mol/L的浓度范围内有良好的线性关系。
Wanhua等[78]为了提高检测的特异性,研发了比率型荧光传感器,该传感器以2个阳离子荧光团甲氧檗因和1个阴离子荧光团9, 10-蒽二甲酸丙二酸(AMDA)在水溶液中形成的络合物作为比率荧光探针,AMDA带4个负电荷,能够特异性识别LPS,当LPS结合到探针表面引起AMDA荧光增强,甲氧檗因荧光降低,根据两者荧光强度之比可用于LPS的定量分析,该传感器能用于亚微摩尔浓度LPS的分析。
为了避免检测基质中自体荧光的干扰,提高检测的灵敏度,Li等[112]开发了一种近红外荧光发射的荧光增强型传感器,实现了脂多糖的定量检测,该方法采用等离子增强荧光信号放大策略,以金纳米棒(Au NRs)作为等离子增强荧光激元,利用聚乙二醇(PEG)控制金纳米棒与近红外荧光团之间的距离,从而实现荧光增强,LPS捕获后会破坏金纳米棒与染料之间的猝灭-增强平衡,从而导致荧光进一步增强,实现了对脂多糖的定量检测(图7),该传感器还可以实现对革兰氏阴性细菌和革兰氏阳性细菌的可视化区分。

图7 荧光增强型传感器的检测策略[112]
在荧光传感器的实际应用中常常会发生荧光基团的聚集猝灭,造成检测效果变差。近年来,研究者们发现了一种新的荧光现象——聚集诱导发光(AIE),具有AIE效应的荧光团聚集后,荧光反而增强,这是由于聚集导致分子内旋转受限所致[113-114],并以此开发了一系列具有该效应的典型荧光团。2016年,Jiang等[115]合成了具有AIE效应的TPEPyE荧光团[116-118],TPEPyE带负电,能够通过静电作用与LPS特异性结合,同时引起TPRPyE荧光光谱的改变(图8),该探针能实现尿液中LPS的检测,检测限低至纳摩尔水平。Tang等[42]用相同的策略开发了LPS生物传感器,该传感器以多肽P16(G-(CKPTFRRLKWKYKC)-G)[113]作为LPS识别元件,以AIE荧光团(1-(4-羧基苯)-1,2,2-三苯(CTPY))[119]为荧光源,在1×10-7~1×10-4mol/L的浓度范围内有良好的线性关系,检出限低至6.97×10-9mol/L,该传感器还可通过介孔二氧化硅的引入来实现实际样品中LPS的清除。
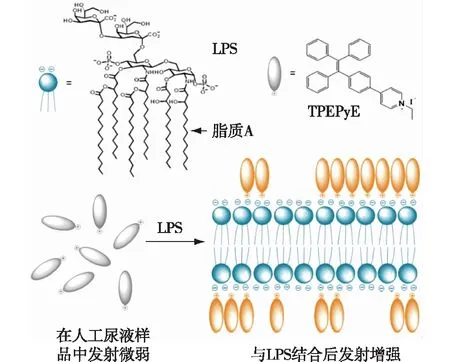
图8 基于TPEPyE荧光团的荧光增强型传感器的检测策略[115]
Niu等[41]发展了持续电堆积芯片(CI-ES)用于LPS荧光检测,该传感器以6-羧基荧光素(6-FAM)标记的适配体作为识别元件,当其在氧化石墨烯(GO)表面结合后,会导致6-FAM的荧光猝灭;当溶液中存在LPS,LPS与6-FAM标记的适配体结合, 6-FAM标记的适配体将从GO表面剥离,此时荧光恢复(图9),该芯片通过电堆叠作用进行信号放大,实现了飞摩尔(1 fM=10-9μmol/L)水平下的LPS检测;该芯片能检测注射液、人血清蛋白样品以及感染的小鼠模型中的LPS,并且能快速区分革兰氏阴性细菌和革兰氏阳性细菌。

图9 持续电堆积芯片用于脂多糖检测的原理[41]
综上所示,荧光传感器法作为一种简便、快速、灵敏的检测方法,能够实现复杂生物样品中的LPS检测,虽然其检测灵敏度远不如LAL测定法,但其对检测温度、pH没有严格要求,且不受碳水化合物(葡萄糖及其衍生物)的干扰[40-42,78,111,114,120](表3),若能提高其检测灵敏度,有望替代LAL测定法应用于临床中。

表3 不同荧光检测法用于LPS检测
4 结语
LPS是肝病早期诊断以及食品、药品质量把控的关键指标,目前临床上脂多糖的检测完全依赖鲎试剂,而内毒素鲎试剂检测法一方面对温度、pH等外部环境要求高,检测耗时,受碳水化合物干扰大;另一方面鲎作为濒危动物使其检测试剂的来源更加困难。因此,开发不依赖鲎试剂的快速、灵敏的脂多糖检测法是目前的发展趋势。基于荧光、比色以及电化学的生物传感器检测法在室温下即可检测,且其响应时间均在20 min以下,电化学传感器灵敏度甚至比LAL测定法高3~6个数量级。基于比色分析的传感器能在较宽的pH适应范围内检测,且能实现可视化分析,但其灵敏度远不如LAL测定法。基于荧光的传感器普遍具有更宽的pH适应范围和更短的响应时间,有利于生物样品的检测,但需进行复杂的荧光标记和繁琐的合成过程,难以实现临床应用。迄今为止,仅有少数LPS检测法能实现真实样品中的LPS检测,它们多是以抗体、受体、适配体来捕获LPS,所以能否实现复杂生物样品中的特异性、高灵敏检测是目前LPS生物传感器检测方法的发展方向。
综上所述,要实现LPS实际临床的快速、灵敏检测应从以下几方面考虑:一是LPS识别元件的选择,选择高亲和力的LPS识别元件(如抗体、适配体、配体、受体等)[74],能在很大程度上排除生物体内其他负电荷分析物以及葡萄糖等碳水化合物的干扰,从而提高检测方法的选择性;二是传感元件的选择,选择性能稳定的纳米材料(如量子点、金纳米簇等),可延长传感器的使用寿命,降低由于传感元件不稳定造成的偶然误差,增强检测方法的可信度;三是检测环境的选择,目前检测环境的选择均是以获得检测方法的最优性能为佳,若能在保证检测效果的前提下不受检测环境的限制,减少高精尖检测仪器的使用,更有利于将检测方法应用于临床中。因此,构建快速、灵敏的生物传感法以替代LAL测定法用于临床生物样品中LPS的定量分析,是未来研究的重点、热点和难点。

