二代测序检测结直肠癌KRAS和BRAF基因突变与预后的关系
司马学琴 苏延停 曾智
1湖北科技学院基础医学院(湖北 咸宁 437100);2咸宁市中心医院病理科(湖北 咸宁 437100)
在结直肠癌(colorectal cancer,CRC)中,抑制RAS-RAF-MAPK信号通路是CRC重要治疗方法之一[1]。其中Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten ratsarcoma viral oncogene homolog,KRAS)基因为RAS家族的原癌基因之一,是CRC中重要的致癌基因,当其突变后可持续激活表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路,使上游驱动蛋白作用及EGFR靶向药物失效[2]。鼠类肉瘤病毒癌基因同源物B1(v-raf murinesar-coma viral oncogene homolog B1,BRAF)基因位于KRAS基因的下游,同属于RAS-RAF-MAPK信号通路[3]。研究发现KRAS及BARF基因突变是CRC不良预后的重要影响因素,KRAS基因突变与肿瘤的分化、侵袭转移等明显相关[4]。BARF基因突变则作为CRC预后风险分级的重要指标,与患者的不良预后明显相关[5]。故在2021版《结直肠癌分子检测高通量测序中国专家共识》中对于确诊的CRC患者,应检测KRAS和BRAF基因表达情况,以便对预后进行分层,指导临床治疗[6]。因此准确检测CRC中KRAS及BRAF的基因状态非常关键。
二代测序在基因检测方面具有灵敏度高,检测范围广等优势,在CRC不同标本中KRAS及BARF基因检测的一致性较高[7]。同时NGS还可以提供定量的等位基因突变频率,预测肿瘤异质性,对肿瘤的治疗有一定的指导意义[8]。目前使用二代测序测定KRAS及BARF基因突变已用于指导药物治疗中,但是在同一样本量中相关研究主要局限在与临床病理特征关系、预后、影响因素等某一方面。本研究将KRAS及BARF基因表达与临床特征的关系、疗效、预后及其影响因素相结合,有助于寻找CRC中具有预测意义的生物标志物及早期的治疗疗效判断。
1 资料与方法
1.1 研究对象 选择2017年1月至2020年1月在咸宁市中心医院就诊的60例CRC患者作为研究对象,所有患者均需按照中华医学会肿瘤学分会“中国结直肠癌诊疗规范(2015版)”的诊断标准明确诊断,并进行分型[9]。入选标准:(1)患者可明确诊断并进行准确分型,临床治疗资料完整;(2)在我院进行规范化治疗4 ~ 8周期;(3)配合随访;(4)治疗期间无严重不良事件发生。排除标准:(1)存在CRC以外的恶性肿瘤;(2)脑转移患者。本研究获我院伦理委员会批准同意(伦理号:20180808-011),所有患者均知情并签署知情同意书。
1.2 CRC患者临床病理学特征 (1)年龄、性别从患者住院病历中的人口统计学信息中收集。(2)原发部位及病理分型从患者病理报告中收集。(3)T分期:T1为肿瘤侵及黏膜下层;T2为肿瘤侵及肠壁固有肌层;T3为肿瘤侵透固有肌层并达浆膜处;T4为肿瘤已穿透腹膜或侵入其他器官。(4)N分期:N0为区域内无淋巴结转移;N1为区域内有1~3个淋巴结转移;N2为区域内有4个及以上淋巴结转移。(5)肿瘤大小:在治疗前进行影像学检查,由研究医生及影像科医生共同测量。(6)治疗方案:①FOLFOX+Bev方案为:D1奥沙利铂85 mg/m2;D1亚叶酸钙400 mg/m2;D1贝伐珠单抗5 mg/kg,每2周重复使用;D1氟尿嘧啶400 mg/m2,D2~3氟尿嘧啶1 200 mg/m2;②XELOX+Bev方案为:D1奥沙利铂130 mg/m2;D1~D14 卡培他滨1 000 mg/m2,休息7 d;D1贝伐珠单抗7.5 mg/kg,每3周重复使用;③FOLFIRI+Bev方案为D1伊立替康180 mg/m2;D1亚叶酸钙400 mg/m2;D1贝伐珠单抗5 mg/kg,每2周重复使用;D1氟尿嘧啶400 mg/m2,D2~3氟尿嘧啶1 200 mg/m2。
1.3 治疗疗效判定 (1)完全缓解:所有靶病灶消失,无新发靶病灶,且持续4周以上;(2)部分缓解:肿瘤靶病灶的最大径之和减少30%以上,且持续4周以上;(3)疾病稳定:肿瘤靶病灶无明显变化;(4)肿瘤靶病灶的最大径之和增加20%以上,或出现新发病灶。客观缓解率=(完全缓解+部分缓解)例数/总例数×100%,疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。
1.4 患者随访 患者出院后均进行电话或门诊随访,随访截止时间为2021年12月1日。总生存期(overall survival,OS)为患者从明确诊断为CRC至患者死亡或随访终止的时间;无进展生存期(progression free survival,PFS)为患者从明确诊断为CRC至患者疾病进展或死亡的总时间。
1.5 NGS检测基因突变
1.5.1 基因组DNA提取 准备5片厚度为5 μm的石蜡切块,切取腊卷至离心管中,加入1 mL的二甲苯,震荡混匀后8 000 rpm离心1 min弃上清,重复2遍;加入1 mL乙醇,震荡混匀后8 000 rpm离心1 min弃上清,重复2遍,低温烘干后再离心管中中加入180 μL ATL缓冲液和20 μL蛋白酶K,混匀后56℃孵育12 h至完全消化,8 000 rpm离心1 min弃上清,加入200 μL ATL缓冲液,震荡混匀后70℃孵育10min。8000rpm离心1min弃上清,再加入200μL乙醇,混匀后,将其转移至QIAamp Mini spin column中,8 000 rpm,1 min离心,依次加入500 μL缓冲液Awl,8 000 rpm,1 min离心,加入500 μL缓冲液AW2,再次14 000 rpm,3 min离心,最后将QIAamp Mini spin column放入1.5 mL的离心管中,加入100 μL缓冲液AE,室温静置40 min,8 000 rpm,1 min离心。使用紫外分光光度仪测量提取的DNA的浓度及纯度。
1.5.2 NGS基因突变检测 使用NextDaySeq结肠癌panel进行NGS,抽取10 ng基因组DNA作为PCR模板,加入4 μL的5 x AmpliSeq HiFi Master Mix及10 μL的2 x NextDaySeq Primer Pool进行PCR杂交反应,使用FuPa酶去除杂交后无用的引物序列,PCR扩增子加入接头及标签,对连接后的产物使用AMPure XP磁珠进行纯化定量,各样本稀释至100 pmol后,取3 μL混合后即得到文库。将缓冲液、酶及ISP磁珠按照比例混合后进行单克隆PCR,对模板进行富集,加入测序引物及引物酶至芯片中,上机检测。
1.5.3 结果判定 (1)突变型(mutant type,MT):NGS检测出任一基因突变为突变型;(2)野生型(wild type,WT):未检测出任何基因突变为野生型。
1.6 统计学方法 采用SPSS 18.0进行数据统计分析。计数资料比较采用χ2检验,计量资料比较采用t检验。单因素及多因素Cox风险回归模型分析影响CRC患者OS的因素,Kaplan-Meier法分析CRC患者的OS及PFS,以P<0.05表示差异具有统计学意义。
2 结果
2.1 KRAS和BRAF基因不同外显子突变情况 60例结直肠癌患者的KRAS基因突变率为41.7%(25/60),其中第2外显子的突变率为35.0%(21/60),第3外显子的突变率为1.7%(1/60),第4外显子的突变率为5.0%(3/60)。BRAF基因突变率为8.3%(5/60),全部为15外显子突变。

表1 KRAS和BRAF基因不同外显子突变发生率Tab.1 Incidence of mutations in different exons of KRAS and BRAF genes
2.2 CRC组织中KRAS及BRAF基因突变与患者临床病理特征的相关性 KRAS突变与患者的性别、年龄、原发部位、T分期、肿瘤大小、治疗方案及远处转移无关,与病理分型及N分期明显相关,KRAS突变在中/高分化患者中的比例明显高于低/未分化患者,且在N2患者中KRAS突变比例较少。BRAF基因突变主要与病理分型及远处转移有关,在中/高分化患者及有远处转移患者中占比较高。

表2 CRC组织中KRAS及BRAF基因突变与患者临床病理特征的相关性Tab.2 Correlation between KRAS and BRAF gene mutations in CRC and clinicopathological features of patients 例
2.3 CRC患者OS影响因素的Cox风险回归模型 单因素分析结果显示疾病的病理分型、T分期、N分期、肿瘤大小、KRAS及BRAF突变与CRC患者的OS有关(P<0.05)。以上因素建立多因素Cox风险回归模型,结果显示病理分型、T分期、N分期、BRAF突变是影响患者OS的独立影响因素(P<0.05),见表3。
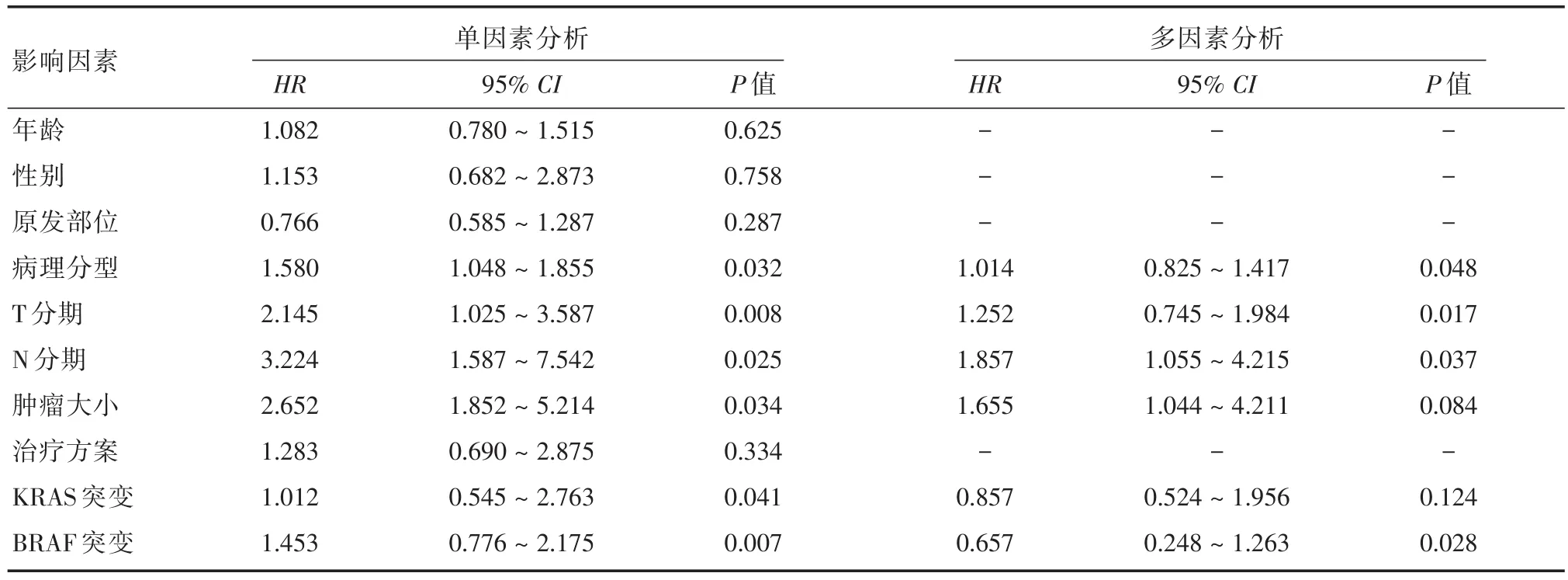
表3 CRC患者OS影响因素的Cox风险回归模型Tab.3 COX risk regression model for influencing factors of OS in CRC patients
2.4 KRAS及BARF突变及野生型患者的总体疗效 60例CRC患者中完全缓解5例,部分缓解13例,疾病稳定26例,疾病进展16例。KRAS基因突变患者的疾病进展例数及疾病控制率明显低于野生型患者(P<0.05),BARF突变或野生患者的疾病总体疗效差异无统计学意义(P>0.05),见表4。
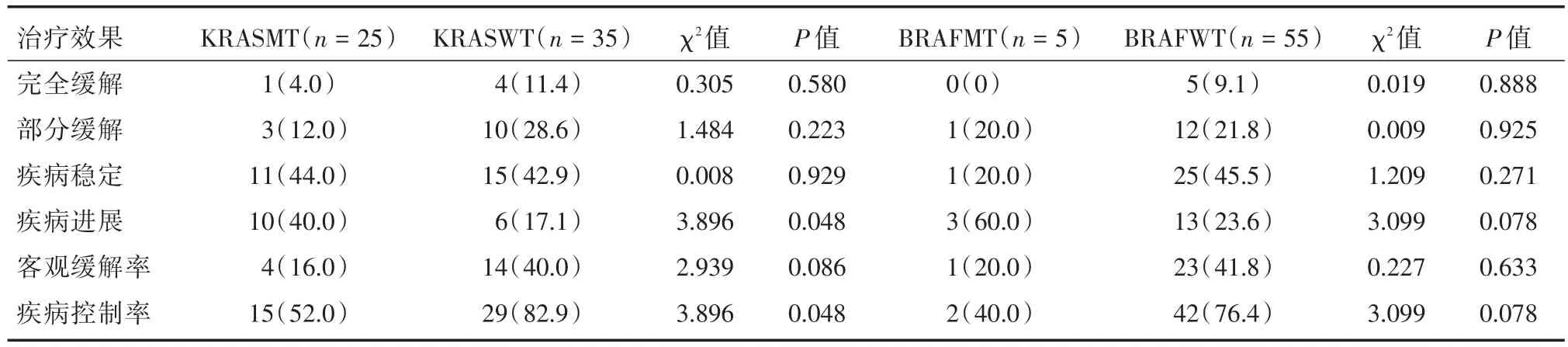
表4 KRAS及BARF突变及野生型患者的总体疗效Tab.4 Overall outcomes in KRAS and BARF mutations and wild-type patients 例(%)
2.5 KRAS及BRAF基因不同表达情况下患者的OS及PFS KRAS突变患者的OS及PFS与野生型患者相比差异均无统计学意义(χ2=0.458,P=0.498)、(χ2=3.126,P=0.077),BRAF突变患者的OS及PFS均明显低于野生型患者(χ2=10.3,P=0.001)、(χ2=8.416,P=0.004),见图1。

图1 KRAS及BRAF基因不同表达状态下患者的OS及PFSFig.1 OS and PFS of patients with different expressions of KRAS and BRAF genes
3 讨论
CRC作为最常见的消化道恶性肿瘤之一,目前其发病机制尚未完全明确[10]。除手术治疗之外,针对基因的分子靶向药物及生物制剂的应用也显著提高了CRC的预后。KRAS基因作为一种致癌基因,当KRAS突变后,自身处于活化状态,无法阻断EFGR上游信号,影响血管内皮生长因子(vascular endothelial growth factor,VEGF)抑制剂的治疗效果[11]。KRAS的基因突变主要表现为点突变及基因扩增,点突变主要以第2外显子上的11及12密码子为主,占比96%以上[12]。由于KRAS基因突变率在CRC患者中比例较高,约为30%~50%[13]。故众多针对KRAS突变患者的临床试验也在开展,结果显示KRAS突变抑制剂单用及联合使用均有良好的治疗效果,进一步提示KRAS基因在CRC治疗中的重要性[14]。在本研究中60例CRC患者的KRAS基因突变率为41.7%,其中第2外显子的突变率为84.0%,与相关报道类似。BRAF负责编码RAF激酶蛋白,属于致癌基因的一种[15]。BRAF基因突变主要为第11外显子及15外显子上的突变,第15外显子上的V600E密码子突变约占突变类型的90%[16]。据报道在CRC中BRAF的突变率约为4.7%~20%[17]。虽然BRAF突变率较低,但是多数研究认为BARF突变是西妥昔单抗或帕尼单抗治疗CRC失败的主要原因,且BRAF基因突变可作为西妥昔单抗或帕尼单抗治疗疗效的独立预测因素[18]。本研究结果显示BRAF突变率为8.3%,全部均为第15外显子上的V600E密码子突变,与之前的报道基本吻合。在KRAS及BARF突变的检测中二代测序不仅具有高通量、高敏感度及低成本的优点,且已证实与免疫组织化学等检测结果具有高度的一致性[19]。目前已有研究使用血样样本进行二代测序,更有利于不易获得肿瘤样本组织的患者,且对于有争议性的结果可使用其他样本复核,保证结果的准确性。但是据报道在原发及转移性病灶中,二代测序会显示出不同的基因突变结果,影响药物的选择[20]。在今后的研究中可使用不同方法检测原发、转移性肿瘤组织及外周血,并进行一致性比较,以供参考选择。
关于KRAS及BRAF突变与CRC患者的病理体征的关系相关性研究较多,但是结果则不尽相同。ZAHRANI等[21]在阿拉伯地区的150例CRC患者中研究KRAS突变与疾病分期及发生部位有关。国内的孙耀华等[22]发现1 205例CRC患者中发现KRAS突变更易发生在黏液腺癌及中高分化的患者中。XI等[23]在1 694例CRC患者中发现BRAF突变与原发部位为右半结肠、腹膜转移及远处转移等相关。刘建化等[24]在281例CRC中发现BARF突变在女性及右半结肠癌患者中比例较高。不同研究结果可能与纳入人群的数量及遗传背景不同有关。在本研究中KRAS突变在病理分型及淋巴结转移有关,在中/高分化患者及区域内淋巴结转移较少的患者中占比较高,BRAF基因突变主要与病理分型及远处转移有关,在中/高分化患者及有远处转移患者中占比较高。
目前KRAS突变对CRC患者接受抗VEGF治疗效果仍存在争议,CHIDA等[25]在1 632例CRC患者发现KRAS G12C突变型患者的一线OS及PFS均低于非突变组(PFS中位数:9.4个月vs.10.8个月;OS中位数:21.1个月vs.27.3个月)组与非G12C组患者特征无明显差异,多因素分析也显示KRAS G12C突变预示了患者较短的PFS及OS。在另一项研究中,223例转移性结直肠癌中,KRAS突变降低患者OS,可作为预后预测的独立因素,但是不影响患者的PFS[26]。本研究结果显示KRAS突变或野生状态不影响患者的OS及PFS,且不影响患者的OS,不能作为预测患者预后的不良因素,可能与纳入样本量有关。BRAF基因突变与患者的预后明显相关,AHN等[27]报道BRAF突变患者的5年生存率显著降低。一项对26例结直肠癌患者的荟萃分析发现BRAF突变使死亡风险增加了一倍多(HR=2.25,95%CI:1.82 ~ 2.83),BRAF突变是影响结直肠癌患者生存的绝对危险因素[28]。本研究发现KRAS基因突变与患者的OS无相关性,与BRAF基因突变呈负相关,提示BRAF基因突变可作为CRC预后指标及独立风险因素。
综上所述,在CRC中,KRAS与BRAF突变与患者的临床病理特征关系密切,且一定程度影响患者预后,但是本研究仍有一定的局限性,如在不同分期的肿瘤患者中基因突变对药物选择及预后等的指导意义不一,在以后的研究中更应进行分层研究,为临床治疗提供参考。

