奶渣酪蛋白特性及营养价值分析
许涌捷,王冠华,伍昌军,刘卫震,隋文杰*
(1.天津科技大学食品营养与安全国家重点实验室,食品科学与工程学院,天津 300457;2.天津科技大学轻工科学与工程学院,天津 300457;3.湖北百特威生物科技有限公司,湖北 仙桃 433099)
牦牛乳又被称为“天然浓缩乳”,含有多种营养物质,如蛋白质、维生素、钙以及乳糖等,是高原地区各族人民重要的食品和乳品加工原料[1-2]。奶渣是牦牛乳提取酥油后留下的一种副产物,由提制酥油后的脱脂乳经加热后凝固沉淀、过滤、晒干制得,呈淡黄色块状[3-4]。奶渣作为一种副产品,产量高并且价格低,营养价值丰富,富含蛋白质、乳糖、矿物质及多种维生素[5-6]。林亚秋等[7]测得牦牛奶渣的脂肪含量和蛋白质含量分别为1.69%与63.92%,并且含有16种水解氨基酸,必需氨基酸含量丰富,具有高蛋白、低脂肪的特点,可作为优质蛋白来源。郑旭华等[8]利用碱溶酸沉的方法从奶渣中提取干酪素,并通过调节颗粒度、含脂率、水分含量等获得高品质干酪素。李玉萍等[9]探究九龙牦牛奶渣的氨基酸含量和蛋白组成分析,测得九龙牦牛奶渣中总氨基酸含量约为36.5%,蛋白组分以酪蛋白为主,比例约为82%。李进波等[5]对牦牛奶渣理化成分及干酪素生产工艺进行研究,确定奶渣生产干酪素的最佳工艺参数。目前对奶渣的研究局限于奶渣基本组分的测定和生产干酪素的工艺研究,并没有对奶渣酪蛋白的理化性质和功能特性进行系统分析评价,并且奶渣相关产品的开发也有限,大多为奶渣制备干酪素和蛋白肽,利用价值较低,本研究对奶渣中酪蛋白的理化特性和营养价值进行了系统分析,深入研究了奶渣酪蛋白的各项理化性质,对于提高奶渣的附加值和经济效益具有重要意义。
本文以牦牛奶渣为原料,通过碱溶酸沉的方法分离奶渣酪蛋白,采用多种分析表征手段,对所提取酪蛋白纯度、溶解度、乳化性、表面疏水性、交联度、热稳定性、分子量以及氨基酸含量和潜在活性多肽片段进行分析,并与市售酪蛋白进行对比,为实现奶渣的高值化利用及相关产品的开发提供理论支持。
1 材料与方法
1.1 材料与试剂
奶渣:四川甘孜藏族自治州理塘县;市购酪蛋白1:新西兰恒天然公司;市购酪蛋白2:湖北百特威生物科技有限公司;谷氨酰胺转氨酶(30 000 U/g):山东元泰生物工程有限公司;十二烷基硫酸钠(sodium lauryl sulfate,SDS)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、邻苯二甲醛、Tris-甘氨酸、电泳制胶液、蛋白Marker:北京索莱宝科技有限公司;氢氧化钠(分析纯)、盐酸(分析纯)、石油醚(分析纯)、Tris-盐酸缓冲溶液(分析纯)、甲酸(色谱纯)、乙腈(色谱纯):国药集团化学试剂有限公司。
1.2 仪器与设备
高速离心机(H1850):湖南湘仪有限公司;冷冻干燥机(Scientz-10N/A):宁波新芝生物科技股份有限公司;凯氏定氮仪(Kjeltec):福特(中国)有限公司;傅里叶红外光谱仪(IS50):美国尼高利仪器公司;热重分析仪(TGAQ50):美国 TA 仪器公司;电泳仪(DYY-8C):北京市六一仪器厂;荧光分光光度计(F-7000):日本日立公司。
1.3 奶渣酪蛋白提取及其理化性质测定
1.3.1 奶渣酪蛋白的提取
取1 g奶渣,加入100 mL蒸馏水,用1%氢氧化钠溶液调节pH值为7.5,待完全溶解后,放入高速离心机10 000 r/min离心5 min,除去不溶性杂质和脂肪,取上清液置于烧杯中,然后用1%盐酸溶液调节pH值为 4.6,离心(10 000 r/min、5 min、25 ℃),取沉淀,多次水洗后去除乳糖,于105℃干燥4 h,得到奶渣酪蛋白,经过一次脱脂、碱溶酸沉得到奶渣酪蛋白1,经过两次脱脂、碱溶酸沉得到奶渣酪蛋白2。
1.3.2 基本组分的测定
蛋白质含量的测定参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》;脂肪含量的测定方法参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》;水分含量的测定参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》;灰分含量的测定参照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》;乳糖含量的测定参照GB 5413.5—2010《食品安全国家标准婴幼儿食品和乳品中乳糖、蔗糖的测定》。
1.3.3 溶解度测定
参考Chattaraj等[10]的方法测定蛋白质的溶解度。分别配制不同pH值的Tris-盐酸缓冲溶液(0.1 mol/L,pH2.0~11.0),取 0.2g酪蛋白样品溶于100 mL Tris-盐缓冲溶液中,8000r/min离心15min,取上清液,参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的方法测定上清液中的蛋白质含量,计算不同pH值下酪蛋白的溶解度,其计算公式如下。

1.3.4 乳化性的测定
参考赵城彬等[11]的方法测定蛋白乳化性。取5 mL菜籽油与15 mL待测样品溶液,均质1 min,取100 μL混合液,用质量分数为0.1%SDS溶液稀释至10 mL,在500 nm波长下测定吸光度。将乳状液静置10 min后再以同样的方法稀释并测定,得到的吸光度A1与初始吸光度A0用来衡量乳化活力指数(emulsification activity index,EAI)与乳状液稳定性(end system identifier,ESI)。EAI与ESI计算公式如下。

式中:EAI为每克蛋白质的乳化面积,m2/g;C为溶液中样品蛋白的浓度,1 g/mL;L为比色杯直径1 cm;A为500 nm处的吸光度;N为稀释倍数;Φ为油相所占的分数;ESI为乳状液稳定性,%;A0为初始吸光度;A1为10 min后的吸光度。
1.3.5 表面疏水性的测定
参考Zhang等[12]的方法测定表面疏水性。将待测样品溶液溶解于0.01 mol/L磷酸盐缓冲溶液中,8 000 r/min离心15 min,收集上清液并使得蛋白质浓度在0.02 mg/mL~0.14 mg/mL。取30 μL浓度为2.3 mg/mL的8-苯胺-1-萘磺酸溶液(采用0.01 mol/L pH7.0的磷酸盐缓冲液配制)与3 mL待测蛋白质样品溶液混匀,2 min后测定荧光强度。激发波长390 nm、发散波长470 nm、缝隙波长5 nm,并以荧光强度为纵坐标,蛋白质浓度为横坐标作图,曲线初始阶段的斜率即为蛋白质的表面疏水性指数。
1.3.6 交联度的测定
参考闫爽等[13]的方法并稍作修改。称取2 g谷氨酰胺转氨酶,溶于水中,定容至50 mL容量瓶中,在37℃下保温30 min。取20 mL浓度为5 mg/mL的样品溶液,添加3 mL谷氨酰胺转氨酶溶液,在47℃的恒温水浴中反应120 min。反应结束后,在85℃水浴锅中灭活5 min,取出冷却后,稀释至0.5 mg/mL。吸取稀释后浓度为0.5 mg/mL改性前后的样品溶液2 mL分别和2 mL邻苯二甲醛试剂振荡混合后,精确静止反应2 min后,在336 nm下测定吸光度,依据公式计算样品中游离氨基的含量,邻苯二甲醛试剂的配制参考闫爽等[13]的方法。游离氨基含量和交联度的计算公式如下。

式中:Ai为样品的吸光度;C为样品的浓度,mg/mL;M1为样品交联前游离氨基含量,μg/mg;M2为样品交联后游离氨基含量,μg/mg。
1.3.7 热稳定性测定
通过热重分析测定奶渣酪蛋白的热稳定性。称取5 mg酪蛋白样品置于坩埚中,设置温度量程为20℃~600℃,升温速率为10℃/min,以温度(℃)为横坐标,样品的失重率(%)为纵坐标,记录样品在加热过程中质量随温度的变化,从而得到热重曲线,即TG曲线,并对失重率求一阶导得到失重率的变化曲线,即微商热重曲线。
1.3.8 蛋白凝胶电泳分析
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析奶渣酪蛋白的分子量。分离胶为12%、浓缩胶为4%,取50 μL蛋白分散液(10 mg/mL)加入50μL SDS-PAGE蛋白缓冲液,混合均匀,沸水浴5min,之后取15 μL处理后的样品上样后进行电泳。
1.3.9 傅里叶红外光谱分析
参考薛海燕等[14]的方法稍作修改后测定蛋白二级结构。将干燥后的2 mg样品与200 mg溴化钾混合于玛瑙研钵中,研磨均匀后压成半透明薄片,用傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR)对样品扫描,扫描范围在 4 000 cm-1~400 cm-1,分辨率为4 cm-1,得到不同蛋白质的分子结构光谱图,使用Omnic软件进行数据分析。
1.4 奶渣酪蛋白营养价值分析
1.4.1 氨基酸组成分析
氨基酸组成的测定参考GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》。
1.4.2 一级序列分析
酪蛋白样品经过酶解后,酶解产物经毛细管高效液相色谱分离,液相所用A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液。分离后用Q Exactive质谱仪进行质谱分析,分析时长为60 min,检测方式为正离子,质谱测试原始文件用软件MaxQuant 1.5.5.1检索相应的数据库,分析蛋白的一级序列片段。
1.4.3 活性多肽片段预测
借助 Biopep数据库(https://biochemia.uwm.edu.pl/biopep-uwm/)提供的在线酶解功能与活性多肽数据库,将质谱鉴定到的蛋白多肽片段进行在线模拟酶解,设置为胃蛋白酶和木瓜蛋白酶复合酶解的方式,最终得到蛋白的潜在活性多肽片段。
1.5 数据统计与分析
试验均重复3次,试验数据采用SPSS 22.0软件的ANOVA(变异系数分析)和Tukey法进行方差分析和多重比较。
2 结果与分析
2.1 奶渣酪蛋白的理化性质与二级结构分析
2.1.1 基本组分分析
不同酪蛋白基本组分含量见表1。
由表1可知,奶渣中含量最高的为蛋白质,含量为64.09%,其次为脂肪,含量为9.36%,水分含量和乳糖含量分别为8.54%和6.30%。李进波等[5]研究香格里拉干奶渣湿基蛋白质和脂肪含量分别为59.35%与8.31%。奶渣酪蛋白1的蛋白质含量为91.41%,奶渣酪蛋白2的蛋白质含量为92.26%,奶渣酪蛋白1与奶渣酪蛋白2的蛋白质含量差异不显著(P>0.05),与两种市购酪蛋白的蛋白质含量差异不显著(P>0.05)。奶渣酪蛋白中的脂肪、乳糖含量相较于奶渣明显降低,且酪蛋白含量符合GB 31638—2016《食品安全国家标准酪蛋白》中的酪蛋白标准。

表1 不同酪蛋白基本组分含量Table 1 Basic component content of different casein
2.1.2 溶解度分析
蛋白质溶解度的大小与pH值有关,通常在等电点时溶解度是最低的[15]。不同pH值下奶渣酪蛋白的溶解度见图1。

图1 不同pH值下奶渣酪蛋白的溶解度Fig.1 The solubility of milk residue protein at different pH values
由图1可知,在pH4时,4种酪蛋白的溶解度均最低,奶渣酪蛋白1溶解度为1.51%,奶渣酪蛋白2溶解度为3.16%,市购酪蛋白1溶解度为3.41%,市购酪蛋白2溶解度为1.82%,说明几种酪蛋白的等电点在pH4附近,这与朱玉英等[16]对羊乳酪蛋白等电点的研究结果一致。随着pH值的升高,4种酪蛋白的溶解度逐渐增大,并且在pH11时均达到最大,奶渣酪蛋白1溶解度为80.33%,奶渣酪蛋白2溶解度为82.44%,市购酪蛋白1溶解度为79.92%,市购酪蛋白2溶解度为75.44%,奶渣酪蛋白与市购酪蛋白表现出了同样优异的溶解性能,在碱性条件下有很好的溶解性,良好的溶解性有利于发挥其功能特性,如形成凝胶和泡沫的能力[17]。
2.1.3 乳化性分析
蛋白质的乳化性质是蛋白质的一项重要的功能性质,是指能使油和水形成稳定乳化液的性质[18]。蛋白质的乳化性与其溶解性、表面疏水性等多种因素相关,不同加工方式的蛋白质的乳化能力可能因为蛋白分子量、表面基团分布、变性程度等的变化而变化[19-21]。不同种类酪蛋白的乳化性见图2。
由图2可知,两种奶渣酪蛋白的乳化活力指数与市购酪蛋白1差异不显著(P>0.05),并且奶渣酪蛋白1的乳化液稳定性较高(>70%),与市面上的两种酪蛋白的乳化液稳定性差异不显著(P>0.05),这说明奶渣经过碱溶酸沉等分离纯化的处理后,制备的酪蛋白性能较好,具有优异的乳化能力,可作为成本较低的乳化剂应用于食品领域。

图2 不同种类酪蛋白的乳化性Fig.2 Emulsification of different kinds of casein
2.1.4 表面疏水性
蛋白质在天然状态下,其中的疏水氨基酸残基大多数是处在分子内部,形成疏水内核,从而维持紧密的结构,当蛋白质受到某些外力作用时,包埋在分子内部的疏水基团会暴露在蛋白分子表面,因此蛋白质的疏水性会发生改变[22]。研究蛋白质的疏水性可应用荧光探针法,在一定范围内,最大荧光强度与蛋白质的表面疏水性呈线性关系[23]。不同种类酪蛋白的表面疏水性见图3。

图3 不同种类酪蛋白的表面疏水性Fig.3 Surface hydrophobicity of different kinds of casein
由图3可知,两种奶渣酪蛋白的表面疏水性要高于市购的两种酪蛋白,可能是由于奶渣在制备过程中,由于经过加热等工艺,蛋白质结构展开,包埋于酪蛋白胶束内部的疏水基部分转移至表面,疏水性能增强[12]。蛋白质的二级结构发生变化,一些聚集在α-螺旋、β-折叠处的亲水区域因结构的变化而减少,使蛋白质分子内部的疏水基团暴露,导致荧光强度增强[14]。
2.1.5 交联度的测定
蛋白质交联是常见蛋白改性技术之一,可改善其功能性质,从而发挥更广泛的作用。谷氨酰胺转氨酶(transglutaminase,TGase)可使蛋白质发生交联,引起蛋白质分子聚集,形成更加致密的网状结构,对外界有更强的抵抗能力,显著改善蛋白质的稳定性[24]。不同酪蛋白的交联度见图4。

图4 不同种类酪蛋白的交联度Fig.4 The cross-linking degree of different kinds of casein
由图4可知,市购的两种酪蛋白交联度较高,这是由于几种蛋白结构不同,通过TGase催化交联反应得到的修饰产物游离氨基也存在明显差异,因此交联度会有差异[13]。在交联过程中,TGase催化的蛋白质侧链的赖氨酸及谷氨酰胺残基发生分子内及分子间交联,引起酪蛋白结构改变,从而影响酪蛋白的凝胶性、乳化性、起泡性、黏度和持水能力等[25]。
2.1.6 热稳定性的测定
酪蛋白的热降解特征可通过热重曲线进行测定,4种酪蛋白的热重分析图见图5。


图5 不同种类酪蛋白的热重分析Fig.5 Thermogram of different kinds of casein
由图5可知,4种酪蛋白的第一个失重峰位于50℃左右,在20℃~150℃出现一定程度的质量损失,这主要是样品失水造成的,第二个热降解阶段位于200℃~500℃,质量损失在50%~70%,失重峰出现于310℃左右,此温度区间的失重加快,说明在此过程中样品含有的主要成分即蛋白质发生化学结构降解。两种奶渣酪蛋白和两种市购酪蛋白都具有较好的热稳定性,在300℃下不易分解,在食品的加工过程中,对食品进行热处理是非常重要的一步,因此温度的控制十分必要。对奶渣酪蛋白和市购酪蛋白进行热重分析,可以了解其热稳定性,结果表明奶渣酪蛋白具有良好的热稳定性,在300℃下不易分解,适合于工业热加工处理。
2.1.7 亚基组成分析
根据其主要结构的不同,酪蛋白可以被分为3种不同的类型,即 α-酪蛋白(α-CN)、β-酪蛋白(β-CN)和k-酪蛋白(k-CN)[26-27]。不同种类酪蛋白的SDS-PAGE电泳图谱见图6。
由图6可知,奶渣酪蛋白1、2与两种市购酪蛋白分子量分布大致相同,依据标准蛋白Marker,α-CN和β-CN的分子量分别约为30、26 kDa,还有少量k-CN,分子量约为24 kDa,与朱玉英等[16]对羊乳酪蛋白分子量的研究保持一致。在63 kDa和180 kDa左右有不清晰条带,这可能是由于蛋白不纯或者测定过程中电压不稳造成。
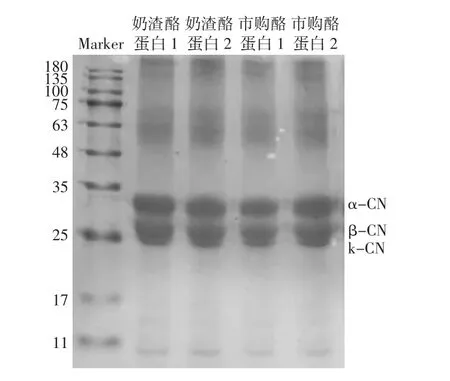
图6 不同种类酪蛋白的SDS-PAGE电泳图谱Fig.6 SDS-PAGE electrophoresis analysis of different kinds of casein
2.1.8 傅里叶红外光谱分析
蛋白质二级结构是指由于主链原子间相互作用而在多肽内部形成的局部折叠结构,其与蛋白质功能特性密切相关[28]。几种酪蛋白样品的红外光谱图见图7。

图7 不同种类酪蛋白的红外光谱Fig.7 Fourier transformation infrared spectroscopy spectra of different kinds of casein
酰胺Ⅰ带的振动频率取决于C=O和N-H之间的氢键性质,此波段的吸收峰主要表示蛋白质分子之间及分子内部形成的二级结构[29]。酰胺Ⅰ带的波长范围为1 700 cm-1~1 600 cm-1。由图7可知,几种蛋白质酰胺Ⅰ带的特征吸收峰分别在 1661、1654、1647、1654 cm-1。
不同种类酪蛋白二级结构含量见表2。
由表2可知,奶渣酪蛋白的α-螺旋和β-折叠含量较高,无规则卷曲含量相对较低,表明奶渣酪蛋白分子能够形成紧密的无空腔结构,二级结构稳定性较好,而与α-螺旋和β-折叠结构相比,无规则卷曲结构的构象稳定性和紧密程度则相对较差[30]。

表2 不同种类酪蛋白二级结构含量Table 2 Secondary structure content of differrent kinds of casein
2.2 奶渣酪蛋白与市购酪蛋白营养价值分析
由两种奶渣酪蛋白和市购酪蛋白理化性质的测定可知,经过两次碱溶酸沉得到的奶渣酪蛋白2相较于奶渣酪蛋白1纯度提升不明显,且得率降低,乳化性和交联度等理化性能差异不明显,基于成本的考虑,在工业生产中,宜选用经过1次碱溶酸沉的奶渣酪蛋白,因此营养价值的分析对象不再包括奶渣酪蛋白2,选取经过一次碱溶酸沉的奶渣酪蛋白1与市购酪蛋白1进行深入研究,包括氨基酸组成分析与潜在活性多肽片段分析。
2.2.1 氨基酸组成分析
奶渣酪蛋白1与市购酪蛋白1的氨基酸组成和含量见表3。

表3 氨基酸组成与含量Table 3 Amino acid composition and content
由表3可知,经过酸解处理后,奶渣酪蛋白1与市购酪蛋白1分别检测出17种氨基酸,与乳蛋白质类似[31],奶渣酪蛋白1富含谷氨酸(13.45%)、脯氨酸(7.49%)、亮氨酸(6.38%)和赖氨酸(5.39%),半胱氨酸(0.10%)和甲硫氨酸(1.82%)含量较少,市购酪蛋白1富含天门冬氨酸(18.56%)、谷氨酸(11.68%)和赖氨酸(8.96%)。奶渣酪蛋白1含有必需氨基酸7种,包括亮氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸、苏氨酸、缬氨酸和赖氨酸,除赖氨酸外的其余6种必需氨基酸含量均高于市购酪蛋白1,其中异亮氨酸(3.75%)和缬氨酸(5.01%)均高于联合国粮食组织和世界卫生组织提出的相对氨基酸评分模式下的儿童推荐值(分别为2.8%、3.5%),亮氨酸(6.38%)、赖氨酸(5.39%)、苯丙氨酸(3.8%)、苏氨酸(2.89%)和甲硫氨酸(1.82%)含量稍低于相对氨基酸评分模式下的儿童推荐值(分别为6.6%、5.8%、6.3%、3.4%、2.8%)。奶渣酪蛋白中氨基酸种类丰富,含有多种必需氨基酸,并且有6种必需氨基酸含量高于市购酪蛋白,表明奶渣营养价值较高,可作为优质蛋白质的来源。
2.2.2 蛋白一级结构及在线酶解分析
本研究中将奶渣酪蛋白1和市购酪蛋白1用胰蛋白酶、胃蛋白酶和木瓜蛋白酶进行酶解,酶解产物经高效液相色谱分离后用质谱仪进行质谱分析,并与活性多肽数据库进行对比,对潜在活性多肽片段进行初步预测,为评估奶渣酪蛋白生理功效提供数据依据[32]。
2.2.2.1 覆盖序列分析
通过MaxQuant可视化分析,得到奶渣酪蛋白1和市购酪蛋白1的一级序列部分片段见表4。样品用胰蛋白酶酶解,作用位点为赖氨酸和精氨酸,因此对应片段末端氨基酸为R或K[32]。
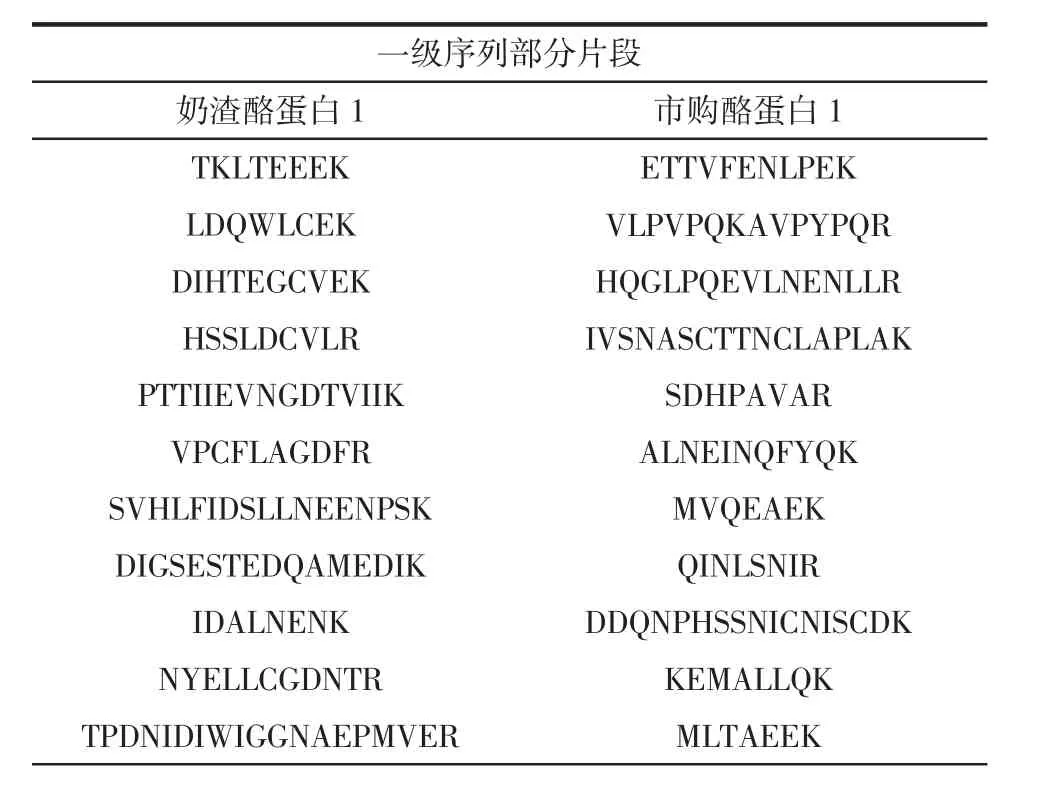
表4 奶渣酪蛋白1和市购酪蛋白1一级序列部分片段Table 4 Partial fragments of primary sequence of milk residue casein 1 and commercially available casein 1

续表4 奶渣酪蛋白1和市购酪蛋白1一级序列部分片段Continue table 4 Partial fragments of primary sequence of milk residue casein 1 and commercially available casein 1
2.2.2.2 活性多肽片段分析
将表4中的片段进行在线模拟酶解,所用酶为胃蛋白酶和木瓜蛋白酶,酶解后与数据库进行比对,得到奶渣酪蛋白1与市购酪蛋白1的潜在活性多肽片段。奶渣酪蛋白1酶解后潜在活性多肽片段见表5。

表5 奶渣酪蛋白1酶解后潜在活性多肽片段Table 5 Potential active polypeptide fragments of milk residue casein 1 after enzymatic hydrolysis
由表5可知,奶渣酪蛋白1共有129条潜在活性肽段,均为二肽或三肽,说明奶渣酪蛋白1酶解较彻底,产生的二肽和三肽更有利于吸收[32]。其中有48条多肽具有降压功能,71条多肽具有降糖功能,部分多肽还具有抗血栓、促进代谢等功效。
市购酪蛋白1酶解后潜在活性多肽片段见表6。

表6 市购酪蛋白1酶解后潜在活性多肽片段Table 6 Potential active polypeptide fragments of commercially available casein 1 after enzymatic hydrolysis
由表6可知,市购酪蛋白1的潜在活性多肽片段,其中27条多肽具有降压功能,37条多肽具有降糖功能,相较于市购酪蛋白,奶渣酪蛋白酶解后的潜在活性多肽片段还具有修护胃黏膜、抗血栓、安神和抗炎等多种生理功效,生理活性更广泛,营养价值更高。
3 结论
为实现奶渣的高值化利用,本文使用牦牛奶渣为原料,通过碱溶酸沉法获得了高纯度的奶渣酪蛋白。研究表明,奶渣酪蛋白在碱性条件下具有较好的溶解性,并且具有良好的乳化性和热稳定性,较高的表面疏水性和碱溶性等理化特性。奶渣酪蛋白含有7种必需氨基酸且其中6种必需氨基酸含量高于市购酪蛋白,酶解后具有多种生理活性的潜在活性片段,可能在降压、降糖等功能上具有一定生理活性,表明奶渣酪蛋白营养价值丰富。研究表明由成本较低的副产物奶渣提取的酪蛋白的各项理化性质与较昂贵的市购酪蛋白没有明显差异且营养价值较高,为实现其高值化利用以及开发相关产品提供了有力的理论支撑。

