子痫前期患者血脂代谢、外周血sFlt-1、sEng水平变化及其相关性
肖学红
四川省成都市郫都区妇幼保健计划生育服务中心(成都市郫都区妇幼保健院)(611730)
子痫前期(PE)是妊娠期的一种多系统进展性疾病[1]。发病机制尚不明确,临床对PE的治疗及早期防控存在困难[2]。有学者认为,寻找与PE病理生理学相关的生物标志物,可帮助临床早期筛查PE人群,实现对PE的早期诊断及干预[3]。内皮细胞激活及功能障碍是PE发病的关键环节,而血脂代谢异常可造成内皮损伤,PE孕妇存在较高的高脂血症发病率[4]。可溶性血管生长因子受体-1(sFlt-1)和可溶性内皮因子(sEng)是反映胎盘功能状态的细胞因子,二者水平变化与妊娠期高血压疾病、不良妊娠结局密切相关[5]。但PE患者血脂代谢指标与外周血sFlt-1、sEng水平变化是否存在相关性尚不清楚。本研究通过观察PE患者血清中血脂代谢指标、sFlt-1和sEng水平变化并探讨其相关性,为临床PE防治提供参考依据。
1 资料与方法
1.1 一般资料
收集2019年1月-2021年1月本院收治的PE患者124例为PE组。纳入标准:①临床检查符合《妇产科学》PE的诊断标准[6];②年龄19~40岁,自然受孕,单胎妊娠;③签署知情同意书。排除标准:①合并自身免疫性疾病、血液性疾病、感染性疾病;②合并重要脏器功能障碍;③既往存在特殊药物服用史。同期产前检查正常妊娠孕妇117例为对照组。本研究经医院伦理委员会批准。
1.2 指标检测方法
PE组入院后次日(对照组产前检查时)取空腹外周静脉血,全自动生化分析仪检测血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和载脂蛋白A(ApoA)等血脂代谢指标。酶联免疫吸附法检测血清sFlt-1、sEng水平,全自动酶标仪测定吸光度(A)450值,标准曲线计算血清sFlt-1、sEng水平。
1.3 PE临床分型
参考《妊娠期高血压疾病诊治指南(2020)》[7]相关标准,根据PE严重程度分为重度和不伴严重表现的PE:①血压持续升高不可控收缩压≥160 mmHg和(或)舒张压≥110 mmHg;②存在上腹部疼痛、中枢神经系统异常表现;③转氨酶水平异常;④肾功能受损,心功能衰竭,肺水肿,肝包膜下血肿或肝破裂;⑤血液系统异常。根据发病时间分为早发型(发病时间<34周)和晚发型(发病时间≥34周)。
1.4 观察指标
①比较PE组和对照组,不同临床分型PE患者的血脂代谢指标、外周血sFlt-1和sEng水平;②分析血脂代谢指标水平与外周血sFlt-1、sEng表达相关性。
1.5 统计学处理
2 结果
2.1 一般资料
两组一般临床资料比较无差异(P>0.05)。见表1。
表1 两组一般临床资料比较
2.2 血脂代谢指标、外周血sFlt-1及sEng水平
PE组血清TC、TG、LDL-C、sFlt-1和sEng水平均高于对照组,HDL-C、ApoA水平均低于对照组(均P<0.05)。124例PE患者中,重度PE患者79例(重度PE),不伴严重表现的PE患者45例(非重度PE),重度PE血清TC、TG、LDL-C、sFlt-1和sEng水平均高于非重度PE患者(P<0.05),二者血清HDL-C、ApoA水平无差异(P>0.05);晚发型患者41例,早发型患者83例,晚发型PE患者血清TC、TG、LDL-C、sFlt-1和sEng水平均低于早发型PE患者(P<0.05),二者血清HDL-C、ApoA水平比较无差异(P>0.05)。见表2。
表2 各组血脂代谢指标、外周血sFlt-1及sEng水平比较
2.3 PE患者血脂代谢指标与外周血sFlt-1、sEng水平相关性
多元线性回归分析显示,PE患者sFlt-1及sEng表达水平与TC、TG和LDL-C均呈正相关(P<0.05),与HDL-C、ApoA水平无相关性(P>0.05)。见表3。
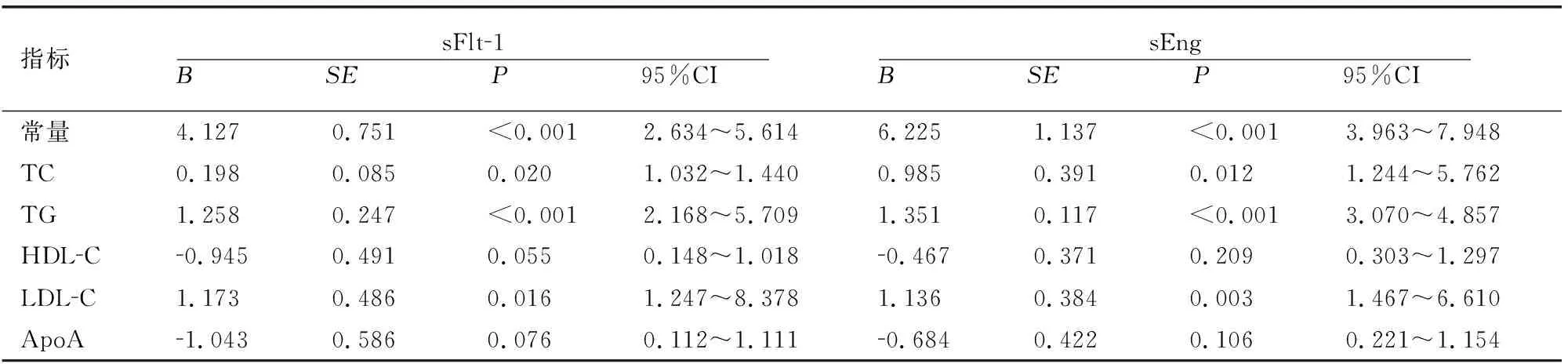
表3 PE患者各指标表达水平的相关性分析
3 讨论
PE是一种多因素、多机制致病的疾病,临床以妊娠20周后出现新发高血压和蛋白尿为主要特征,病情可呈持续性进展,严重影响孕妇及新生儿的生命安全[8]。“胎盘化不足”是PE发病的中心环节。有研究[9]发现,异常的内皮细胞激活及功能紊乱,会导致胎盘新生血管生成失衡,使患者出现高血压和其他临床症状,最终引发PE。血脂代谢异常是导致内皮细胞损伤的主要原因之一,孕妇脂肪过度堆积,会使血管内皮细胞通透性发生改变,引发血管细胞功能障碍,导致血管生成失衡[10]。除血脂代谢异常外,sFlt-1和sEng也是抑制新生血管生成、损伤内皮功能的细胞因子,二者可通过抑制血管内皮生长因子、胎盘生长因子和内皮素等因子的生理效应,发挥血管生成失衡的作用[11]。血脂代谢与sFlt-1、sEng表达之间是否存在相关性,共同参与PE的发生发展尚不明确。
本研究分析显示,PE组血清TC、TG、LDL-C、sFlt-1和sEng水平均高于对照组,HDL-C、ApoA水平均低于对照组,提示EP患者存在血脂代谢异常、外周血sFlt-1、sEng水平升高的现象。一项孕妇血脂异常与PE的回顾性研究[12]发现,血清TC、TG、LDL-C水平异常升高是PE的独立危险因素,会加重氧化应激反应,造成过氧化物堆积,影响成血管内皮功能,参与PE形成,而HDL-C、ApoA作为血管保护性因子,其水平下降会使胆固醇转运发生功能性障碍引发血管硬化。赵影庭等[13]对52例PE患者血清sFlt-1、sEng水平研究发现,与正常妊娠孕妇相比,妊娠期高血压患者和PE患者血清sFlt-1、sEng水平显著升高,认为sFlt-1、sEng异常升高与妊娠期高血压、PE相关。
临床上根据病情严重程度将PE分为重度PE和不伴严重表现的PE;根据发病时间分为早发型和晚发型,其中早发型患者多为重度PE[14]。本研究发现,血清TC、TG、LDL-C、sFlt-1和sEng水平重度PE患者高于不伴严重表现的PE患者,晚发型PE患者低于早发型PE患者,提示不同临床分型PE患者上述指标存在差异。血脂代谢异常会加速胎盘血管内皮细胞的损伤及凋亡,引发绒毛浸润异常,使PE发生更早;而晚发型PE患者长期处于疾病与机体耐受的平衡阶段,当平衡被打破时相关指标水平才发生变化[15]。此外,损伤的血管内皮细胞会进一步促进血脂代谢指标和sFlt-1、sEng释放,形成恶性循环加重PE病情。本研究中,不同临床分型PE患者血清HDL-C、ApoA水平未见差异,考虑与不伴严重表现的PE患者血管内皮损伤较轻、机体脂质代谢异常不明显有关;也与PE进展期间HDL-C、ApoA分泌被抑制,导致各时期表达水平差异较小有关[16]。本研究多元线性回归分析显示,PE患者sFlt-1、sEng表达水平与TC、TG和LDL-C均呈正相关,这可能与血脂代谢异常会使患者体内出现异常内皮细胞激活,导致血管生成失衡,而血管生成失衡使患者处于抗血管生成状态,进而影响sFlt-1、sEng表达水平有关[17]。
综上所述,EP患者存在血脂代谢异常、外周血sFlt-1和sEng水平升高的现象,血脂代谢指标与sFlt-1、sEng水平存在相关性,这些指标可能参与了PE的发生发展。

