乳腺癌血行肺转移模型家兔血小板与凝血功能变化研究
吴国泰 马倩倩陈艳娥杜晓红王晓禹杜丽东∗
(1.甘肃中医药大学 药学院,兰州 730000;2.甘肃省中药药理与毒理学重点实验室,兰州 730000)
2020 年全球最新癌症负担数据显示乳腺癌成为全球第一大癌症,其全球新发病例占新发癌症总数的11.7%,也是全球女性癌症死亡的首位原因,占总数的15.5%[1]。目前,临床采用改良根治手术的方法治疗乳腺癌,但术后复发转移仍是引起患者死亡的最主要原因[2],乳腺癌转移患者中21%~32%发生于肺[3],经血液肺转移是乳腺癌转移复发的主要途径,乳腺癌患者的血液存在一定程度的高凝状态,不仅血小板数量显著上升,同时血小板功能也显著改变[4]。研究发现血小板能引起乳腺癌肿瘤细胞侵袭、转移,帮助肿瘤细胞逃脱免疫系统的攻击杀伤[5]。乳腺癌血行肺转移动物模型已有研究,但模型动物血液血小板与凝血功能变化规律研究鲜见报道,本文从血小板活化和凝血状态的角度探讨乳腺癌血行肺转移模型家兔血液微环境的变化规律,为乳腺癌血行肺转移相关研究提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级新西兰白兔,3 月龄,雄性2 只,体重2.5 kg;雌性12 只,未孕,体重1.5~2.0 kg,均由中国农业科学院兰州兽医研究所实验动物中心提供【SCXK(甘)2020-0001】,生长兔配合饲料由临沂市瑞泰饲料有限公司提供,实验操作均在甘肃中医药大学科研实验中心SPF 级动物实验室进行【SYXK(甘)2020-0003】,所有家兔均分笼饲养,每笼1 只,自由进食及饮水。室温(25.0 ± 0.5)℃,相对湿度(55% ± 5%),明暗各12 h,适应7 d 开始实验,实验方案经甘肃中医药大学实验动物伦理委员会批准(2019-SY011)。
1.1.2 瘤株
VX2 兔实体瘤组织,由广州吉妮欧生物科技有限公司提供。
1.1.3 主要试剂与仪器
阿司匹林肠溶片(由Bayer S.p.A.生产,国药准字J20171021,批号BJ52622)。大鼠抗血浆α 颗粒膜蛋白(GMP-140)ELISA 试剂盒、大鼠血栓素(TXB2)ELISA 试剂盒、大鼠血小板α 颗粒膜蛋白(CD62P)ELISA 试剂盒、大鼠CD63 分子(CD63)ELISA 试剂盒,均购自上海江莱实业股份有限公司,批号分别为JL10386、JL12324、JL50846 和JL20774。
电子天平(北京赛多利斯仪器系统有限公司);电动组织匀浆器(宁波新芝生物科技股份有限公司);低温高速离心机(德国Kendro 公司);光学显微镜(日本尼康公司);全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司);全自动血凝仪(郑州瑞郎光学光源医疗电子有限公司);酶标仪(美国Thermo 公司);生物组织包埋机(JB-P5,武汉俊杰电子有限公司);病理切片机(RM2016,德国徕卡);组织摊片机(KD-P,郑州博邦仪器有限公司)。
1.2 方法
1.2.1 VX2 兔实体瘤在体培养
参考文献[6-7]并改进,将液氮保存的VX2 兔实体瘤组织于37℃水浴解冻、复苏后,按肿瘤组织与生理盐水1∶9(质量(g):体积(mL))比例,用组织匀浆器制备悬液。取雄性新西兰白兔2 只,麻醉,取1 mL 组织悬液注入兔右侧后腿外侧肌内,单笼饲养。每天观察各兔的活动、饮食状态,每3 d 检视1 次接种部位肿瘤生长情况,直至接种部位可见实体瘤形成。
1.2.2 VX2 肿瘤组织悬液制备
家兔后腿外侧肌瘤体直径大于1 cm 时进行瘤体剥离,用8%硫化钠对兔右侧后腿瘤体所在部位脱毛,麻醉,常规消毒无菌条件下剥离实性瘤体,瘤体用生理盐水冲洗后,切除边缘纤维结缔组织,置于有生理盐水的无菌培养皿中将瘤块剪碎,按质量∶体积比1∶9(肿瘤组织:生理盐水)用组织匀浆器制备肿瘤组织悬液,备用。
1.2.3 VX2 细胞悬液制备
参考文献[8-9]并改进,取20 mL VX2 组织悬液在低温条件下(4℃)1500 r/min 离心5 min,弃上清液;用200 目细胞滤网过滤,置于冰预冷的试管内,1500 r/min 离心5 min,弃上清液,试管内加入适量PBS 液轻轻振荡混匀,用300 目细胞滤网过滤,去细胞团块,500 r/min 离心5 min,弃上清液,再加15 mL PBS 液混匀,显微镜下细胞计数并调整浓度约为1 × 106/mL。
1.2.4 乳腺癌血行肺转移家兔模型建立
取雌性兔12 只,体重1.5~2.0 kg,随机抽取6只作为模型组,麻醉,仰位固定,用碘伏消毒,在左侧第3 乳房乳垫注射组织悬液每只0.3 mL,确认无出血无渗出后,碘伏消毒;模型组家兔再经耳缘静脉注入VX2 细胞悬液每只0.3 mL;剩余6 只作为正常组,注射等容量生理盐水,所有家兔单笼饲养。
1.2.5 检测指标
(1)一般状态:观察各组家兔精神状态、饮食情况。若有家兔死亡,记录死亡时间,并大体解剖。每7 d 称体重1 次,并用卡尺测量家兔乳腺移植性肿瘤的长、短径,计算肿瘤体积,肿瘤体积(mm3)=0.5×长径(mm)×(短径(mm))2。
(2)血小板相关参数检测:各组家兔每7 d 耳缘静脉采血20 μL,置于含有40 μL EDTA 的EP 管中,用全自动血液细胞分析仪检测 PLT、MPV、PDW、PCT。
(3)凝血指标检测:各组家兔每10 d 麻醉后,用含有柠檬酸钠的抗凝管心脏采血2 mL,充分混匀,4℃条件下1500 r/min 离心15 min,分离血浆,用全自动血凝仪测定血浆PT、APTT、TT、FIB 及D-D 二聚体。
(4)血小板活化因子检测:造模第42 天,麻醉家兔,心脏取血约5 mL,室温静置2 h,以1500 r/min离心20 min,分离血清;心脏取血2 mL 置于含EDTA 的抗凝管中,充分混匀,4℃条件下1500 r/min离心15 min,分离血浆;ELISA 法检测血清CD62P、CD63、TXB2及血浆GMP-140 含量。
(5)肿瘤组织、肺组织形态检测:造模第42 天,各家兔心脏取血后,静脉空气栓法处死,模型组在移植瘤所在乳房局部脱毛、消毒、切口,摘取实体瘤组织,正常组取部分乳垫;开胸,取出全部肺,用生理盐水清洗表面血渍,检视大体形态。取部分实体瘤块和右肺组织,用10%甲醛固定,石蜡包埋、切片,HE 染色,光镜下观察组织形态学变化。
1.3 统计学分析
所有数据采用SPSS 19.0 软件进行处理,符合正态分布的数据采用平均值 ± 标准差()表示,不符合正态分布则采用中位数表示,采用独立样本t检验、重复测量方差分析(正态分布)或秩和检验(非正态分布)进行比较,P<0.05 有统计学意义。
2 结果
2.1 一般状态
正常组家兔和模型组家兔造模前状态良好、反应灵敏、活泼好动、毛色洁白有光泽、饮食正常、体表未见肿块、乳房未见异常、大小便正常。造模后1~21 d,模型组6 只家兔精神状态较好,与造模前无明显差异,体重增加。第28~42 天,模型组家兔精神状态逐渐变差,反应迟钝,活动量减少,毛色暗淡杂乱,局部脱落,饮食减少,体重逐渐下降(P<0.05,P<0.01),42 d 内无家兔死亡(见图1)。

图1 各组家兔体重变化情况(n=6)Note.Compared with the normal group,∗P <0.05,∗∗P <0.01.(The same in the following figures)Figure 1 Body weight change of rabbits(n=6)
2.2 肿瘤生长情况
正常组家兔在实验期间乳房未见明显变化,躯体各部位未见实体肿块。模型组家兔造模7 d 后,左侧第3 乳房部位肉眼可见小结节,质硬,瘤体边界清楚,形状规则,触诊活动度较差,第14 天肿瘤体积明显增大,但均无统计学意义;第21~42 天,移植瘤体积迅速增大(P<0.01),个别家兔移植部位皮肤溃烂,渗血、结痂(见图2)。
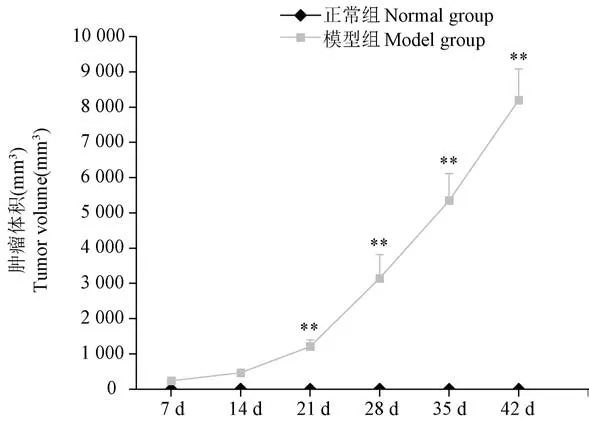
图2 各组家兔肿瘤体积变化情况(n=6)Figure 2 Changes of tumor volume in rabbits(n=6)
2.3 外周血血小板相关参数变化
造模前及造模第7 天,各组家兔PLT、MPV 无显著性差异;与正常组相比,造模第14~42 天,模型组家兔PLT 和MPV 明显升高(P<0.05,P<0.01)。造模前各组家兔外周血PCT 无显著性差异;与正常组相比,造模第14~42 天,模型组家兔外周血PCT 均逐渐升高(P<0.05,P<0.01)。实验期间,各组家兔外周血PDW 均无显著性差异。结果提示模型家兔血小板的数量和功能发生了明显改变,表现为血小板活化和数量增多(见图3)。

图3 家兔外周血血小板相关参数变化(n=6)Figure 3 Changes of platelet related parameters in rabbit peripheral blood(n=6)
2.4 外周血PT、APTT、TT、FIB 和D-二聚体含量变化
造模前,各组家兔外周血PT、APTT、TT、FIB 和D-二聚体含量均无显著性差异;与正常组相比,造模第10、20、30 天,模型组家兔PT、APTT、TT 均明显缩短(P<0.05,P<0.01),且随时间延长,缩短幅度加大;第10、20、30 天,模型组家兔FIB、D-二聚体含量均明显升高(P<0.05,P<0.01),表明模型组家兔外周血凝血速度加快,纤维蛋白降解程度较高(见图4)。

图4 家兔外周血PT、APTT、TT、FIB 和D-二聚体变化(n=6)Figure 4 Changes of PT,APTT,TT,FIB and D-dimer in rabbit peripheral blood(n=6)
2.5 血清CD62P 和CD63 含量变化
造模第42 天,与正常组比,模型组家兔血清CD62P 和CD63 含量显著升高(P<0.01)(图5)。

图5 兔血清CD62P 和CD63 含量变化(n=6)Figure 5 Changes of CD62P and CD63 in rabbit serum(n=6)
2.6 血清TXB2 和血浆GMP-140 含量变化
造模第42 天,与正常组相比,模型组家兔血清TXB2和血浆GMP-140 含量均显著升高(P<0.01)(见图6)。

图6 家兔血浆TXB2 和GMP-140 含量变化(n=6)Figure 6 Changes of plasma TXB2 and GMP-140 in rabbits(n=6)
2.7 肿瘤组织形态变化
正常组家兔各乳房部位及全身未见肿块,皮肤及乳垫组织HE 染色后光镜下可见腺体细胞完整、排列整齐紧密,大小均一,未见炎性细胞;模型组家兔可见移植部位的瘤体呈结节状,与周围组织边界清晰,质韧,剥离切开后内见肿瘤血管丰富、不同程度灶性坏死、出血;HE 染色后光镜下可肿瘤细胞排列紧密,大小不等,呈不规则的团块状或条索状,核大,染色较深,多见瘤巨细胞和多倍体细胞,易见核分裂,大量炎性胞浸润(见图7)。

图7 家兔乳腺肿瘤组织形态的变化Figure 7 Histological changes of breast tumors in rabbits
2.8 肺组织形态变化
正常组家兔肺组织柔软红润,表面光滑,形态正常,HE 染色后光镜下可见肺泡腔呈空泡状、薄壁结构,大小均匀;模型组家兔肺组织不同程度充血,表面多处可见明显肿瘤转移灶,边界清晰,镜下可见瘤细胞弥漫性分布,大小不一、质实、染色深,转移瘤细胞排列紧密、核大深染、核膜清晰、核仁明显,核分裂增多(见图8)。

图8 家兔肺组织形态的变化Figure 8 Morphological changes of lung tissue in rabbits
3 讨论
恶性肿瘤的血行转移是一个复杂的过程,近年来,肿瘤血行转移血液环境因素对肿瘤转移的影响越来越受到人们的重视,尤其血小板的变化是研究的热点。有证据表明,在恶性间皮瘤、妇科恶性肿瘤、肾、胃、结肠直肠癌和乳腺癌等多种恶性肿瘤中都存在血小板活化现象[10-11],且血小板聚集和活化现象越明显,血行转移也越多;相反,研究发现加入抗血小板药物如肝素、阿司匹林等可明显减弱肿瘤的转移[12-13]。
乳腺癌动物模型包含自发型、诱发型、移植型、转基因型等,每种模型都有各自的特点和应用条件,其中移植性乳腺癌动物模型,造模周期短,成本低,肿瘤生长速度和个体差异较小,成功率高[14]。乳腺癌是伴有远处转移最常见的恶性肿瘤之一,癌细胞直接或经血行传播侵入血循环而至远处转移,其中最常见的远处转移部位为肺[15]。有研究比较了皮下接种、乳垫接种、尾静脉接种、心内接种4 种方法制备的小鼠乳腺癌移植瘤模型肿瘤进展与转归情况。结果显示,皮下接种无转移,乳垫接种出现肺部转移,尾静脉接种瘤细胞主要集中于肺部,心内接种组瘤细胞呈现全身播散,认为乳垫接种制备的移植瘤模型,操作简便,与临床病理过程相近,适合乳腺癌的基础与药理研究;尾静脉接种适合进行乳腺癌肺转移的研究[16]。
综合前期研究报道,我们发现乳腺癌血行肺转移动物模型通常采用BALB/c 纯系小鼠尾静脉注射[17],或第二乳头的脂肪垫注射[18]4T1 乳腺癌细胞株,均成功建立乳腺癌肺转移小鼠模型。但家兔乳腺癌肺转移模型报道较少,其实家兔比小鼠在该模型复制中有更多的优势,如血液样本、组织标本载量大,可以更好的进行动态检测等。我们选用体型较大的家兔做为模式生物,并改进了乳腺癌血行肺转移家兔模型,技术要点包括乳腺癌家兔模型的复制和乳腺癌家兔肿瘤肺转移模型的两部分,首先建立移植性乳腺癌家兔模型尤为重要,用VX2 组织悬液乳垫注射法操作简便、成瘤率高,是理想的模型制作方法,可在短期内提供生长迅速、性质稳定、容易发生多组织脏器转移的移植性乳腺癌兔模型,动物模型病程进展和人类转移性乳腺癌相似,且肿瘤出现时间为21 d,与文献报道一致[6,19],尤其在第42 天未见家兔死亡,提示更适宜于长疗程药物的药效学实验。
在成功复制移植性乳腺癌家兔模型的基础上,经耳缘静脉给予VX2 细胞悬液进行血行刺激建立BCLM 家兔模型,所有模型组家兔肺部均存在转移灶,成模率100%。两种因素复合刺激所建立的BCLM 家兔模型既符合临床病理过程,又符合靶向性较高的肺转移研究,为进一步研究乳腺癌的肺转移的药效学实验提供了可靠的方法学基础。
本研究所建立的BCLM 模型家兔血液系统环境异常,血小板数量和活性明显增高,血液出现高凝血状态,也存在纤维蛋白降解加速等,与临床乳腺癌晚期患者凝血异常、血栓增多等并发症基本吻合[20]。本研究对肿瘤细胞与血小板之间的相互作用尚未进一步验证和阐述,理论上讲当肿瘤细胞在肺泡间微血管中传输时,分泌的细胞因子刺激血小板活化,导致血小板聚集和肿瘤细胞-血小板栓子形成,形成癌栓,可以通过血栓弹力图进行表征;当模型家兔肿瘤细胞游离入血时,体内血小板就会被肿瘤细胞激活,从而处于过度活化状态。这也是肿瘤患者血液普遍存在高凝状态的原因之一,亦需要在药效学研究过程中加以评估。

