天目山银杏根区土壤固氮微生物群落沿海拔梯度的分布特征①
吴 狄,杨 腾,林臣峰,付 晓,赵云鹏,褚海燕*
天目山银杏根区土壤固氮微生物群落沿海拔梯度的分布特征①
吴 狄1,2,杨 腾1,林臣峰3,付 晓1,2,赵云鹏3,褚海燕1,2*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049;3 浙江大学生命科学学院植物系统进化与生物多样性实验室,杭州 310058)
土壤微生物多样性的海拔分布规律已被广泛研究,然而单一木本植物根区土壤固氮微生物的海拔分布特征尚不清楚。本研究采集了浙江省天目山308 ~ 1 236 m海拔范围内的161棵野生银杏树的根区土壤,利用Illumina高通量测序研究了土壤固氮微生物的多样性、群落组成及其空间分布。结果表明:固氮微生物多样性(Shannon与Richness指数)随海拔高度增加而降低,群落异质性随海拔差值增大而增加。慢生根瘤菌属、根瘤菌属、疣微菌属等优势属的相对丰度与海拔显著正相关,而地杆菌属、固氮菌属、伯克霍尔德菌属等优势属的相对丰度与海拔显著负相关。进一步分析发现,固氮微生物多样性和群落组成与土壤N∶P均呈最显著相关,上述优势属的相对丰度同样与土壤N∶P有着极强的相关性。结构方程模型显示,海拔可以直接或通过影响土壤N∶P间接作用于固氮微生物多样性和群落组成。通过随机森林模型分别鉴定出与海拔、N∶P紧密相关的物种,发现这两类物种具有较大比例(45%)的重合。综上,土壤N∶P是天目山银杏根区土壤固氮微生物群落沿海拔分布的关键驱动因子,N∶P的变化直接影响银杏固氮微生物群落。本研究的发现从土壤微生物学角度为天目山野生银杏的保护提供了科学依据。
土壤固氮微生物;海拔;天目山;银杏
微生物海拔分布规律对于解释控制微生物多样性与群落组成的潜在驱动机制至关重要[1-2]。在山地生态系统中,微生物细菌群落对海拔有着不同的响应,其多样性随海拔单调递减[3],随海拔呈U型或驼峰型变化[4-5],以及没有明显的海拔规律[6]。这种响应的差异可能是生态系统中多种环境因素或与微生物相关的未检测到的因素的复合效应的结果[4]。在一定海拔范围内,沿着海拔梯度变化的土壤因子往往是形成微生物多样性与群落组成沿海拔变化的关键所在[7-10],不同山区的驱动因子存在差异。如Wang等[11]发现,土壤全磷可以预测土壤细菌多样性的沿海拔变化趋势(中国、欧洲部分山区);Liu等[12]发现,pH与海拔的强耦合决定了紫金山土壤细菌群落的分布;Shen等[13]研究结果显示,土壤硝态氮主导了东灵山土壤细菌群落的海拔分布。为了更好地研究生态系统中特定生态功能的变化规律,越来越多的研究开始关注功能微生物的海拔分布规律。近期研究发现,土壤碳、氮以及植物丰富度是推动贡嘎山固氮微生物沿海拔分布的关键因素[14];而在东灵山,固氮微生物多样性随海拔上升而增加很大程度上取决于土壤含水量的变化[13]。由此可见,与土壤细菌类似,不同山区的固氮微生物的海拔分布规律似乎也存在差异,为了更准确地解析当地生态功能的变化规律,研究单一山地系统内固氮微生物的海拔分布规律是必不可少的。
植物可以通过其根系分泌物以及凋落物选择性地招募微生物类群[15-16],这可能会导致即使在相同的山地系统中,不同种植物的根区土壤微生物群落具有一定的差异。相关研究发现,不同类型的森林定殖着显著不同的微生物[17],植物系统发育与森林土壤微生物的群落组成紧密相关[18]。而关于土壤微生物海拔分布规律,先前的研究大都是按照海拔梯度采集空地土壤样品[3,5,14],很少有研究沿海拔采集单一作物的根区土壤,因而植物群落可能会协同土壤理化性质对土壤固氮微生物的群落造成叠加影响[14,17]。通过控制植物种类,研究单一植物根区土壤微生物的变化不仅可以为土壤微生物的海拔分布规律提供精细参考,而且能够针对性地理解该地区土壤生态过程与植物生长发育的关联,进而为更好地保护当地植物物种提供指导[19-20]。
银杏()起源于2亿多年前,是现存种子植物中最古老的孑遗植物,是漫长自然历史下的宝贵遗产和活化石[21]。银杏在浙江省分布广泛,其中天目山是我国重要的古银杏群落集中区和野生银杏产区[22],具有重要的经济、文化与药用价值[23]。土壤固氮微生物多样性和群落组成对植物固氮及植物生长发育具有重要意义[15, 24],然而,目前关于银杏固氮微生物群落的研究尚未见报道。本研究首次在浙江省天目山区选取野生银杏树161棵(包括大部分的银杏古树),使用基因高通量测序分析其根区土壤固氮微生物的海拔分布特征,探索影响银杏根区固氮微生物群落沿海拔分布的主要因素,以期为提高野生银杏生物固氮潜力、维系健康稳定的银杏居群提供科学参考。
1 材料与方法
1.1 研究区概况
研究区为天目山国家级自然保护区,位于浙江省西北部杭州市临安区天目山镇内,地理位置30°18′30″ ~ 30°21′37″ N,119°24′11″~ 119°27′11″ E。保护区内气候温和,处于中亚热带向北亚热带过渡区域,四季分明。
1.2 样品采集与处理
2020年8月,在海拔308 ~ 1 236 m内,共采集161棵野生银杏树根区土壤样品。采样时,去除表层凋落物后,在每棵银杏树根部附近,随机收集6份土壤样本(0 ~ 10 cm),随后将其混合均匀为1份样品。将新鲜的土壤样品过2 mm筛,去除可见根和其他残留物后,进一步分成2份子样,一份储存在–40℃用于土壤DNA提取,另一份储存在4℃用于测量土壤理化性质。
1.3 分析项目与方法
1.3.1 土壤化学性质与植物变量测定 参照Yang等[18]的方法,测量土壤pH、水分(Moisture)、溶解性有机碳(DOC)、溶解性有机氮(DON)、铵态氮(NH4+-N)、硝态氮(NO3–-N)、全碳(TC)、全氮(TN)、全磷(TP)、全钾(TK)、有效磷(AP)、速效钾(AK),并计算C∶N、N∶P与C∶(N∶P)。测定土壤 pH 时,取相当于 5 g 干土的新鲜土样,加入 25 ml 无CO2水,放置于磁力搅拌器上搅拌 30 min后用 pH 计(FE20-FiveEasyTM pH, Mettler Toledo, German)进行测定。土壤含水量(Moisture):称取 5 g新鲜土壤样品装入铝盒中放置于 105℃烘箱中烘干至恒重,测定土壤中水分的质量百分比。DOC 和 DON 的测定:称取 5 g 过 60 目的新鲜土样置于 250 ml 的塑料瓶中,加入 50 ml 2 mol/L 的 KCl 溶液,振荡1 h后用滤膜过滤,用总有机碳–总氮(TOC-TN)分析仪测定(Shimadzu,Kyoto,Japan)。土壤全碳和全氮测定:土壤自然风干后,磨细,过 100 目筛后使用碳氮分析仪(Vario MAX,Elementar,Germany)测定。土壤全磷和全钾测定:土壤自然风干后,磨细,过100 目筛后,采用钼蓝比色法测定全磷,采用火焰光度计法测定全钾。NH4+-N 与NO3–-N 的测定:取 10 g 过 2 mm 筛的新鲜土样置于 250 ml 塑料瓶中,加入 2 mol/L KCl 溶液 100 ml,振荡 1 h,干滤纸过滤,滤液用连续流动分析仪测定(AAIII; Bran and Luebbe, Germany)。植物变量:胸径(DBH, diameter at breast height)通过测量银杏树距离地面1.3 m处的截面直径所得;性别(Gender)通过观察银杏有无结果所得。
1.3.2 土壤微生物DNA提取与扩增 称取0.5 g新鲜土壤,使用Fast DNA SPIN试剂盒(MP Biomedicals,Santa Ana,CA,USA)进行总DNA提取。使用引物对(5'-AAAGGYGGYGG WATCGGYAARTCCAC-3')/(5'-TTGTTSGCSGCRTACATSGCCATSGCCAT-3')扩增基因。PCR在含有4 μl 5×FastPfu缓冲液、2 μl dNTPs、正向引物与反向引物各0.8 μl、0.4 μl fastPfu聚合酶、10 ng模板DNA和双蒸水(ddH2O)的20 μl反应体系中进行。扩增条件:95℃预变性3 min,95℃变性30 s,55℃退火30 s,72℃延伸45 s,35个循环,72℃ 10 min。扩增产物在 Illumina MiSeq PE 300上进行测序。
1.3.3 生物信息分析 固氮菌基因核酸序列在生物信息学软件 QIIME 中进行分析(http://qiime.sourceforge.net/)。首先进行质控,剔除 score < 25的序列、错误序列以及与引物或与 barcode 信息不匹配的序列;将保留的序列在 FunGene平台上进一步转化为氨基酸序列;翻译蛋白与nifH蛋白序列不匹配的或含有终止密码子的序列被剔除;接着,将序列按照基因数据库参考序列进行对齐,删除不能对齐的序列或含嵌合体的序列;剩余的高质量序列采用 UCLUST 方法按照 95% 的核酸相似性进行聚类,得到相应的固氮菌操作分类单元(operational taxonomic units,OTU),用 FastTree软件对已对齐的代表序列构建进化树。本研究从161份样品中获得了3 204 298条高质量序列,为了消除不同测序深度对固氮菌群落多样性的影响,将所有样品序列数抽平至7 063(所有样品中的最小序列数)。
1.3.4 统计分析 在R软件中对数据进行统计分析与可视化。使用phyloseq包计算固氮微生物alpha多样性:香农指数(Shannon)与丰富度指数(Richness)。使用vegan、ecodist、psych与relaimpo包进行多元线性回归分析、Spearman 相关性分析、Mantel检验以及基于矩阵的多元回归分析(multiple regression analysis on matrices,MRM),进而揭示影响固氮微生物多样性与群落结构分布的主要因子。使用Hmisc、minpack.lm与stats4包将固氮微生物群落与中性群落模型(neutral community model,NCM)进行拟合,以量化中性过程对固氮微生物群落构建的重要性,其中2,该值越高表明越接近中性群落模型,即群落的构建受随机性过程的影响越大;量化了群落层面的迁移率(migration rate),该值越小说明整个群落中物种扩散越受限制。使用picant包计算固氮微生物群落间的净种间最近亲缘关系指数 βNTI与基于 Bray– Curtis 距离的Raup Crick 指数(RCbray),通过 βNTI和 RCbray两个指数评估异质选择(βNTI > 2)、同质选择(βNTI < –2)、扩散限制(|βNTI| < 2 且 RCbray > 0.95)、匀质扩散(|βNTI| < 2 且 RCbray < –0.95) 和非主导过程(|βNTI| < 2 且| RCbray | < 0.95)对固氮菌群落构建的相对贡献。使用randomforest 与rfPermute包鉴定对海拔与土壤N∶P响应的关键物种集。使用ggplot2 与heatmap包进行可视化分析。另外,使用IBM SPSS Amos 21进行结构方程模型构建[25]。
2 结果与分析
2.1 固氮微生物多样性和群落组成沿海拔分布特征
随着海拔升高,固氮微生物多样性显著降低(图1A、1B)。由图1C可知,基于Bray-Curtis 距离的群落组成变化与海拔有显著的相关性(0.325,=0.001),随着海拔跨度的增加,固氮微生物群落相似度降低。
为进一步展现固氮微生物群落沿海拔的分布特征,选取相对丰度>2% 的12个属,将其相对丰度与海拔进行相关性分析(图2),可以发现,慢生根瘤菌属 ()、根瘤菌属 () 与疣微菌属 ()的相对丰度与海拔显著正相关;而固氮菌属()、伯克霍尔德菌属 ()、地杆菌属()等的相对丰度与海拔显著负相关;此外,生丝微菌属 () 与 黄杆菌属 () 的相对丰度与海拔无显著相关性。

图1 固氮微生物Shannon指数(A)、Richness指数(B)与海拔的线性回归分析及固氮微生物群落异质性与海拔差值的相关性(C)
2.2 土壤、植物变量与固氮微生物多样性及群落组成的相关性
由表1可知,在所有变量(土壤与植物变量)中,土壤N∶P、C∶N与pH 是导致固氮微生物Shannon指数变化的主要因素,N∶P与AP 是导致固氮微生物Richness指数变化的主要因素,其中N∶P对Shannon与Richness指数变化贡献度最大,分别达51.5% 与85.5%。图3表明,随着N∶P增加,固氮微生物多样性显著降低。
中性群落模型分析结果显示,固氮微生物群落与中性群落模型拟合度较低(2=0.239,图 4A);零模型分析进一步表明,在固氮微生物群落构建过程中,异质性选择占主导过程,比例高达44.53%,而同质性选择占0.02%,匀质扩散占 0.36%,扩散限制占 29.96%,非主导过程占 23.93%(图4B)。为了分析影响固氮微生物群落组成的主要因子,本研究进行了MRM分析,结果显示,MRM解释了固氮微生物群落组成总变异的18.9%,其中N∶P对群落组成变化的贡献度最大(=0.027,<0.001;表2),银杏树胸径(DBH)与性别(Gender)对固氮微生物群落组成变化有微弱但显著的影响(DBH:=0.009,=0.002;Gender:=0.003,=0.006;表2)。
同样,选取相对丰度>2% 的12个属,分析其相对丰度与N∶P的相关性,结果与海拔分析结果相似(图5):慢生根瘤菌属 ()、生丝微菌属 ()、根瘤菌属 ()、疣微菌属 () 等的相对丰度与N∶P呈显著正相关;固氮菌属()、伯克霍尔德菌属()、脱氯单胞菌属()、地杆菌属()等属的相对丰度与N∶P显著负相关;此外,固氮螺菌属 () 与贪铜菌属 ()的相对丰度与N∶P无显著相关性。
2.3 固氮微生物关键指示种与海拔、土壤因子的关系
海拔与N∶P显著正相关,且在所有变量中相关性最高(=0.680,图6A)。结构方程模型显示,固氮微生物多样性与海拔(Estimate= –0.275)、N∶P (Estimate= –0.253)显著负相关,群落异质性与海拔差值(Estimate=0.235)、N∶P差值(Estimate=0.199)显著正相关,模型中海拔与N∶P具有显著的相关性,这表明海拔可以直接影响或通过影响N∶P间接影响固氮微生物群落(图7)。分别以海拔与N∶P为响应变量,通过随机森林模型,以%IncMSE即increase in mean squared error为标准,选取排名前20的物种作为指示种,分别称为海拔指示种与N∶P指示种。如图6所示,不论是海拔指示种,还是N∶P指示种,其相对丰度都与海拔以及N∶P有相似的相关性。值得注意的是,其中有9个物种为海拔与N∶P的共有指示种,分别为相对丰度与两者显著正相关的(慢生根瘤菌属)、(慢生根瘤菌属)、(红假单胞菌属)、(运动发酵单胞菌)以及相对丰度与两者显著负相关的(甲基杆菌属)、(地杆菌属)、(脱氯单胞菌属)、(伯克霍尔德菌属)与(脱氯单胞菌属)。
此外,一些海拔指示种与海拔及其他土壤因子表现出相似的关系(图6B)。如相对丰度与海拔显著正相关的(慢生根瘤菌属)、(慢生根瘤菌属)、(疣微菌属)等指示种,同时与DOC、DON、NH4+-N、NO3–-N、TC、TN等土壤养分显著正相关;相对丰度与海拔显著负相关的(甲基杆菌属)、(伯克霍尔德菌属)、(地杆菌属) 与(脱氯单胞菌属)等指示种,同时与DOC、DON、NH4+-N、NO3–-N、TC、TN等土壤养分显著负相关。

图2 固氮微生物优势属的相对丰度与海拔的相关性

表1 银杏根区土壤固氮微生物多样性的驱动因素
注:Shannon指数的多元回归全模型解释率:5,15512.15,2=0.214,2adj=0.199,<0.001;Richness指数的多元回归全模型解释率:2,158=20.34,2=0.205,2adj=0.195,<0.001。

图3 固氮微生物多样性指数与N︰P的线性回归分析
类似地,一些N∶P指示种与N∶P及其他土壤因子表现出相似的关系(图6C)。如相对丰度与N∶P显著正相关的(慢生根瘤菌属)、(疣微菌属)等指示种,同时与DOC、DON、NH4+-N、NO3–-N、TC、TN等土壤养分显著正相关;相对丰度与N∶P显著负相关的(脱氯单胞菌属)、(地杆菌属) 等指示种,同时与DOC、DON、NH4+-N、NO3–-N、TC、TN等土壤养分显著负相关。

(图中R2表示模型解释率,m表示迁移率)

表2 基于Bray-Curtis距离的MRM分析结果
注:基于Bray-Curtis 距离的 MRM全模型解释率:2=0.189,<0.001;2表示由表中所有变量对ln(Bray-Curtis距离)变化的总解释度;偏回归系数和显著性通过排列检验得到(nperm=9 999)。
3 讨论
本研究发现天目山野生银杏根区土壤固氮微生物群落具有明显的海拔分布特征。首先,其多样性随海拔升高单调递减。尽管缺少关于单一木本植物根区土壤固氮微生物海拔分布的研究,但与先前研究发现土壤微生物多样性与海拔有明显的相关性结果一致,如在贡嘎山海拔3 000 ~ 4 100 m处,土壤固氮微生物多样性随海拔升高而降低[14];Shen等[26]发现,中国长白山局部(2 000 ~ 2 500 m)苔原生态系统土壤细菌群落多样性丰富度随海拔升高呈线性下降趋势;Bryant等[27]发现,美国落基山脉局部(2 460 ~ 3 380 m)细菌丰富度和系统发育多样性随着海拔升高单调下降。本研究首次揭示了山地生态系统中(308 ~ 1 236 m)银杏根区土壤固氮微生物多样性的海拔分布规律。然而,在更大的海拔跨度上,秘鲁安第斯山东部(440 ~ 3 250 m)细菌多样性与海拔无明显关系[6]。因此,为了更全面地揭示银杏根区土壤固氮菌多样性的分布规律,还需要更大尺度的试验设计与分析。此外,银杏根区土壤固氮微生物群落组成与海拔具有显著相关性,海拔跨度越大,群落差异越大,这可能是由于不同类别的固氮菌占据了不同的海拔位点。如在较低海拔处相对丰度较高的为固氮菌属、地杆菌属、伯克霍尔德菌属等,而在较高海拔处根瘤菌属、慢生根瘤菌属与疣微菌属占一定优势。
在大尺度上,气候往往是影响微生物群落分布的主导因子[28];而在小尺度上,由于在某一气候带长期适应的种群往往占据相似的气候生态位,不同地点土壤因子的较大差异是造成土壤微生物组成和丰度显著变化的首要原因[9-10]。资源化学计量在微生物的生长和功能发挥中起着至关重要的作用,近期研究发现在整个森林演化过程中,基质化学计量主导了氮素固定速率,其中演化程度通过正调控土壤氮含量间接影响土壤碳氮比,进而正调控土壤固氮效率[29]。Reed等[15]指出,相比单独使用氮(N)或磷(P),N∶P可以更好地预测氮固定率。在本研究中,土壤N∶P是影响天目山银杏根区土壤固氮微生物群落沿海拔分布的主要因素,主要表现在以下5个方面:① N∶P是解释固氮微生物群落多样性变化的首要土壤因子,群落多样性随着土壤N∶P增加而降低,这与其随海拔变化趋势基本吻合;② N∶P是解释固氮微生物群落结构变化的首要土壤因子;③ 主要固氮微生物属的相对丰度随N∶P变化趋势与随海拔变化趋势相似;④ 海拔与土壤N∶P具有最高的相关性,可以通过影响土壤N∶P进而影响固氮微生物多样性与群落结构;⑤ 绝大部分N∶P指示种与海拔指示种的相对丰度与N∶P、海拔表现出类似的相关性,且具有较高比例(45%)的重合。

图5 固氮微生物优势属的相对丰度与N∶P的相关性

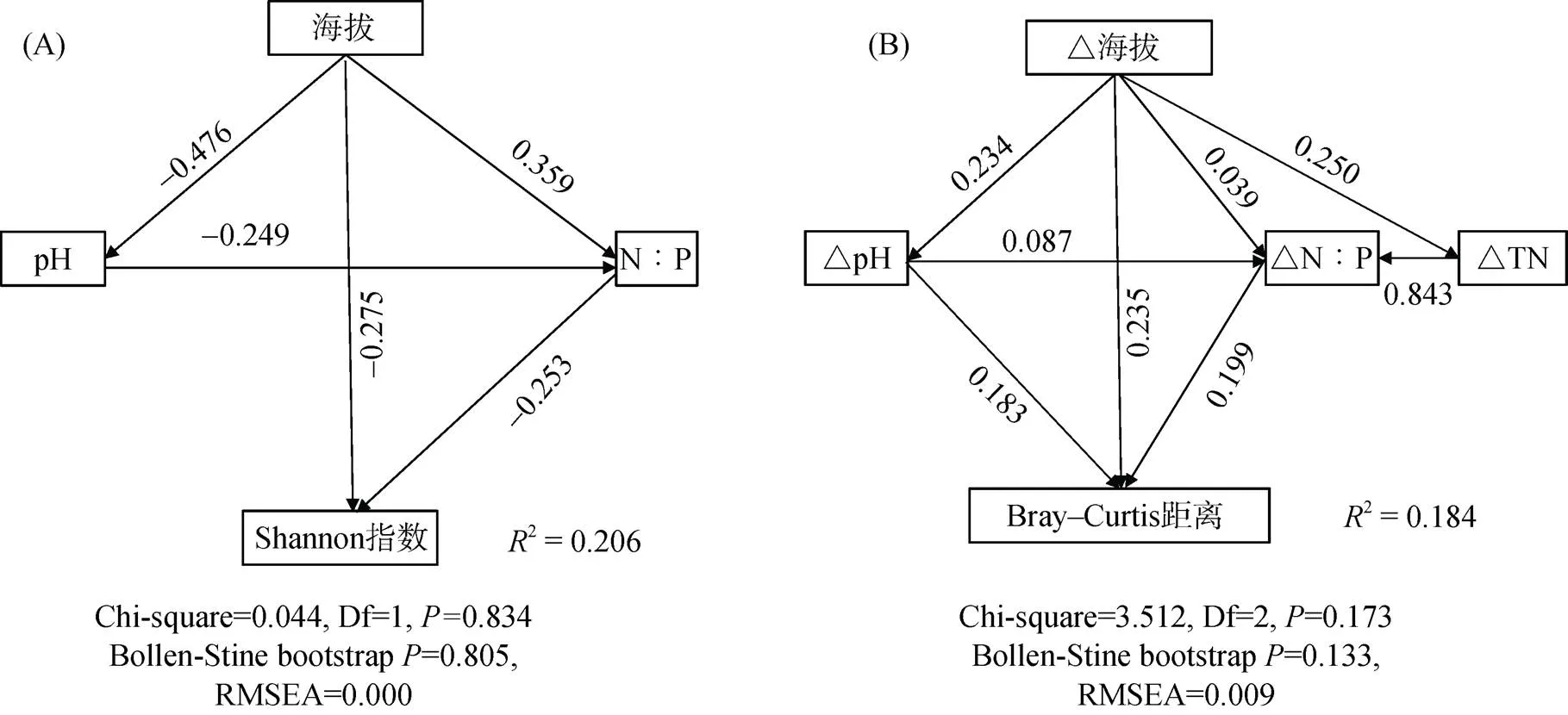
(箭头上的数字是标准化路径系数(Estimate),图中所有路径都是显著的(P<0.05),R2表示模型所解释的比例。固氮微生物多样性由Shannon指数代替,固氮微生物群落结构由Bray-Curtis距离代替。Df表示自由度;△海拔表示海拔差值;△N∶P表示氮磷比差值;△pH表示pH差值;△TN表示全氮差值)
由于生态位偏好、寿命和传播能力的不同,微生物的生物地理格局会随着距离的不同而发生定量变化[30]。氮、磷元素往往制约着森林生态系统的固氮微生物及其固氮作用,具体表现为土壤氮含量较高时或磷含量较低时会抑制一些固氮菌的生长,进而抑制生物固氮(氮限制或磷限制)[29]。这类元素可能会诱导不同固氮微生物的生态位偏好差异[15, 28]。例如慢生根瘤菌属,其相对丰度随土壤N∶P增大而增加,研究发现这类固氮菌具有广泛的生态位,可以进行非共生固氮[31-32], 因此即使是高N∶P(氮限制或磷限制)等条件下该类固氮菌也能生存,进而维持高海拔地区银杏的生物固氮。此外,本研究中地杆菌属在氮等养分含量较低的低海拔区域相对富集。该属为非共生固氮菌,研究发现在长期施肥下地杆菌属被显著地抑制,进而影响生态系统的固氮效率[33],而在营养贫瘠的环境中其更容易生存并进行氮固定[34]。因此,地杆菌属可能是天目山低海拔处银杏进行生物固氮的重要物种。但同样被视为寡养生物的疣微菌属,本研究中却更适应生活在高海拔、高土壤养分的银杏根区,两者之间的差异仍需要进一步的研究。
除关键因子的作用外,其他因子对银杏根区土壤固氮微生物群落的海拔分布也有一定的影响。如大部分海拔指示种的相对丰度与表示土壤碳与氮含量的因子(如DOC、DON、TC、TN)显著相关,且这种相关性与指示种对海拔变化的响应类似。表明土壤碳、氮、磷间的耦合作用对银杏根区土壤固氮微生物群落分布特征具有潜在影响。这与Zheng等[29]发现的森林生物固氮的变化主要受基质C∶N和C∶(N∶P)主导这一结果相呼应。此外,pH对森林生态系统中固氮微生物的空间分布有着不可忽视的作用[17,28]。本研究中,结构方程模型表明,海拔显著影响土壤pH,而pH又可以通过影响N∶P进而影响固氮微生物多样性与群落组成变化。其中,海拔对固氮微生物多样性和群落组成的直接影响均为最大,暗示了随海拔升高而下降的温度可能对固氮微生物造成重要影响。类似地,在纬度梯度上,Zhou等[35]发现,土壤固氮微生物多样性在森林生态系统中随温度梯度显著变化。此外,随着海拔的抬升,山地森林的多层级结构则在更小的尺度上形成了微气候效应[36],这种微气候变化对当地物种多样性具有一定的影响。例如,研究发现微气候的变化造成了两栖动物群落在跨越几米的微气候梯度上的突然变化[37]。值得注意的是,银杏个体的功能性状,如胸径和性别,对固氮微生物群落组成亦有一定的影响,暗示了植物个体本身对其邻近土壤微生物的塑造作用[18]。因此,尽管N∶P主导了本研究中银杏根区土壤固氮微生物的海拔分布模式,但是与海拔协同变化的温度、微气候效应以及银杏本身特征也可能在海拔梯度的背后发挥重要作用。
4 结论
天目山野生银杏根区土壤固氮微生物多样性与群落组成沿海拔梯度显著变化。土壤N∶P与固氮微生物多样性显著负相关,且与固氮微生物群落组成变化、优势属的相对丰度以及高低海拔生境的指示种的相对丰度显著相关。土壤N∶P是决定天目山野生银杏根区土壤固氮微生物群落沿海拔规律性分布的关键因素。
[1] Chu H Y, Gao G F, Ma Y Y, et al. Soil microbial biogeography in a changing world: Recent advances and future perspectives[J]. mSystems, 2020, 5(2): e00803–e00819.
[2] 褚海燕, 申聪聪. 绘制土壤微生物蓝图: 土壤微生物地理学[J]. 科学观察, 2017, 12(6): 54–56.
[3] Zhang Y G, Cong J, Lu H, et al. Soil bacterial diversity patterns and drivers along an elevational gradient on Shennongjia Mountain, China[J]. Microbial Biotechnology, 2015, 8(4): 739–746.
[4] Shen C C, Gunina A, Luo Y, et al. Contrasting patterns and drivers of soil bacterial and fungal diversity across a mountain gradient[J]. Environmental Microbiology, 2020, 22(8): 3287–3301.
[5] Singh D, Takahashi K, Kim M, et al. A hump-backed trend in bacterial diversity with elevation on Mount Fuji, Japan[J]. Microbial Ecology, 2012, 63(2): 429–437.
[6] Fierer N, McCain C M, Meir P, et al. Microbes do not follow the elevational diversity patterns of plants and animals[J]. Ecology, 2011, 92(4): 797–804.
[7] Shen C C, Liang W J, Shi Y, et al. Contrasting elevational diversity patterns between eukaryotic soil microbes and plants[J]. Ecology, 2014, 95(11): 3190–3202.
[8] Ni Y Y, Yang T, Zhang K P, et al. Fungal communities along a small-scale elevational gradient in an alpine tundra are determined by soil carbon nitrogen ratios[J]. Frontiers in Microbiology, 2018, 9: 1815.
[9] Mirza B S, Potisap C, Nüsslein K, et al. Response of free-living nitrogen-fixing microorganisms to land use change in the Amazon rainforest[J]. Applied and Environmental Microbiology, 2014, 80(1): 281–288.
[10] Shay P E, Winder R S, Trofymow J A. Nutrient-cycling microbes in coastal Douglas-fir forests: Regional-scale correlation between communities,climate, and other factors[J]. Frontiers in Microbiology, 2015, 6: 1097.
[11] Wang J J, Meier S, Soininen J, et al. Regional and global elevational patterns of microbial species richness and evenness[J]. Ecography, 2017, 40(3): 393–402.
[12] Liu X, Yang T, Shi Y, et al. Strong partitioning of soil bacterial community composition and co-occurrence networks along a small-scale elevational gradient on Zijin Mountain[J]. Soil Ecology Letters, 2021, 3(4): 290–302.
[13] Shen C C, He J Z, Ge Y. Seasonal dynamics of soil microbial diversity and functions along elevations across the treeline[J]. Science of the Total Environment, 2021, 794: 148644.
[14] Wang Y S, Li C N, Shen Z H, et al. Community assemblage of free-living diazotrophs along the elevational gradient of Mount Gongga[J]. Soil Ecology Letters, 2019, 1(3/4): 136–146.
[15] Reed S C, Cleveland C C, Townsend A R. Functional ecology of free-living nitrogen fixation: A contemporary perspective[J]. Annual Review of Ecology, Evolution, and Systematics, 2011, 42: 489–512.
[16] Sasse J, Martinoia E, Northen T. Feed your friends: Do plant exudates shape the root microbiome? [J]. Trends in Plant Science, 2018, 23(1): 25–41.
[17] Tu Q C, Deng Y, Yan Q Y, et al. Biogeographic patterns of soil diazotrophic communities across six forests in North America[J]. Molecular Ecology, 2016, 25(12): 2937–2948.
[18] Yang T, Tedersoo L, Soltis P S, et al. Phylogenetic imprint of woody plants on the soil mycobiome in natural mountain forests of Eastern China[J]. The ISME Journal, 2019, 13(3): 686–697.
[19] Yang T, Weisenhorn P, Gilbert J A, et al. Carbon constrains fungal endophyte assemblages along the timberline[J]. Environmental Microbiology, 2016, 18(8): 2455–2469.
[20] Yang T, Tedersoo L, Fu X, et al. Saprotrophic fungal diversity predicts ectomycorrhizal fungal diversity along the timberline in the framework of island biogeography theory[J]. ISME Communications, 2021, 1: 15.
[21] Guan R, Zhao Y P, Zhang H, et al. Draft genome of the living fossil[J]. GigaScience, 2016, 5(1): s13742–16.
[22] 孙立民, 刘晓静, 邢世岩, 等. 浙江省古银杏资源调查与生长特性分析[J]. 林业科技开发, 2015, 29(1): 118–122.
[23] Crane P R. An evolutionary and cultural biography of[J]. Plants, People, Planet, 2019, 1(1): 32–37.
[24] Hsu S F, Buckley D H. Evidence for the functional significance of diazotroph community structure in soil[J]. The ISME Journal, 2009, 3(1): 124–136.
[25] 杨腾, 褚海燕. 结构方程模型在土壤微生物生态学中的应用[J]. Bio-protocol, 2021: e2003678.
[26] Shen C C, Ni Y Y, Liang W J, et al. Distinct soil bacterial communities along a small-scale elevational gradient in alpine tundra[J]. Frontiers in Microbiology, 2015, 6: 582.
[27] Bryant J A, Lamanna C, Morlon H, et al. Colloquium paper: Microbes on mountainsides: Contrasting elevational patterns of bacterial and plant diversity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(Suppl 1): 11505–11511.
[28] Zhao W Q, Kou Y P, Wang X H, et al. Broad-scale distribution of diazotrophic communities is driven more by aridity index and temperature than by soil properties across various forests[J]. Global Ecology and Biogeography, 2020, 29(12): 2119–2130.
[29] Zheng M H, Chen H, Li D J, et al. Substrate stoichiometry determines nitrogen fixation throughout succession in southern Chinese forests[J]. Ecology Letters, 2020, 23(2): 336–347.
[30] Meyer K M, Memiaghe H, Korte L, et al. Why do microbes exhibit weak biogeographic patterns? [J]. The ISME Journal, 2018, 12(6): 1404–1413.
[31] VanInsberghe D, Maas K R, Cardenas E, et al. Non-symbioticecotypes dominate North American forest soils[J]. The ISME Journal, 2015, 9(11): 2435–2441.
[32] Tao J J, Wang S S, Liao T H, et al. Evolutionary origin and ecological implication of a unique nif island in free-livinglineages[J]. The ISME Journal, 2021, 15(11): 3195–3206.
[33] Fan K K, Delgado-Baquerizo M, Guo X S, et al. Suppressed N fixation and diazotrophs after four decades of fertilization[J]. Microbiome, 2019, 7: 143.
[34] Bazylinski D A, Dean A J, Schüler D, et al. N2-dependent growth and nitrogenase activity in the metal-metabolizing bacteria,andspecies[J]. Environmental Microbiology, 2000, 2(3): 266–273.
[35] Zhou J Z, Deng Y, Shen L N, et al. Temperature mediates continental-scale diversity of microbes in forest soils[J]. Nature Communications, 2016, 7: 12083.
[36] de Frenne P, Lenoir J, Luoto M, et al. Forest microclimates and climate change: Importance, drivers and future research agenda[J]. Global Change Biology, 2021, 27(11): 2279–2297.
[37] Basham E W, Seidl C M, Andriamahohatra L R, et al. Distance-decay differs among vertical strata in a tropical rainforest[J]. The Journal of Animal Ecology, 2019, 88(1): 114–124.
Elevational Distribution of Soil Diazotrophic Community in Root Zone ofin Tianmu Mountain
WU Di1,2, YANG Teng1, LIN Chenfeng3, FU Xiao1,2, ZHAO Yunpeng3, CHU Haiyan1,2*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China; 3 Laboratory of Systematics and Evolutionary Botany and Biodiversity, College of Life Sciences, Zhejiang University, Hangzhou 310058, China)
The elevational distribution of soil microbial diversity has been extensively studied, however, the distribution pattern of soil diazotrophic community along elevational gradient in root zone of a single woody plant is still unclear.Based on the Illumina high-throughput sequencing, soil diazotrophic diversity, community composition and spatial distribution in root zone of 161trees with elevation from 308 m to 1 236 m in the Tianmu Mountain, Zhejiang Province were investigated. The results show that diazotrophic diversity (Shannon and Richness indexes) significantly decreases along elevation. Diazotrophic community dissimilarity increases with the increase in elevation distance, and relative abundances of dominant genera such asare significantly and positively correlated with elevation, while relative abundances of the genera such asandare significantly and negatively correlated with elevation. Besides, both diazotrophic diversity and community composition are mostly correlated with soil N∶P ratio. In addition, relative abundances of dominant diazotrophic genera are significantly correlated with soil N∶P ratio. Structural equation modelling analyses show that elevation can directly or indirectly affect diazotrophic diversity and community composition by affecting soil N∶P ratio. Random forest model analysis identifies species clusters are closely related to elevation and N∶P ratio, respectively, and these two clusters have a large proportion (45%) of overlap. In summary, soil N∶P ratio is the key factor in determining elevational distribution of soil diazotrophs in root zone ofin the Tianmu Mountain, and the change in soil N∶P ratio can directly affect diazotrophic community of. Our findings provide scientific basis in the conservation of wildin the Tianmu Mountain from the view point of soil microbiology.
Soil diazotrophs; Elevation; Tianmu Mountain;
S154.3
A
10.13758/j.cnki.tr.2022.05.012
吴狄, 杨腾, 林臣峰, 等. 天目山银杏根区土壤固氮微生物群落沿海拔梯度的分布特征. 土壤, 2022, 54(5): 958–967.
国家自然科学基金项目(31461123001,41907039)和国家重点研发计划重点专项项目(2017YFC0504002) 资助。
(hychu@issas.ac.cn)
吴狄(1996—),男,安徽宿州人,硕士研究生,主要从事土壤微生物生态学研究。E-mail: wudi@issas.ac.cn
——固氮微生物

